肿瘤乏氧靶向响应的罗丹明荧光探针及其成像介导手术治疗
2021-10-15王萌萌栾天骄杨铭焱吕佳佳李洪玉袁泽利
王萌萌,栾天骄,杨铭焱,吕佳佳,高 杰,李洪玉,卫 钢,袁泽利
(1.遵义医科大学药学院,基础药理教育部重点实验室,特色民族药教育部国际联合实验室,贵州省生物催化与手性药物重点实验室,贵州省医用光学诊疗技术与创新药物研究国际科技合作基地,遵义563000;2.澳大利亚联邦科学与工业组织(CSIRO),新南威尔士州2070)
术前的分子影像诊断信息(如放射性核素成像、磁共振成像等)、术中的视觉检查(如组织的色泽、质地、形态特征)、术中的扪诊及术中的病理组织切片为综合判断肿瘤切除位置和切除范围提供了有效信息[1,2].然而,由于受视觉检查和扪诊受术者临床经验的影响,而且病理组织冰冻切片取材有限、病变组织在冰冻过程中会形成结晶、组织处理和诊断时间紧迫,使其结果的准确性受到影响.因此,术前的分子影像诊断为肿瘤切除提供了最为准确、有效和可靠的信息,但这些设备无法在手术中实时指导精准切除肿瘤,长时间运行时对患者和手术者的影响因素也不可忽视.因此,发展客观、安全、实时和可行的术中介导肿瘤切除新方法十分重要[3~5].为此,研究者们基于正电子计算机发射断层扫描(PET)[6,7]、光声成像(PAI)[5,8]及荧光成像(FLI)[9,10]等技术进行了相关研究.在这些研究中,FLI是基于分子影像学发展起来的肿瘤诊疗新技术,在肿瘤早期诊断和术中导航中发挥实时、非侵入式、特异性示踪与探测的功能[3~5,9,10].如吲哚菁(ICG)已被批准临床应用,并取得一定数量的临床成功病例,但由于给药时间和给药剂量难以精准控制,使其临床广泛应用受到限制[11].同时,ICG在体内递送时其荧光一直处于“Turn on”状态,荧光信号在正常组织和肿瘤组织中的显像差异不明显[12,13],影响术者精准实时界定肿瘤边缘.此外,ICG的局部累积、代谢慢和组织毒性过大等问题也引起了关注[11].因此,探寻高效、安全、给药时间与剂量明晰、能在正常组织和肿瘤组织产生易辨别的“Off-On”荧光成像的探针备受研究者们青睐[14,15].
肿瘤的乏氧程度与偶氮还原酶等还原物质的局部浓度密切相关[16,17],偶氮还原酶可引发偶氮苯(N=N—Ar)衍生物分子切割.同时,在常氧条件下,含偶氮苯的荧光团被激发,使其围绕N=N偶氮键的快速构象翻转导致荧光猝灭,故基于N=N的肿瘤乏氧敏感荧光探针设计备受关注[18,19].迄今,精确介导术中切除肿瘤的N=N荧光探针鲜见报道[20].为此,鉴于罗丹明染料具有水溶性好、荧光量子产率高、摩尔消光系数大以及叔氮正离子的线粒体靶向等特性[21],本文在已合成的系列罗丹明诊疗联用探针研究的基础上[22],设计了一个偶氮乏氧特异响应的荧光“Off-On”型肿瘤乏氧荧光成像探针(FY-4);通过分子、细胞和活体3个层面研究其乏氧特异选择性、靶向性、荧光成像性能及荧光成像介导切除肿瘤的潜能;并在此基础上通过细胞毒性、生物相容性、血清指标测试和主要脏器的H&E染色实验考察了其生物安全性.结果表明,探针FY-4具有高的靶向肿瘤特异乏氧响应性显像差异和优异的FLI介导切除肿瘤潜能,结合其良好的光物理性能、生物安全性和明晰的给药时间与剂量等特性,有望为生物医学FLI介导肿瘤切除提供新的研究工具.
1 实验部分
1.1 试剂与仪器
所用试剂和药品均购自安耐吉或百灵威试剂公司,未经特别说明均为分析纯.
Varian 1000 FT-IR型红外光谱仪(美国瓦里安公司);Nightowl LB 983型小动物活体成像仪(德国Berthold公司);Micromass LCT PremierXE型高分辨质谱仪(德国布鲁克公司);安捷伦400 MHz-DD2型磁共振仪(美国安捷伦公司);WD-2102B型全自动酶标仪(北京六一生物科技有限公司);CKX41型倒置显微镜(日本Olympus公司);1260高效液相色谱仪(美国安捷伦公司);QB-9001型微孔板快速振荡器(上海泸粤明科学仪器有限公司);CM1950型冷冻切片机(德国Leica公司);27310型乏氧小室(美国Stemcell公司);全波长扫描式多功能读数仪(美国Thermo公司).
1.2 实验方法
1.2.1 探针合成探针FY-4的合成路线示于图S1(见本文支持信息)中.
N,N-二(氯乙基)苯胺(1)的合成:参照文献[22,23]方法,将10 g(0.055 mol)N,N-二羟乙基苯胺缓慢滴入冰浴冷却的10.2 mL(0.11 mol)三氯氧磷中,然后在氦气气氛下,于110℃回流反应3 h;停止反应,冷却,将反应液倒入50 mL苯中,用饱和氯化钠溶液和水洗涤2~3次,用无水Na2SO4干燥,有机层经旋转蒸干后,用二氯甲烷溶解重结晶,得到淡紫色固体化合物1,产率92.0%.1H NMR(400 MHz,CDCl3),δ:7.32~7.28(m,2H,Ar-H),6.83~6.79(m,1H,Ar-H),6.73~6.71(d,J=7.7 Hz,2H,Ar-H),3.76~3.73(m,4H,—CH2—),3.67-3.64(m,4H,—CH2—).13C NMR(100 MHz,CDCl3),δ:146.01,129.76,129.74,117.66,111.92,53.45,40.46,40.42.
化合物2的合成:参照文献[22,23]方法,将1.0 g(0.7 mmol)3-羟基-N,N-二乙基苯胺和0.9 g(6 mmol)邻苯二甲酸酐加至30 mL甲苯中,于110℃搅拌回流反应8 h,抽滤得紫红色固体,用乙醇重结晶得紫红色固体化合物2,产率88.6%.1H NMR(400 MHz,CDCl3),δ:13.02(s,1H,COOH),12.48(s,1H,OH),7.86~7.88(d,1H,J=7.6 Hz,Ar-H),7.57~7.61(t,1H,J=7.3 Hz,Ar-H),7.50~7.53(t,1H,J=7.4 Hz,Ar-H),7.28~7.30(d,1H,J=7.3 HZ,Ar-H),6.68~6.71(d,1H,J=9.1 Hz,Ar-H),6.08~6.10(d,1H,J=9.1 Hz,Ar-H),5.98(s,1H,Ar-H),0.98~1.01(t,6H,J=6.7 Hz,CH3).13C NMR(100 MHz,CDCl3)δ:198.66,167.29,165.01,153.82,140.37,134.60,132.38,130.23,130.00,129.76,128.03,109.58,104.33,96.63,44.38,12.83.
中间体FY的制备:参照文献[24,25]方法,将0.64 g(4 mmol)6-氨基-1,2,3,4-四氢-1-萘酮缓慢滴入冰浴冷却的40 mL浓硫酸中,搅拌5 min,而后将1.39g(3 mmol)化合物2加入到上述体系中,升温至90℃,用薄层色谱监测反应完全;冷却,将反应液倾入150 g冰中,加入2 mL高氯酸,搅拌过夜,过滤即得紫黑色固体FY,产率90%.1H NMR(400 MHz,CDCl3),δ:8.17~8.19(d,1H,J=7.8 Hz,Ar-H),8.10~8.12(d,1H,J=8.8 Hz,Ar-H),7.83~7.87(t,J=7.5 Hz,Ar-H),7.73~7.77(t,1H,J=7.6 Hz,Ar-H),7.39~7.41(d,H,J=7.5 Hz,Ar-H),7.18(s,1H,Ar-H),7.04~7.06(d,1H,J=9.3 Hz,Ar-H),6.83~6.85(d,1H,J=9.3 Hz,Ar-H),6.72~6.74(d,1H,J=8.8 Hz,Ar-H),6.51(s,1H,Ar-H).13C NMR(100 MHz,CDCl3),δ:174.89,164.43,161.08,156.81,156.75,153.54,146.19,129.54,129.24,129.12,118.69,114.55,114.01,113.77,112.07,95.51,44.90,26.87,23.69,11.32.HR-MS(ESI-MS)calcd.for C28H27N2O3[M+H]+:440.2094,found:440.2060.
目标探针FY-4的制备:在氮气气氛下,将0.44 g(1 mmol)化合物FY加入至20 mL乙腈/水(体积比1∶1)混合液中,于0℃搅拌下加入75 mg(1.05 mmol)亚硝酸钠,再加入115 mg(1 mmol)三氟乙酸,继续搅拌30 min,然后加入含435 mg(2 mmol)化合物1的乙腈溶液,继续于0℃下搅拌4 h,而后向反应液中加入蒸馏水100 mL,用二氯甲烷萃取并经无水硫酸钠除水后,经硅胶柱分离[洗脱剂V(甲醇)∶V(二氯甲烷)=1∶50~1∶20],得到蓝色固体FY-4,产率58.24%.1H NMR(400 MHz,DMSO-d6),δ:7.95~8.01(dd,2H,J=17.1,7.9 Hz,Ar-H),7.75~7.82(m,4H,Ar-H),7.64~7.70(dd,2H,J=15.8,8.3 Hz,Ar-H),7.35~7.35(d,1H,J=7.6 Hz,Ar-H),6.93~6.95(d,2H,J=9.1 Hz,Ar-H),6.58~6.59(d,1H,J=1.9 Hz,Ar-H),6.43~6.50(m,2H,Ar-H),3.85~3.86(d,4H,J=5.9 Hz,CH2),3.80~3.81(d,4H,J=5.5 Hz,CH2),3.35~3.37(d,4H,J=7.0 Hz,CH2),2.78~2.90(m,2H,CH2),1.96~2.04(m,1H,CH2),1.72~1.81(m,1H,CH2),1.08~1.12(t,6H,J=6.9 Hz,CH3).HR-MS(ESI-MS)calcd.for C38H37Cl2N4O3[M+]:667.2237,found:667.2263.
1.2.2 光谱与HPLC测试将FY及FY-4分别用二甲基亚砜(DMSO)配制成1 mmol/L的储备液,测试溶液浓度为10 μmol/L.选择性测试所用各种干扰离子均为钠盐或钾盐,Cys测试浓度为1 mmol/L,GSH浓度为1 mmol/L,其它还原性物质的浓度均为1 mmol/L,其它干扰离子测试浓度为100 μmol/L,测试溶液为磷酸盐缓冲溶液(PBS,10 mmol/L,pH 7.4,含10%的DMSO).荧光光谱和吸收光谱均在25℃条件下测试,激发波长为570 nm,激发狭缝宽度为5 nm,发射狭缝宽度为2.5 nm.
将FY及FY-4分别用色谱纯甲醇配制成20 μmol/L待测液,再向探针测试液中加入5 mmol/L连二亚硫酸钠溶液.HPLC测试条件:在0~20 min,用30%~90%甲醇流动相进行梯度洗脱,再将流动相换为30%甲醇溶液,流速为1.0 mL/min,检测器波长为570 nm.
1.2.3 量子化学计算采用Gaussian 09 DO1量子化学程序包,并用密度泛函理论(DFT)计算方法,在B3LYP/6-311+G[2]水平上,对FY及FY-4的电子结构进行研究.全部计算在PentiumⅣ(3 GHz)计算机上完成.
1.2.4 细胞实验细胞培养:参照文献[22,23,26]方法,将L02细胞、4T1细胞、HeLa细胞和A549细胞在高糖培养基(体积分数为10%的胎牛血清+100 U/mL盘尼西林+100 mg/mL链霉素+4 mmol/LL-谷氨酰胺),于37℃体积分数为5%的CO2条件下培养.
细胞毒性实验:分别取处于对数生长期的4株受试细胞按照5×104个/mL接种于96孔板上,于37℃,5%的CO2培养箱中孵育24 h.将FY-4用细胞级的DMSO溶解后加入孔板中,终浓度分别为0,5,10,20,30,40,60,80和120 μmol/L,作用24 h后,加入20 μL 5 mg/L的MTT,4 h后弃去MTT,加入150 μL DMSO,于490 nm测OD值.按下式计算细胞存活率:
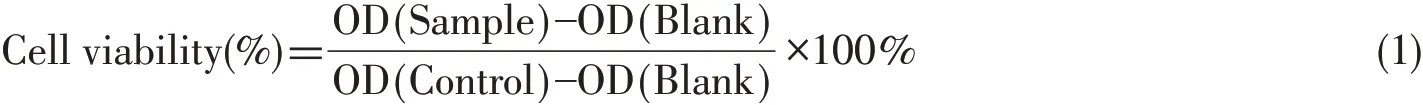
细胞乏氧毒性实验:除了向乏氧小室通入5%氧气和95%氮气的混合气体进行培养程序外,其余与常氧细胞毒性实验步骤相同.
细胞乏氧成像实验:分别取对数生长期的细胞按照1×105个/mL接种于96孔板上,于37℃,5%的CO2培养箱中孵育24 h,加入10 μmol/L FY-4后再孵育3 h,吸出培养液,用PBS溶液洗涤3次,每孔加入1 mL新鲜培养基.在板上设置常氧对照孔,其余每孔加上盖玻片制造乏氧环境,使偶氮还原酶过度表达,分别于不同乏氧时间后用倒置荧光显微拍摄成像.
细胞偶氮还原酶抑制乏氧成像实验:除分别加入0,0.025,0.05,0.1,0.15和0.20 μmol/L鱼藤酮作为抑制生成的偶氮还原酶外,其余步骤同细胞乏氧成像实验.
1.2.5 生物安全性实验4T1肿瘤模型的建立:将4T1细胞(1×106个/mL)接种于15~20 g雌性BABL/c小鼠皮下,待肿瘤长至适宜大小后,分别进行肿瘤原位注射或尾静脉注射FY-4,给药后于不同时间用NightOWLⅡLB983小动物活体成像系统进行成像,激发波长为570 nm,发射波长为620 nm.相同条件下开展注射PBS空白对照小鼠成像实验.
肝功和肾功血清指标测试:分别对上述成像7 d后的空白对照组和FY-4组的荷瘤小鼠经眼底动脉取血,送遵义医科大学附属医院检验科进行肝功能标志物[丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)]和肾功能标志物[肌酐(Cr)、尿肌酐(Ucrea)]测试.
H&E染色实验:将上述取血后的荷瘤小鼠处死后取其心、肝、脾、肺和肾,送教育部基础药理重点实验室进行H&E染色实验.
溶血性实验:参照前文[22,23]方法进行实验.
1.2.6 活体成像实验将建好的4T1肿瘤模型小鼠经麻醉后行切皮术露出肿瘤,经NightOWLⅡLB983小动物活体成像系统进行成像;再于肿瘤原位注射FY-4 30 min后,用NightOWLⅡLB983小动物活体成像系统进行成像.此后,行肿瘤切除术,与对照组肿瘤进行体外成像,成像后的肿瘤经冰冻切片后进行荧光成像.
2 结果与讨论
2.1 探针的设计合成及光学性能
为获得荧光“Turn off”的含N=N官能团罗丹明探针,以3-羟基-N,N-二乙基苯胺、邻苯二甲酸酐和6-氨基-1,2,3,4-四氢-1-萘酮为起始物,通过关环、中和、缩合反应得到中间体FY,再将其与N,N-二氯乙基苯胺进行偶氮反应制备目标探针FY-4[图1(A)].FY-4的结构经1H NMR,13C NMR和HRMS(ESIMS)确证为目标化合物(图S2~图S11,见本文支持信息).
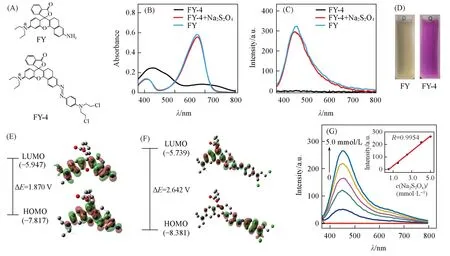
Fig.1 Structures of FY and FY⁃4(A),absobance(B)and fluorescence(C)spectra of FY,FY⁃4 and FY⁃4+Na2S2O4 in a mixture of PBS and DMSO buffer(volume ratio:9/1,pH=7.4)at room temperature,a visual change photograph of FY⁃4 and FY⁃4+Na2S2O4(D),schematic diagram for some calculated frontier molecular orbital energies of FY(E)and FY⁃4(F),and fluorescence spectral changes for FY⁃4(10 μmol/L)in the presence of different concentrations of Na2S2O4 in PBS/DMSO buffer(volume ratio:9/1,pH=7.4)(G)
FY和FY-4的吸收光谱和荧光光谱示于图1.由图1(B)可知,FY的最大吸收峰位于574 nm,较罗丹明B(图S13,见本文支持信息)红移22 nm[27].在荧光光谱[图1(C)]中,FY的荧光发射峰位于625 nm,较罗丹明B红移44 nm[27],表明经萘酮修饰可使罗丹明母核的吸收和发射峰波长红移.同时,FY的Stokes位移(51 nm)较罗丹明B增强23 nm,摩尔消光系数为6.4×104mol·cm−1·L−1,较罗丹明B增加了1.8倍[27],上述光物理性质表明FY的光学性能得到了改善.为得到乏氧下荧光由“Turn off”到“Turn on”的特异响应探针,在设计引入N=N官能团的同时,还将强吸电子的双氯乙基引入分子结构,降低体系电荷,实现了荧光完全猝灭.由图1(B)和(C)可以看出,FY-4在426和592 nm处出现了2个强度减弱的吸收峰,而荧光完全猝灭.
采用密度泛函方法[28,29]计算了FY和FY-4的最高占有分子轨道(HOMO)和最低空分子轨道(LUMO)[图1(E)和(F)].结果表明,FY的HOMO轨道主要分布在与N原子相连的苯环上,LUMO轨道则分布在吡喃环和苯环上.使FY的HOMO轨道电子跃迁到LUMO轨道上的CT(Charge transfer)转移效应较为明显[30~32].对于FY-4而言,在偶氮与氯原子的吸电子作用下,偶氮一侧的基团对LUMO贡献较小,而在HOMO轨道则主要分布在偶氮一侧的基团,即电子从HOMO跃迁到LUMO时,电子从偶氮一侧基团转移到吡喃基团,引起的CT转移效应较小,能量差减小,使FY-4荧光处于“Turn off”状态[30~32].
2.2 选择性及识别机理
为验证FY-4经偶氮还原断裂生成有荧光的中间体FY,以常用的连二亚硫酸钠作为还原物质进行了考察[33][图1(C)].同时,还考察了常见金属离子、阴离子对FY-4的吸收光谱和荧光光谱的影响(图S14,见本文支持信息).实验结果表明,仅有连二亚硫酸钠与FY-4作用后,在625 nm处出现了强的荧光发射峰,溶液颜色由淡黄色变为紫红色[图1(D)].同时,荧光强度随连二亚硫酸钠浓度的增加而增强,且在0.5~5.0 mmol/L之间呈良好的线性关系[图1(G)].此外,FY-4与连二亚硫酸钠作用在4 min内即可迅速完成[图2(A)].
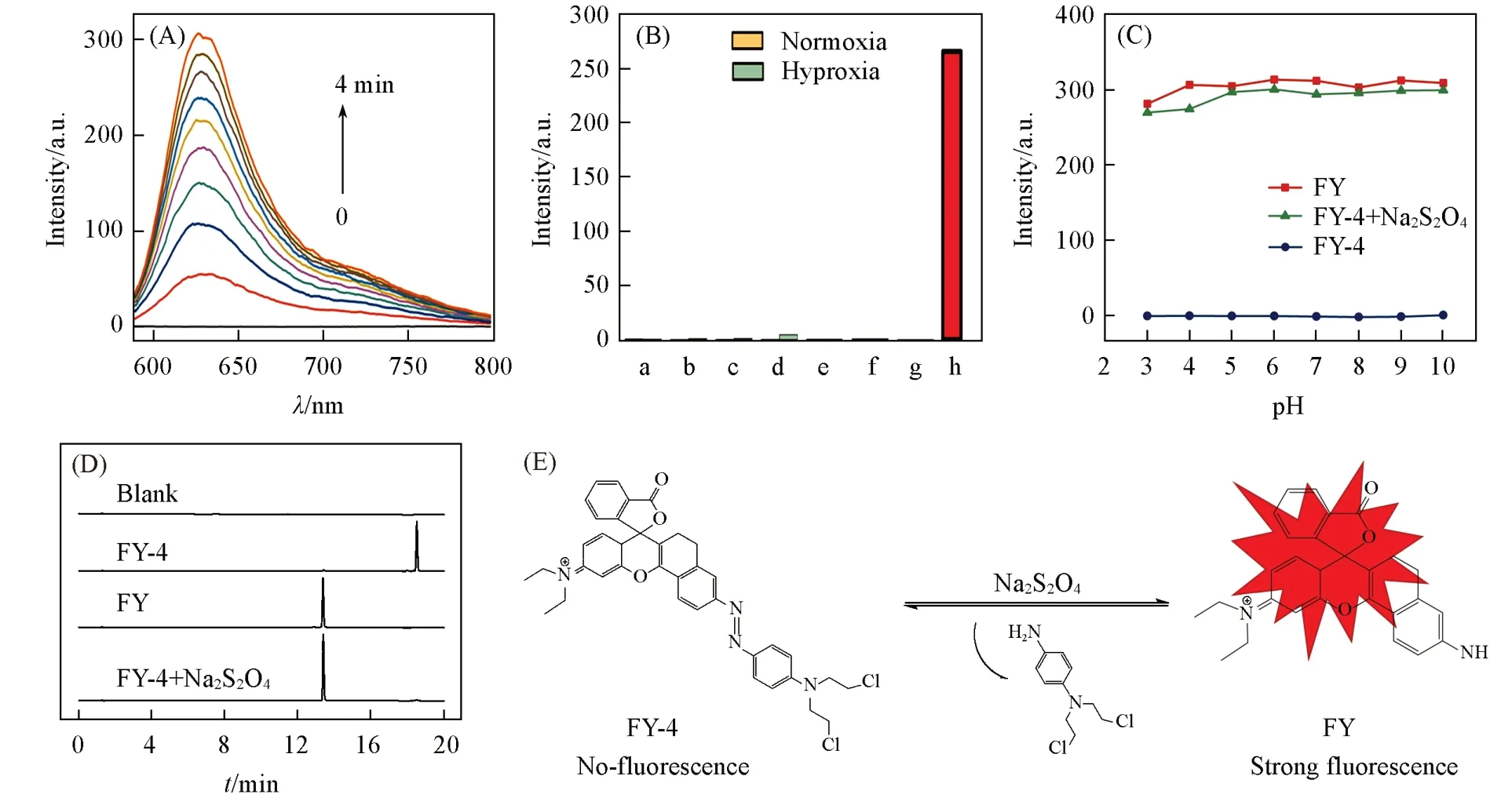
Fig.2 Fluorescence enhancement of FY⁃4(10 μmol/L)after treated with Na2S2O4(5 mmol/L)at various time(0—4 min)(A),fluorescent response of FY⁃4(10 μmol/L)to various reductants(B),fluores⁃cence intensity of FY,FY⁃4 and FY⁃4+Na2S2O4 at various ranges of pH in PBS/DMSO(volume ratio:9/1,pH=7.4)(C),HPLC chromatograms of FY,FY⁃4 and FY⁃4+Na2S2O4(D)and proposed fracture mechanism of FY⁃4 under Na2S2O4 environment(E)
实验中分别在常氧和乏氧条件下考察了还原型物质半胱氨酸、还原型烟酰胺腺嘌呤二核苷酸(还原辅酶I,NADH)、还原谷胱甘肽(GSH)、H2O2、HClO、半胱氨酸、葡萄糖及维生素C分别与FY-4作用后的荧光光谱[图2(B)].结果表明,它们均不能使FY-4的荧光恢复,表明这些物质不能使FY-4的偶氮键断裂.此外,FY,FY-4及FY-4与连二亚硫酸钠体系在pH=3~10的条件下,荧光强度均能保持稳定[图2(C)],表明FY-4可在较宽的pH范围内对连二亚硫酸钠进行选择性识别.
为证实FY-4对连二亚硫酸钠的荧光“Turn on”识别机理,对FY,FY-4及FY-4与连二亚硫酸钠混合液分别进行了HPLC测试[图2(D)].结果表明,FY和FY-4的出峰时间分别为13.4和18.5 min.当将FY-4与连二亚硫酸钠混合后,未发现18.5 min的峰,而在13.4 min出现了FY的峰,表明连二亚硫酸钠将FY-4的偶氮断裂生成了FY.将FY-4与连二亚硫酸钠混合液通过HRMS测试,发现了m/z=439.2022的FY准分子离子峰(图S12),结合吸收光谱、荧光光谱和HPLC分析结果,可推断FY-4识别连二亚硫酸钠的机理如图2(E)所示.
2.3 细胞毒性
低毒性是一个优良探针应用于生物体研究的必备条件,进行了FY-4对正常肝细胞L02及3株肿瘤细胞(4T1细胞、HeLa细胞和A549细胞)存活率实验(图S15和图S16,见本文支持信息).结果表明,即使FY-4浓度高达120 μmol/L,4株受试细胞在常氧和乏氧下的存活率均在95%以上,表明FY-4对受试细胞均具有低毒性,可应用于生物体研究.
2.4 细胞乏氧成像
为证实FY-4在乏氧下因偶氮还原酶表达,断裂N=N键使探针在肿瘤细胞中发生荧光“Turn on”,分别将FY-4与上述3株肿瘤细胞于不同乏氧时间共孵育后,进行荧光成像,实验结果示于图3、图S17及图S18(见本文支持信息).结果表明,FY-4分别与3株受试肿瘤细胞在不同乏氧时间共孵育后,均呈现乏氧时间越长,荧光强度越强的趋势.这是由于乏氧时间越长,偶氮还原酶的表达量越高[16,17,33,34],使FY-4偶氮键断裂生成的FY多,导致荧光强度增强.在乏氧共孵育8 h后,FY-4与A549细胞的荧光强度是HeLa细胞的1.4倍,是4T1细胞的2.4倍;而HeLa细胞的荧光强度是4T1细胞的1.7倍.这表明同样条件下,3株肿瘤细胞乏氧所致偶氮还原酶表达顺序为A549,HeLa及4T1.将正常肝细胞L02与FY-4在上述条件下共孵育却未见荧光恢复(图S19,见本文支持信息),说明正常细胞未有偶氮还原酶表达或其浓度不足以使N=N键断裂.
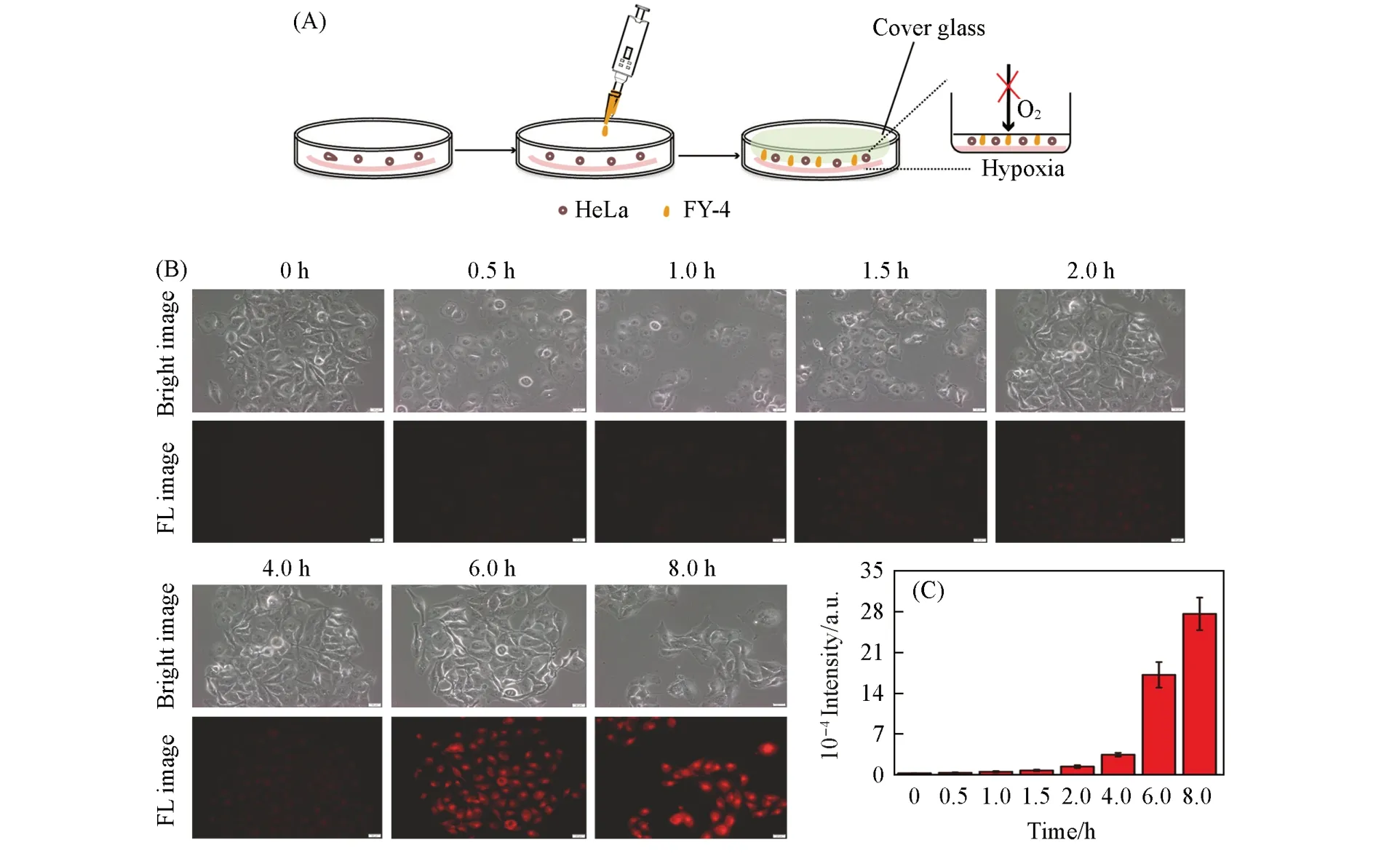
Fig.3 Schematic diagram of hypoxia experiment(A),fluorescence images(B)and intensities(C)of HeLa cell lines incubated with FY⁃4(10 μmol./L)under different incubating time
为佐证FY-4在乏氧下经偶氮还原酶断裂N=N键生成FY,采用偶氮还原酶的专一抑制剂鱼藤酮进行了考察[33,34],分别将不同浓度的鱼藤酮与上述3株肿瘤细胞及FY-4乏氧共孵育8 h后,进行荧光成像(图S20,见本文支持信息).结果表明,加入鱼藤酮后,3株受试细胞内的荧光均明显减弱.这表明鱼藤酮抑制了乏氧肿瘤细胞内的偶氮还原酶后,FY-4与偶氮还原酶发生切割反应生成的FY减少,进一步证实FY-4可用于肿瘤细胞乏氧荧光成像检测.
2.5 活体成像
鉴于FY-4的细胞低毒性和荧光成像探测肿瘤乏氧细胞的特异性,考察了其应用于活体肿瘤的荧光成像性能.在受试的3株肿瘤细胞中,由于4T1细胞在同样乏氧后引起的偶氮还原酶表达量最低,故为证实FY-4的应用潜能,建立了4T1细胞的BABL/c小鼠肿瘤模型,并进行了荧光成像性能研究.由图S21(见本文支持信息)可以看出,当在肿瘤部位原位注射FY-4后0.5 h即有荧光显现,2 h后荧光强度显著增强,至36 h仍可见清晰的荧光,且能显著明晰肿瘤组织和正常组织边界,表明FY-4可用于肿瘤活体荧光成像探测.肿瘤乏氧与实体瘤大小有关,实体瘤越大偶氮还原酶的表达量越高[33,34].为证明FY-4可应用于不同大小肿瘤的活体成像探测,以肿瘤尺寸为1.2 cm和0.6 cm的4T1荷瘤小鼠模型,原位注射FY-4后于不同时间点进行荧光成像(图4).
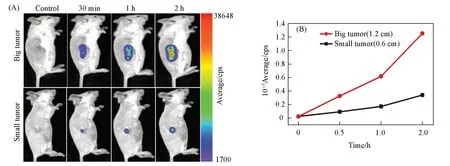
Fig.4 Real⁃time in vivo fluorescent images(A)and intensities(B)of different sized 4T1 tumor⁃bearing mice after the intratumoral injection of FY⁃4(100 μL,500 μmo/L)
由图4可见,注射同剂量的FY-4后,大、小肿瘤组织均能在30 min显示清晰的荧光,且随着时间增加,荧光成像显著增强;但体积大的肿瘤组织荧光强度增加更显著,给药2 h后,大体积肿瘤荧光强度是小体积肿瘤荧光强度的3.7倍[图4(B)],表明FY-4能够对不同乏氧程度的肿瘤进行荧光成像探测.
为考察FY-4在肿瘤组织的靶向富集性能,对4T1荷瘤小鼠模型经尾静脉注射FY-4后,于不同时间下进行荧光成像(图5).由图5(A)可以看出,尾静脉给药2 h后,在肿瘤组织处出现显著的荧光信号,4 h后荧光强度达最大值,12 h仍可见较为显著的荧光,且能清晰判断肿瘤组织边缘.这表明FY-4具有在肿瘤靶向富集和较长时间蓄积成像的性能,能满足肿瘤手术切除时间的需要.此外,为考察FY-4经尾静脉注射的生物分布,尾静脉注射10 h后,取小鼠主要脏器行荧光成像[图5(B)和(C)],表明FY-4主要经肾脏和肝脏代谢.
2.6 生物安全性
为证实FY-4的体内生物安全性,对上述尾静脉给药的4T1肿瘤模型小鼠和注射生理盐水的4T1肿瘤模型小鼠分别取其主要脏器进行H&E染色、血清生化指标及溶血性实验.
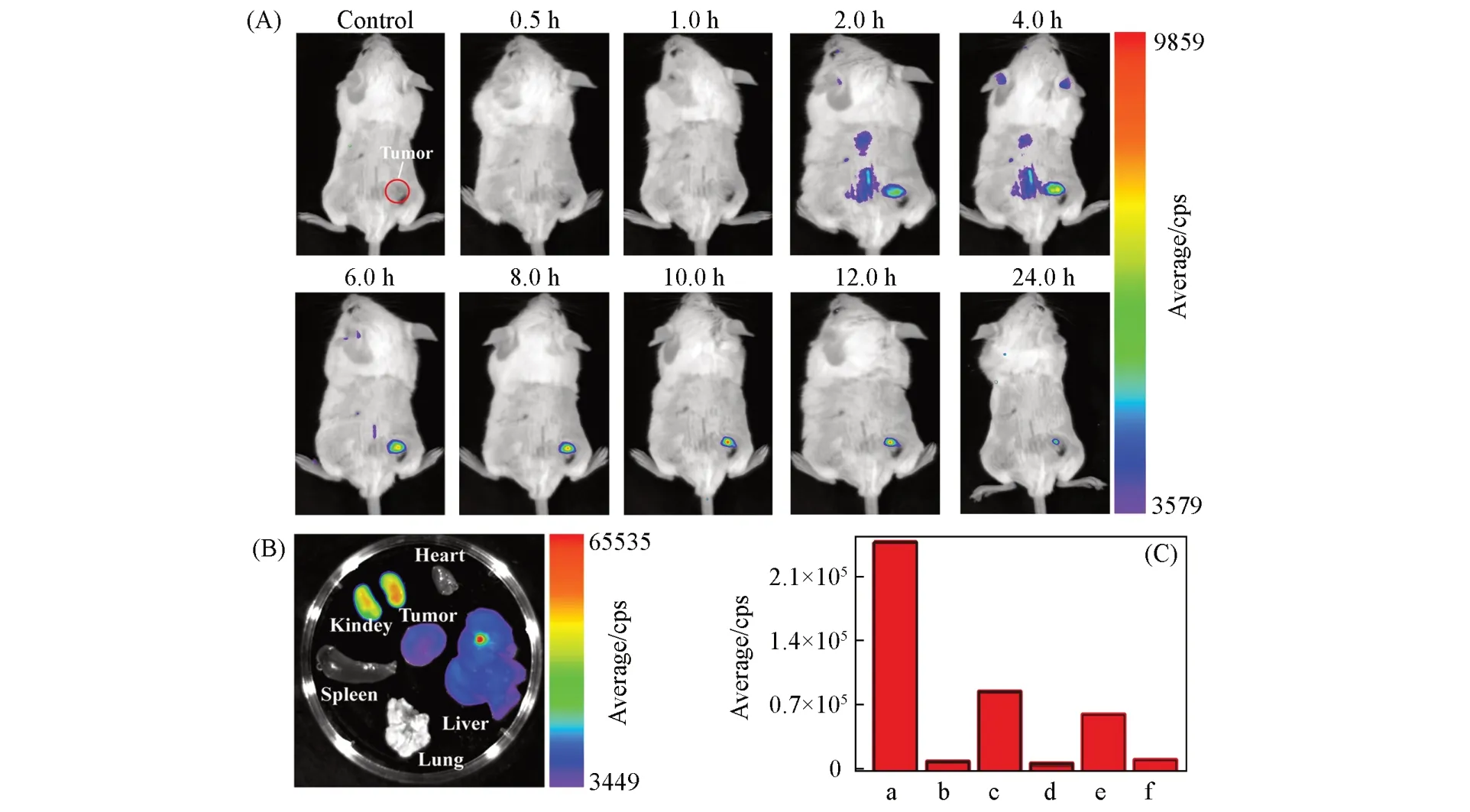
Fig.5 Real⁃time fluorescence images of 4T1 tumor⁃bearing mice after intravenous injection of FY⁃4(100 μL,2 mmol/L per mouse)for different time(A),bio⁃distribution(B)and the fluorescence intensity(C)of FY⁃4 in the heart,liver,spleen,lung,kidney,brain,and tumor tissues after tail⁃vein injection of FY⁃4(100 μL,2 mmol/L)for 10 h
由图6(A)可以看出,尾静脉注射FY-4第7 d后,小鼠主要脏器(心、肝、脾、肺、肾)的H&E染色未发现显著的病理征象,与生理盐水对照组也无显著性差异[22,23,35,36].小鼠血清肝功能标志物[丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)]和肾功能标志物[肌酐(Cr)、尿肌酐(Ucrea)]较生理盐水组未见显著改变[图6(B)~(E)][22,23,35,36].在FY-4对红细胞的溶血实验中(图S22,见本文支持信息),80 μmol/L的FY-4的溶血活性仅为2.53%,未出现明显的溶血作用.上述实验结果表明,FY-4经尾静脉给药后,在给药浓度下具有较好的生物安全性.
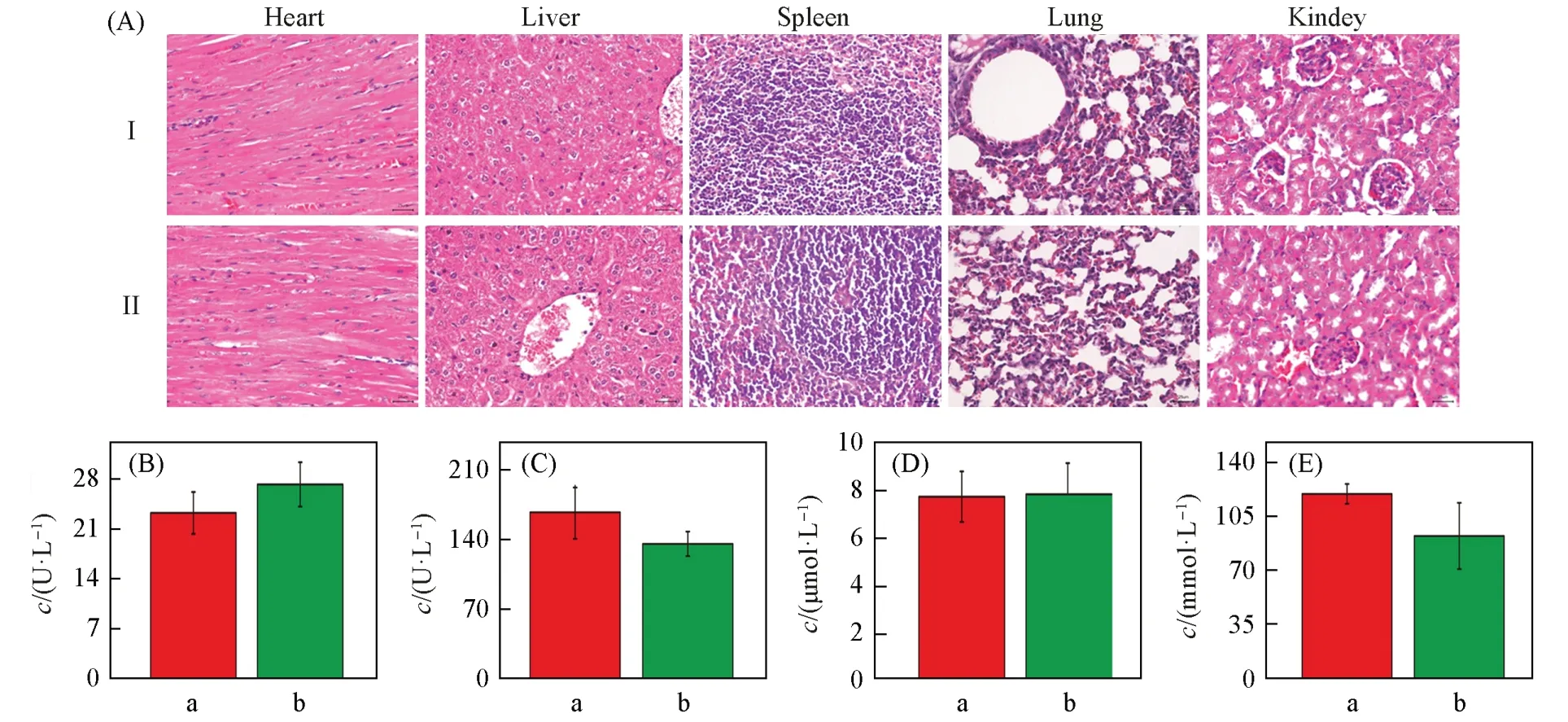
Fig.6 H&E staining of heart,liver,spleen,lung and kidney sections from mice bearing 4T1 tumors with different treatments(scars=20 μm)(A);blood biochemistry tests of ALT(B),AST(C),Cr(D)and Ucrea(E)from mice treated with different formulations
2.7 荧光成像介导手术切除肿瘤
鉴于FY-4的上述优良性能,进一步将其应用于荧光成像介导肿瘤切除.由图7(A)可以看出,在未注射FY-4时,肿瘤组织和正常组织均未现荧光,当注射FY-4 30 min后,在肿瘤组织出现了显著的荧光信号,且能清晰辨识肿瘤组织及其边缘.行肿瘤切除术后再行荧光成像,未见新的荧光组织,表明肿瘤完全切除.此外,另切除新的肿瘤和肿瘤周边正常组织,分别注射同样剂量的FY-4,30 min后肿瘤组织即可见显著的荧光信号[图7(B)],且肿瘤组织的荧光强度是肿瘤周边正常组织的8.44倍[图7(C)].将肿瘤组织和正常组织经冰冻切片后,进行组织荧光成像实验,由图7(D)可以看出,仅有肿瘤组织有强的荧光信号.以上结果表明,FY-4在术前30 min给药即可行荧光成像介导精准切除肿瘤.
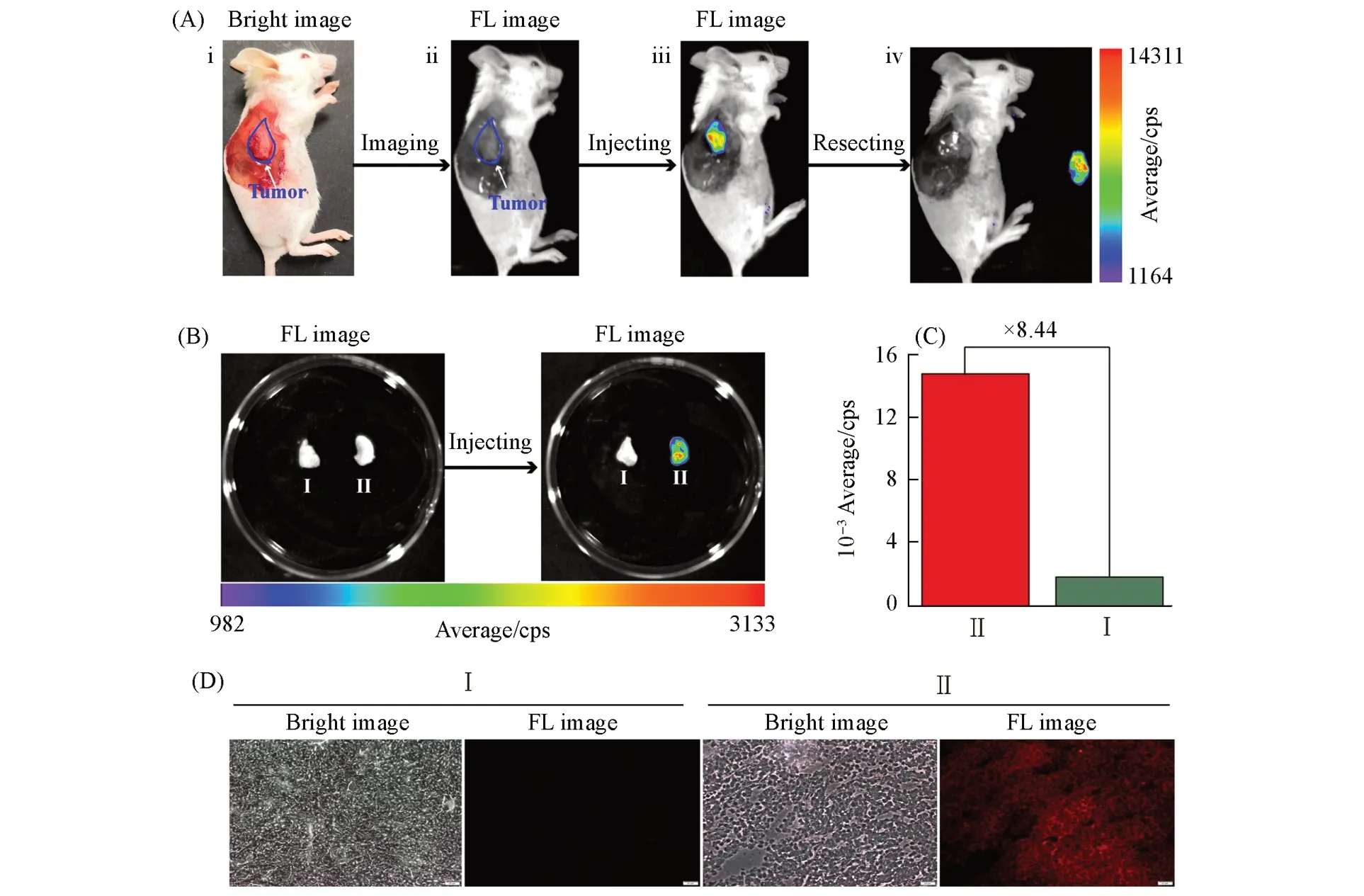
Fig.7 Illustrative fluorescence⁃guided surgery of a mice bearing a 4T1 tumor,30 min p.i.of FY⁃4(100 μL,500 μmol/L)(A),fluorescence images ofⅠandⅡthrough injecting FY⁃4(100 μL,500 μmol/L)for 30 min(B),statistical fluorescence intensities ofⅠandⅡ(C)and fluorescent images of tissue slicesⅠandⅡbased on(B)(D)
3 结 论
基于罗丹明的良好荧光性能,经关环、中和、缩合及偶氮反应制备并表征了一种偶氮乏氧特异响应的“Off-On”型靶向肿瘤乏氧荧光成像探针FY-4.通过分子设计改善了罗丹明结构的光物理性质,并将其成功应用于肿瘤靶向乏氧特异荧光成像及荧光成像介导精准切除肿瘤.FY-4在给药剂量下30 min内即可在肿瘤部位实现特异“Off-On”清晰显像、清晰界定肿瘤边缘,进而介导肿瘤精准切除,并还具有良好的光物理性能、生物安全性等潜在优势,有望为生物医学光学肿瘤成像诊断与介导肿瘤切除提供新的研究工具.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20210316.