医用制氧机使用期限的验证和分析及建议
2021-10-15李娟赖玉菡瞿倩张磊通信作者
李娟,赖玉菡,瞿倩,张磊(通信作者)
四川省药品检验研究院(四川省医疗器械检测中心) (四川成都 611731)
近年来,在针对医用制氧机的国家级抽验、省级抽验中,发现其氧浓度基本满足制造商公布的要求,但是针对在用制氧机的检验中,发现其氧浓度不能满足制造商公布的浓度要求。在注册型式检验中,针对绝大多数产品,均未对其寿命进行测试,仅依赖于企业说明书的声称。医用制氧机虽然不属于高值医疗器械,但是其使用场合广泛,且患者群体涉及面广。当产品存在质量问题时,若在保修期内,则有途径对问题进行解决;若已脱保,则往往维修困难;若产品持续工作,可靠性不足,性能指标降低,则可能对患者造成伤害。基于此,本研究对医用制氧机进行试验及质量分析,验证医用制氧机在其声称使用期限内关键性能参数的符合性,分析影响制氧机电气安全、性能、功能的关键指标,提出使用期限验证的基本方法与思路,通过分析验证结果,寻找影响制氧机使用期限的因素并给出改善建议供制造商参考,为有关单位的下一步抽验工作提供指导依据,为监管者提供监管依据。
1 试验方法及过程
医用制氧机主要由电子元器件组成,不同的电子元器件或组件有相应的使用期限,部分关键元器件会随时间产生累积的老化、磨损情况,而随着制氧机的持续老化和磨损,会导致设备效率下降,安全防护系统失效。
1.1 试验方法
本研究方案参考GB/T 34986-2017《产品加速试验方法》及相关文献[1-3],采用高加速应力试验(highly accelerated stress test,HAST),即为了缩短产品的试验时间而显著地增大施加在产品上的应力量值的试验。
1.2 试验过程
选取试验样品(医用制氧机均取得注册证),通过整机寿命加速试验分析验证的方法评价验证试验样品是否满足产品铭牌标识的使用期限(标识5年),为了方便同期对比,试验根据产品铭牌的寿命(或典型认可)——5年进行分析计算。
1.2.1寿命5年的分析计算过程
试验样品均为上市医疗器械,铭牌上均未标识运行模式,按GB 9706.1-2007《医用电气设备 第1部分:安全通用要求》6.1m)运行模式的要求,若无标记,则认为设备是连续运行;且小型医用制氧机使用场合多为门诊(非住院部,晚上不工作),按设备连续运行的模式,每天连续工作8 h,以一年250个工作日为工作时间作为计算依据,则寿命周期内的总工作时间为8×250×5=10 000 h,考虑到极限使用方式及使用频率的差异,取1.2倍裕量因子,则总试验时间为10 000×1.2=12 000 h。
1.2.2加速应力确定
整机加速寿命试验重点验证系统集成后整机的寿命,此部分验证对象均为电子电器类的部件,寿命周期内经历的环境应力主要为高温及高湿导致的老化失效。根据使用说明书宣称及GB 9706.1-2007中4.5的规定,医用制氧机的正常工作温度取23 ℃,湿度取60%RH,该设备使用的电子元器件中商业元器件的工作温度范围为0~+70 ℃,工业级元器件的工作温度范围为-40~+85 ℃。综合考虑元器件可维持正常工作的温、湿度范围,本次加速寿命试验应力选取60 ℃、80%RH的高温、高湿组合应力。
1.2.3加速因子计算
高温、高湿加速服从Hallberg-Peck模型(在阿伦尼斯模型基础上增加湿度应力的影响),加速因子计算如下:
其中,Tuse为正常条件下的温度(K),Tuse=23+273(K);Tstress为应力条件下的温度(K),Tstress=60+273(K);RHuse为正常条件下的湿度(%RH),RHuse=60%;RHstress为应力条件下的湿度(%RH),RHstress=80%;Ea为激活能,Ea=0.6 eV;m为湿度影响指数,m=2;KB为波尔兹曼常数,KB=8.6173×10-5eV/K。
将上述值代入模型中,即可求出加速因子约为24.26。
1.2.4整机加速试验时间计算
整机加速试验时间为总试验时间/加速因子,即12 000 h/24.26≈495 h(整机加速试验分为5个周期进行,每个周期的加速试验时间为495 h/5=99 h)
1.2.5试验样品数量统计
由于存在抽样风险,因此,为使试验结果具有统计意义,选取5台已上市医用制氧机进行整机测试。
1.2.6试验样品工作状态分析
在加速试验过程中,医用制氧机处于正常运行状态,在测试程序的控制下,模拟正常工作过程周期性循环运转。
1.2.7接受准则
基本电气安全(依据GB 9706.1-2007)应符合GB 9706.1-2007中条款7.1、15b)、19的要求。
基本性能(依据产品技术要求规定及实际使用需求),医用制氧机:氧浓度≥90%;试验过程中设备各部分应正常工作(判断设备各个控制部件功能是否完好,显示屏显示内容是否正常,是否影响正常操作功能,按钮操作是否准确,能否通过正常操作完成功能)。
在每个加速试验周期完成后,应对基本性能进行功能验证。
在进行整机加速寿命试验前应按照上述接受准则进行验证,符合准则要求后,再按照加速试验方案进行试验。
2 结果
整机加速寿命试验前、中、后的测试结果见表1~3。(1)试验中:在第1轮试验后,有1台样品氧浓度低于80%,随后每一轮试验后逐渐降低(第5轮试验后低于30%),其他功能和安全性均满足要求,该样品不满足1年的使用期限;另外1台样品在第3轮试验后氧浓度低于30%,其他功能和安全性均满足要求,该样品满足2年的使用期限,不满足整机5年使用期限。(2)试验后:有3台样品功能、性能、安全性均满足要求,符合整机5年的使用期限。
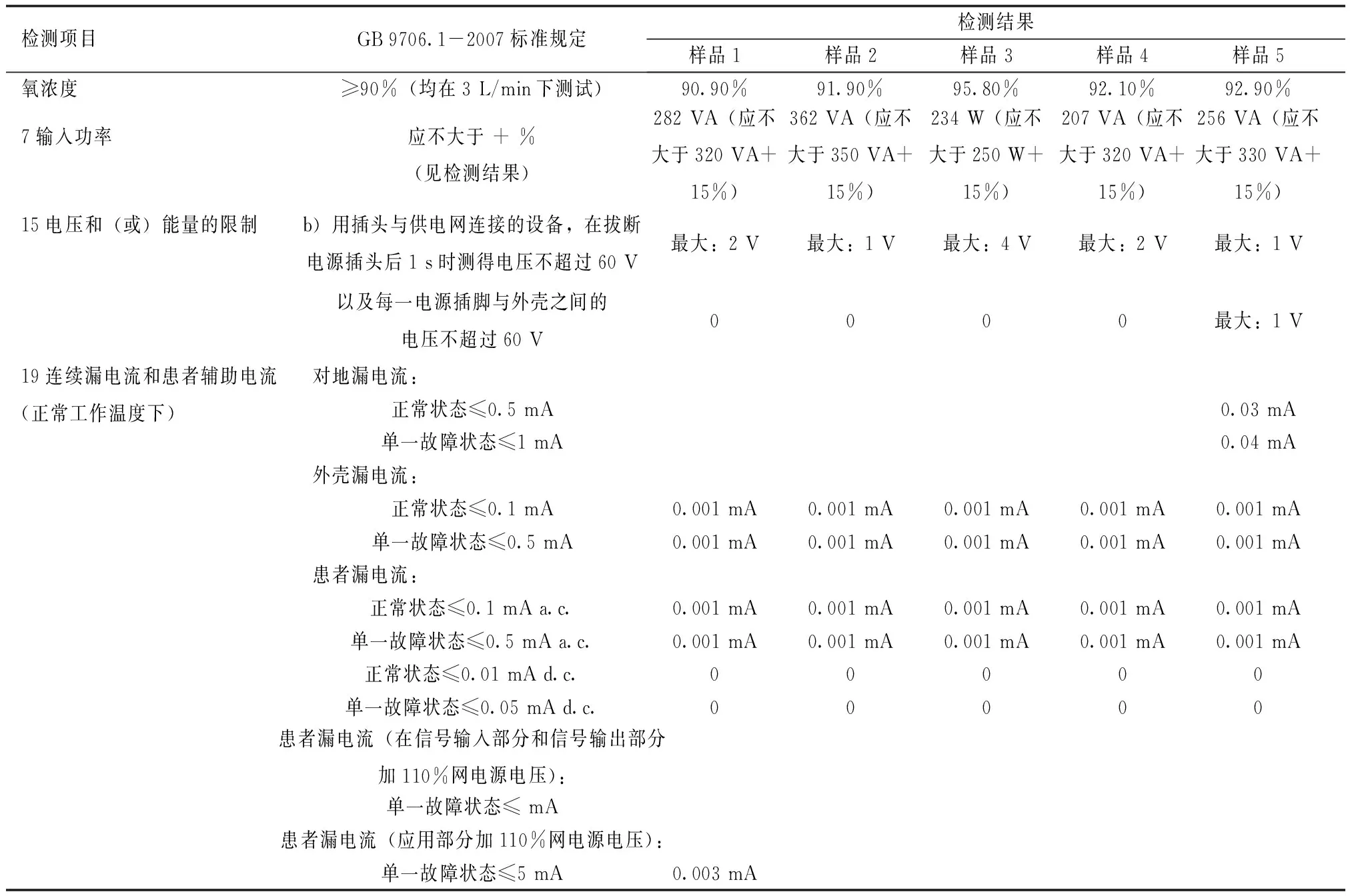
表1 整机加速寿命试验前的测试结果
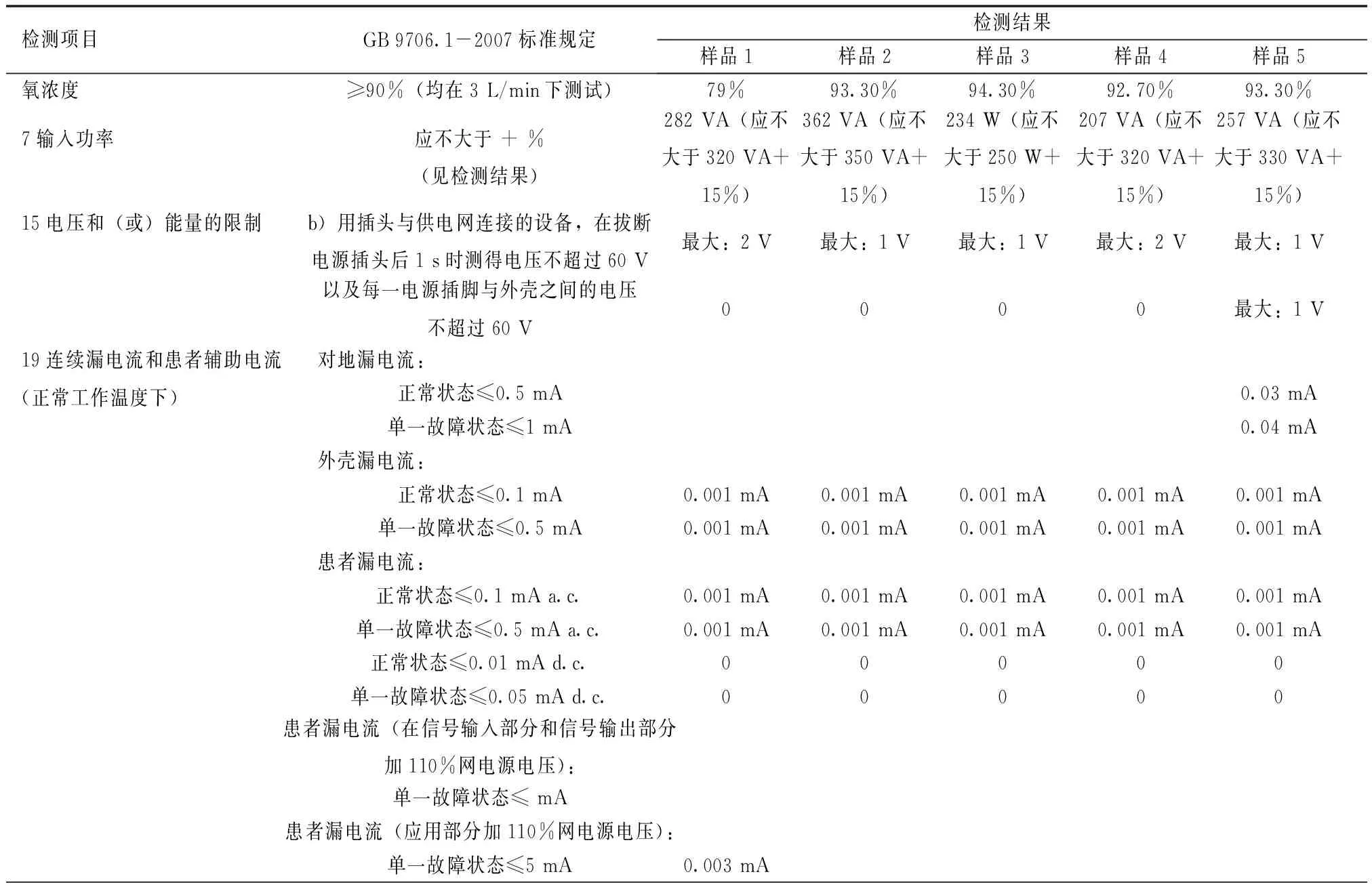
表2 整机加速寿命试验中的测试结果

续表2

续表2

表3 整机加速寿命试验后的测试结果
3 分析
通过对试验结果的分析,总结如下。(1)可能影响医用制氧机使用期限的因素有与氧气浓度有关的关键元器件本身的使用期限;设计过程中的防护措施,如软件检测工作环境;上市后产品缺乏后期的监管和维护,不能保持产品的持续有效。(2)大部分医用制氧机是Ⅱ类结构+塑料外壳,根据安规测试项目分析,产品结构基本可以保证基本安全;由试验结果可知,安全指标在经过几个阶段的试验后并没有明显的降低,故现有产品设计都能满足声称使用期限内安规指标的要求。(3)5台样品中1台有设计报警功能,当温度过高时,报警启动,设备停止工作,进入待机模式,当温度恢复后测试氧浓度满足要求。(4)氧浓度低于30%的2台样品,其中1台在第1轮试验后性能下降[氧浓度正常值为(93±3)%],且随着每一轮试验氧浓度逐步下降(图1),该样品在第1轮试验后性能指标异常,说明该产品不满足1年使用期限,由于电子产品大概率会在第1年内出故障,如第1年正常则使用期限内都能正常使用,此类1年内故障的情况经老化试验应能够检测出来,故合理怀疑可能是产品出厂前老化试验未做到位或者老化方案待改善;另外1台在第3轮试验后氧浓度直接下降至28%(图2),该产品满足2年预期使用,此种情况合理怀疑是虚标高了使用期限,建议优化设计提升使用年限。
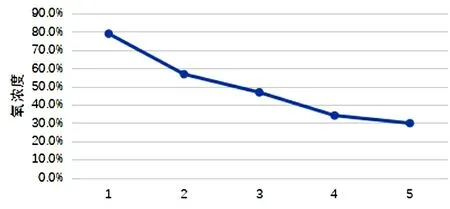
图1 样品1每轮试验后的氧浓度
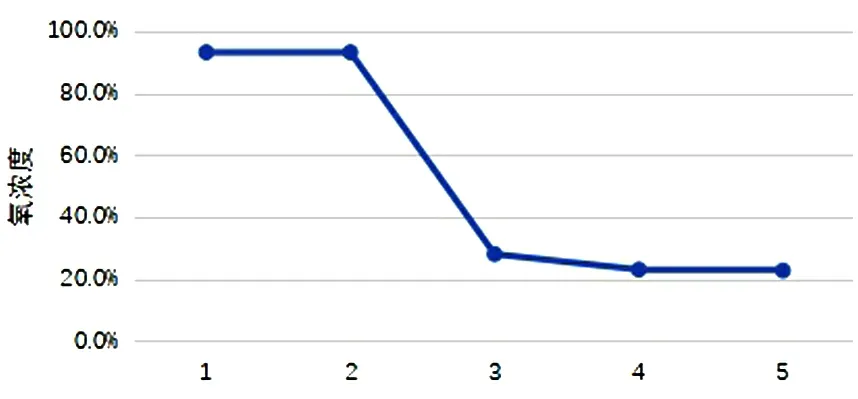
图2 样品5每轮试验后的氧浓度
4 建议
(1)通常情况下,医用制氧机的使用期限应通过参考同类产品、预估产品更新等方法制定,或以其采购的元器件产品的寿命来确定总装产品的寿命,随机文件不能无依据随机标称医疗设备的使用期限,切勿未经验证直接参考其他厂家随意标识。(2)医用制氧机氧浓度有所下降,而电气安全指标未受影响,此种情况不会造成电气安全风险,但在某些对氧浓度要求很高的场所尤其应杜绝此种情况;由于氧浓度是医用制氧机的重要临床指标,不满足宣称的浓度可能会影响临床效果,严重时可能导致不可接受的风险,因此,对于制造商而言,建议在随机文件内规定定期维护、保养和检查的方法和措施,以便不定期检测当前氧浓度是否符合使用要求。(3)在进行内部研发时,制造商应特别关注对关键性能有影响的重要元器件,在项目需求阶段应制定预期使用期限,选择满足要求的元器件,或者从软件设计上实现对重要元器件的防护(如软件设置报警等措施),从设计源头上解决问题。(4)对于故障和不满足要求的设备,需要重点关注并维护与性能指标相关的元器件,需要对主要元器件或部件进行研究,建议通过定期维护、定期更换相关元器件来维持医疗设备的预期使用期限;若受条件限制不可更换,则应在说明书及风险管理文档中说明此类部件的购买及更换方法。(5)当外部有类似事件时(如美国FDA官网产品召回),或者质量控制或售后反馈有异常时,首先自查产品,查找、分析原因,采用多样品验证是属于个别情况还是大概率事件,纳入质量监督计划,分析原因后再次验证,找到解决方案,稳步提升产品质量。(6)针对使用方,建议制定控制计划,保证氧浓度,如缩短检定的周期或购买氧浓度计不定期抽查氧浓度。(7)针对制造商,需要考虑整机验证的局限性,从更多方面(如失效模式与影响分析、过程失效模式与影响分析、设计失效模式与影响分析等)进行分析,从源头上保证产品的质量,且售后可定期做回访,收集使用方反馈信息并进行分析,持续改进。(8)医用制氧机除了满足声称使用期限的要求,因其为注册医疗器械产品,同时也需满足相应的医疗器械标准要求,本次试验样品中有1台设备为Class Ⅰ,有3台设备为B型应用部分,不符合IEC/EN 60601-1-11家用医疗设备要求,即不能为Class Ⅰ且应用部分需要为F型应用部分,结构满足防水IP22及以上要求,故针对家用型医用制氧机的设计同时需要考虑以上3个要求;GB 9706.1-2007要求电源线53 RVV及以上(该要求适用于任何医疗器械),试验样品中个别设备电源线为家用型电源线(52 RVV),不满足标准要求,而使用低于医疗绝缘要求的电源线可能影响产品使用期限内的基本安全。
在当今全球新型冠状病毒肺炎疫情的严峻局势下,医用制氧机的出口需求巨大,建议制造商在设计阶段纳入现有适用的国际标准要求,设计、生产满足国内及国际标准要求的高质量制氧机,保证制氧机在其使用期限内满足电气安全、性能指标均符合要求。
