发酵过程中青梅酵素的活性成分及其抗氧化性能
2021-10-15姜峰晏子玉乐治平
姜峰,晏子玉,乐治平,2
(1.南昌大学化学学院,江西 南昌330031;2.贵州荔波亿隆之家农业科技有限公司,贵州 荔波 558400)
自由基和活性氧是造成人体氧化损伤的主要原因,致使脂质过氧化以及细胞中的蛋白质变性,由此加速细胞衰老并诱发一系列常见的慢性疾病[1]。随着年龄增长和外界环境的影响,人体内防御系统不足以应对自由基和活性氧造成的氧化应激,因此需要摄入一定的抗氧化剂来维持体内的氧化还原平衡,这就引起了人们对天然抗氧化性食品的极大关注[2]。
青梅为蔷薇科乔木植物梅的一种,含有丰富的维生素、多种有机酸以及黄酮和多酚等营养物质。有研究[3]发现,青梅中含有的多酚类物质使青梅具有良好的抗氧化能力,且二者间存在显著的线性相关性。国外学者的研究[4]也表明,多酚类物质是梅子具有抗氧化性的主要贡献者,除此之外,类黄酮对自由基的清除作用也起了显著作用。
食用酵素主要以新鲜水果和蔬菜为原料进行发酵,通过酵母菌等微生物自身的新陈代谢活动而制得,在很大程度上保留了果蔬中的营养物质及活性成分,具有较好的抗氧化作用。刘涛等[5]以桑葚为原料发酵制得的酵素具有明显的抗氧化能力。董银卯等[6]研究了火龙果酵素的抗氧化性能,结果表明火龙果酵素对超氧阴离子自由基和DPPH自由基具有很强的清除作用。
本文以新鲜青梅为原料,经发酵制得酵素,研究了青梅酵素在发酵过程中黄酮和总酚类物质成分的变化及其与抗氧化活性的相关性,为制取青梅酵素产品提供一定的理论基础和数据支持。
1 实验部分
1.1 材料与试剂
新鲜青梅,购于大理市下关镇向阳村;白砂糖,市售;芸香叶苷,分析对照品;没食子酸,分析对照品;福林酚试剂,生物技术级;2,2-联苯基-1-苦基肼基(DPPH);2,2-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS);三(羟甲基)氨基甲烷(Tris);邻苯三酚、亚硝酸钠、九水合硝酸铝、氢氧化钠、碳酸钠、水杨酸、硫酸亚铁、过氧化氢、浓盐酸、过硫酸钾、磷酸氢二钠、二水合磷酸二氢钠、铁氰化钾、氯化铁、三氯乙酸、无水乙醇等均为分析纯。
1.2 仪器与设备
HC-3541高速离心机(安徽中科中佳科学仪器有限公司);UV-5500PC紫外可见分光光度计(上海元析仪器有限公司);DF-101S集热式恒温加热磁力搅拌器(河南予华仪器有限公司);雷磁PHS-25型pH计。
1.3 实验方法
1.3.1 青梅酵素的制备
取新鲜青梅490 g,清洗干净晾干后按1:1的比例加入适量白砂糖,放于已杀菌处理的密封罐中室温避光发酵。发酵过程中每隔6 d取发酵酵素液,4 000 r·min-1离心10 min后放于冰箱保存,用于测定。
1.3.2 黄酮质量浓度的测定
采用亚硝酸钠-硝酸铝比色法测定[7]。取适量发酵不同时间的酵素原液于带塞比色管中,加入5%NaNO20.5 mL,6 min后加入10%Al(NO3)30.5 mL,6 min后加入4%NaOH 5 mL,用蒸馏水补齐至10 mL,摇匀后静置15 min,于510 nm处测定吸光度值,以蒸馏水代替样品作为参比溶液。以芦丁为标准品,根据标准曲线回归方程y=12.054x-0.002 4、R2=0.999 4,计算黄酮质量浓度,其中y为吸光度值,x为样品质量浓度,mg·mL-1。
1.3.3 总酚质量浓度的测定
采用Folin-Ciocalteu法测定。取适量的发酵不同时间的酵素原液于10 mL容量瓶中,用蒸馏水稀释并定容至刻度线。取1 mL稀释过的样品液于10 mL带塞比色管中,加入0.25 mol·L-1福林酚试剂1 mL,5 min后加入20%碳酸钠2 mL,用蒸馏水补齐至刻度线,于760 nm处测定吸光度值,以蒸馏水代替样品作为参比溶液。以没食子酸为标准品,根据标准曲线线性方程y=0.103 4x+0.009 5、R2=0.999 1,计算总酚质量浓度,其中y为吸光度值,x为样品质量浓度,μg·mL-1。
1.3.4 羟基自由基清除能力的测定
分别取0.15 mL发酵不同时间的酵素原液于10 mL容量瓶中,用蒸馏水稀释并定容至刻度线。在每支试管中分别依次加入9 mmol·L-1FeSO41 mL、9 mmol·L-1水杨酸-乙醇溶液1 mL和0.03% H2O21 mL,最后加入稀释过的样品液1 mL,用蒸馏水补齐至10 mL,摇匀后置于37 ℃水浴中反应15 min,于530 nm处测定吸光度值为A2,以蒸馏水代替样品作为空白组A1,以不加过氧化氢的为参比溶液,羟基自由基清除率用X1表示,计算公式如下:

ρ(芦丁)/(mg·mL-1)
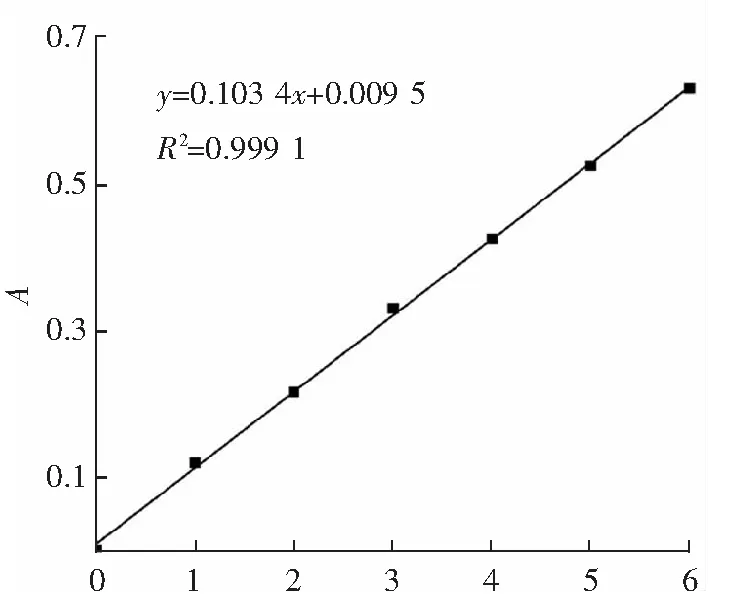
ρ(没食了酸)/(μg·mL-1)
1.3.5 超氧阴离子自由基清除能力的测定
分别取0.8 mL发酵不同时间的酵素原液于10 mL容量瓶中,用蒸馏水稀释并定容至刻度线。在试管中分别依次加入50 mmol·L-1Tris-HCl缓冲液(pH=8.2)4.5 mL和稀释过的样品液1 mL,然后加入3 mmol·L-1邻苯三酚(用10 mmol·L-1HCl配制)0.5 mL,立刻放入比色皿中,于320 nm处每隔30 s测定一次吸光度值,计算5 min内邻苯三酚的自氧化速率为ΔA2/Δt,以蒸馏水代替样品为空白组ΔA1/Δt,以10 mmol·L-1HCl代替邻苯三酚作为参比溶液,超氧阴离子自由基清除率用X2表示,计算公式如下:
1.3.6 DPPH自由基清除能力的测定
分别取50 μL发酵不同时间的酵素原液于10 mL容量瓶中,用蒸馏水稀释并定容至刻度线。在每支试管中分别加入0.04 mg·mL-1DPPH-乙醇溶液4 mL,然后加入稀释过的样品液2 mL,摇匀后在室温下避光静置30 min,于517 nm处测定吸光度为A2,以蒸馏水代替样品为空白组A1,以不加DPPH-乙醇溶液的为参比溶液,DPPH自由基清除率用X3表示,计算公式如下:
1.3.7 ABTS自由基清除能力的测定
取7.4 mmol·L-1的ABTS储备液和2.6 mmol·L-1的K2S2O8溶液等量混合,置于黑暗处反应12~16 h,用蒸馏水稀释45倍作为ABTS标准液,使其在734 nm处的吸光度值为0.7左右。分别取70 μL发酵不同时间的酵素原液于10 mL容量瓶中,用蒸馏水稀释并定容至刻度线。在每支试管中分别加入ABTS标准液4 mL,然后加入稀释过的样品液1 mL,摇匀后在暗处静置6 min,于734 nm处测定吸光度值为A2,以蒸馏水代替样品为空白组A1,以不加ABTS标准液作为参比溶液,ABTS自由基清除率用X4表示,计算公式如下:
1.3.8 总还原力的测定
采用铁氰化钾法。分别取150 μL发酵不同时间的酵素原液于10 mL容量瓶中,用蒸馏水稀释并定容至刻度线。在试管中分别依次加入稀释过的样品液1 mL、PBS(pH=6.6)2.5 mL,摇匀后在50 ℃水浴中静置20 min,之后加入10 g·L-1的TCA 2.5 mL,静置10 min后取上清液2.5 mL,加入0.1%氯化铁0.5 mL和蒸馏水2.5 mL,摇匀后静置10 min,于700 nm处测定吸光度值,以蒸馏水代替样品参比溶液。以所测定的吸光度值的大小反映样品还原能力的强弱,吸光度越大,还原力越强,抗氧化能力越强。
1.3.9 SOD酶活性的测定
根据1.3.5测得的超氧自由基清除率求得SOD酶活性,μmol·min-1·mL-1。
式中:X2为超氧阴离子自由基清除率,%;V总为反应液的总体积,mL;V样为加入样品液的体积,mL;n为样品稀释倍数。
2 结果与讨论
2.1 黄酮和总酚质量浓度的变化
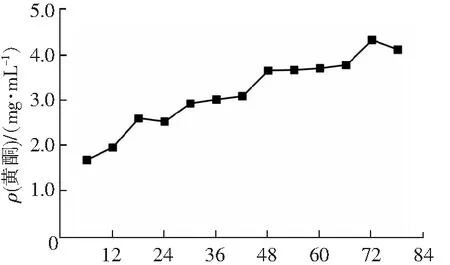
黄酮可以与自由基反应链中的过氧自由基发生反应,生成稳定的半醌式自由基,从而达到清除自由基的目的,因此具有良好的抗氧化能力[8]。酚类物质可以通过直接清除自由基、抑制氧化酶系、激活抗氧化酶系以及与过渡金属螯合等方式而实现抗氧化作用,是极好的天然抗氧化剂[9]。发酵过程中总酚和黄酮质量浓度的变化如图3、图4所示。
t/d

t/d
可知,随着发酵时间的延长,青梅中的黄酮被不断浸出,在第72天达到最大值4.32 mg·mL-1,发酵后较发酵前增加了2.42 mg·mL-1。有研究表明[10],发酵过程中黄酮质量浓度与酒精体积分数之间呈显著的相关性,随着微生物代谢产生的乙醇逐渐增多,青梅中的黄酮不断被提取出来,酵素液中黄酮的质量浓度随之增加。总酚质量浓度在发酵的前30 d快速增加,30 d以后质量浓度增加趋缓,在第72天达到最大值3.33 mg·mL-1,整个发酵中总酚质量浓度增加了1.85 mg·mL-1。这可能是因为在发酵前期,可溶性酚类物质逐渐析出,同时微生物代谢产生的碳水化合物代谢酶将青梅中以共轭形式与糖、有机酸、胺和脂质相连的酚类化合物进行酶促水解,大分子酚类物质被转化为小分子酚类物质,从而增加了酵素中游离酚类物质[11]的质量浓度。Zhu等[12]通过实验发现,杨梅果渣发酵过程中,类黄酮和总酚质量浓度明显增加,发酵后杨梅果渣液体比未发酵的杨梅果渣液体具有更高水平的抗氧化活性。Ding等[13]研究表明,发酵增加了黑大麦中类黄酮和总酚的质量浓度并提高了其抗氧化能力。
2.2 羟基自由基清除能力的变化
在各种活性氧自由基中,羟基自由基的反应活性和破坏作用最强。不同发酵时间的青梅酵素对羟基自由基的清除能力如图5所示。

t/d
可知,发酵的前30 d,青梅酵素对羟基自由基的清除能力迅速增大,在第30天达到最大清除率61.07%,之后清除能力趋于稳定,发酵结束后羟基清除率达59.61%,较发酵前增加了31.28%。李飞等发酵的苹果酵素对羟基自由基的清除能力最高达到了77%[14]。
2.3 超氧自由基清除能力的变化
超氧自由基在细胞氧化反应中最先生成,它可以与羟基自由基共同引发脂质过氧化,同时又可产生其他种类的有害自由基和氧化剂[15]。不同发酵时间的青梅酵素对超氧自由基的清除能力如图6所示。

t/d
可得,发酵前30 d超氧自由基清除能力增加了29.71%,第30天清除能力达到72.61%。30 d以后清除能力较之前有所浮动,但依然维持较高的清除率。可能是因为发酵过程中产生的SOD酶等抗氧化性酶的酶活力增大,有效地清除了氧自由基;同时,酚类化合物的游离羟基以及具有游离的3-羟基取代的类黄酮分子也具有良好的抗氧化能力[16]。
2.4 DPPH自由基清除能力的变化
DPPH作为一种稳定的自由基,可以接受电子或氢自由基而成为稳定的抗磁性分子,导致其颜色发生变化,因此被广泛用于测量活性化合物的抗氧化能力[17]。不同发酵时间的青梅酵素对DPPH自由基的清除能力如图7所示。

t/d
可得,在发酵的前18 d,DPPH清除能力几乎呈直线上升,18 d后清除能力基本保持稳定,在发酵后期有小幅度增加,发酵78 d后,DPPH清除率达到68.62%,较发酵前增加了35%。据报道[18],DPPH清除能力的变化主要与多酚质量浓度的变化有关。
2.5 ABTS自由基清除能力的变化
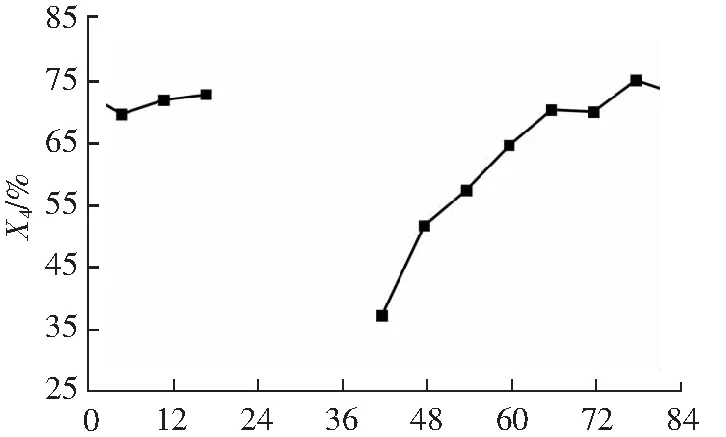
相对DPPH自由基来说,ABTS自由基更易被清除且与抗氧化剂反应时间更短,因此ABTS能更好地评价食品的抗氧化性能[19]。不同发酵时间的青梅酵素对ABTS自由基的清除能力如图8所示。
t/d
可得,在发酵的前30 d,ABTS自由基清除能力逐渐增强,30 d之后清除率在70%上下波动,最高达到74.7%。发酵结束后,清除能力较发酵前增加了35.76%。蒋增良等[20]研究蓝莓酵素的发酵过程中,ABTS清除能力与未发酵前相比仅增加了16.5%。
2.6 总还原力的变化
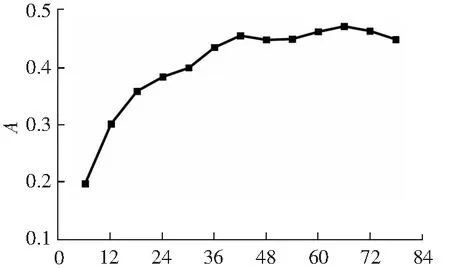
铁氰化钾还原法是一种广泛用于测定抗氧化活性的方法,样品的还原能力可以通过测量700 nm处的吸光度来表示,吸光度越大表明还原能力越强[21]。发酵过程中青梅酵素总还原力的变化如图9所示。
t/d
可得,发酵前42 d,还原力从0.19增加到0.45,42 d后还原力趋于稳定,在第66天前后有小幅度增加。可能是因为发酵后期,溶解和转化在酵素中的各种活性物质达到饱和,质量浓度趋于稳定。
2.7 SOD酶活力的变化
SOD酶是生物体内抗氧化酶系的主要组成之一,它能快速清除体内的氧自由基,保护组织细胞免受损伤[22]。发酵过程中青梅酵素中SOD酶活性的变化如图10所示。

t/d
可得,发酵过程中SOD酶活力呈现先期快速增加、后期趋于稳定的趋势。在第30天达到最大活性108.92 μmol·min-1·mL-1,发酵结束后,SOD酶活力维持在108.45 μmol·min-1·mL-1。表明青梅酵素在发酵过程中具有良好的清除氧自由基的能力。
2.8 抗氧化性能与黄酮及总酚质量浓度之间的相关性分析
通过SPSS软件,研究ABTS清除能力、DPPH清除能力、超氧自由基清除能力、羟基清除能力以及还原力和黄酮及总酚质量浓度之间的相关性。青梅酵素在自然发酵过程中抗氧化性能和黄酮及总酚质量浓度之间的相关性分析如表1所示。

表1 抗氧化性能与总酚和黄酮之间的相关性
Wang等[23]通过研究表明,发酵后番石榴叶茶的可溶性酚提取物表现出更高的抗氧化活性,证实了可溶性酚是抗氧化活性和还原能力的主要贡献者。蒋增良等[24]的实验表明,葡萄酵素在自然发酵过程中具有良好的抗氧化性能,且与酚类物质的质量浓度呈显著的正相关性。
表1结果显示,青梅酵素在自然发酵的过程中,还原力、ABTS清除能力、DPPH清除能力、超氧自由基清除能力以及羟基自由基清除能力与黄酮和总酚质量浓度之间均具有极显著的正相关性(P<0.01),且总酚质量浓度与4种自由基的清除能力和还原力之间的相关性要大于黄酮。由此可知,青梅酵素在自然发酵过程中所表现出的良好的抗氧化能力主要和酚类物质及黄酮有关。
3 结论
本文研究了78 d内青梅经自然发酵制备青梅酵素过程中活性成分的变化规律,并测定了它们的抗氧化性能。结果显示,羟基自由基、超氧自由基、DPPH自由基和ABTS自由基清除能力在发酵前期均呈现出快速增加的趋势,中后期略有波动或小幅度增加,还原力也呈现出先增加后趋于稳定的趋势,这和总酚质量浓度变化趋势相似。黄酮质量浓度在整个发酵过程中逐步增加,SOD酶活力亦是先期快速增加后趋于稳定。还原力以及4种自由基的清除能力和黄酮及总酚质量浓度变化之间均呈现极显著的相关性(P<0.01),并且和总酚质量浓度的相关性要高于黄酮。青梅酵素在自然发酵的过程中表现出良好的抗氧化能力,这主要与酚类物质和黄酮质量浓度的变化有关。
