虾青素对db/db小鼠糖尿病肾病的保护作用
2021-10-14吕亭亭桂定坤葛声
吕亭亭 桂定坤 葛声


摘 要:目的:采用2型糖尿病模型db/db小鼠,观察虾青素对糖尿病肾病的保护作用。方法:db/db小鼠糖尿病肾病模型成模后随机分为:模型对照组、氯沙坦组、虾青素低剂量组、虾青素高剂量组进行干预。同窝db/m小鼠作为正常对照。其中,氯沙坦组、虾青素低剂量组、虾青素高剂量组分别采用氯沙坦10 mg/(kg·d)BW、虾青素30 mg/(kg·d)BW、虾青素60 mg/(kg·d)BW进行灌胃,氯沙坦与虾青素均用橄榄油溶解,正常对照组与模型对照组灌胃等量橄榄油。干预8w后,检测其空腹血糖、OGTT、24 h尿白蛋白、尿ACR、肌酐、尿素氮等指标。结果:低剂量虾青素对糖耐量无不良影响,并能显著降低血清尿素氮、尿蛋白、尿ACR水平。结论:低剂量虾青素具有肾脏保护作用,但不具有剂量依赖性。
关键词:虾青素;糖尿病肾病;肾功能;抗氧化
糖尿病及其并发症的防治已成为重要的公共卫生问题[1-8]。虾青素(astaxanthin,ASX)是一种类胡萝卜素 [9],天然虾青素主要存在于藻类、三文鱼、虾、酵母菌等。虾青素的生物学活性作用及健康效益是近年来医学营养学研究的热点。大量的体内、体外研究结果显示,虾青素具有预防黄斑变性[10]、改善皮肤皱纹[11]、改善血流动力学[12]、预防冠状动脉粥样硬化性心脏病[13-14]、抑制肿瘤生长[15-17]等作用,其作用机制主要与抗氧化、抑制炎症反应、调节免疫有关。虾青素是单线态氧的猝灭剂,可以清除自由基,具有强大的抗氧化作用[18],虾青素的抗氧化能力是玉米黄素、叶黄素、角黄素、β-胡萝卜素的10倍,是α-生育酚的100倍。高血糖引起的氧化应激是引起糖尿病慢性并发症的重要作用机制之一,前期研究发现,虾青素对高糖诱导的人足细胞早期凋亡和粘附功能具有保护作用[19]。本研究拟在动物水平进一步验证虾青素对糖尿病肾病小鼠肾脏的保护作用。
1 材料与方法
1.1 试剂
虾青素,上海麟宝实业发展有限公司;氯沙坦,中国食品药品检定研究院;橄榄油,上海国药集团化学试剂有限公司;生理盐水,上海君瑞生物技术有限公司;尿微量白蛋白试剂盒,Bethyl Laboratories;尿肌酐试剂盒,南京建成有限公司。
1.2 实验动物
1.2.1 实验动物及饲养 6周龄雄性db/db小鼠20只,同窝雄性db/m小鼠5只。实验动物由南京大学-南京生物医药研究院提供。动物生产许可证号:SCXK(苏)2010-0001;动物使用许可证号:SYXK(沪)2011-0128。动物饲养条件:所有小鼠每笼5只,分笼饲养在清洁级(SPF)动物房内。SPF级动物房内环境温度为(25±2)℃,相对湿度50%~70%,每天予以12 h光照。实验过程中,小鼠自由进食和饮水,采用普通饲料喂养,每100 g普通飼料三大产能营养素供能比:碳水化合物 60%、脂肪19%、蛋白质21%。
1.2.2 动物分组与处理 db/db小鼠是由瘦素受体基因缺陷导致的先天肥胖性2型糖尿病小鼠模型。随着时间发展会自发出现肥胖、高胰岛素血症、高血糖,一般8~9 w即可出现微量白蛋白尿,提示出现糖尿病肾病。将db/db小鼠随机分为4组,每组各5只,即模型对照组(MG)、氯沙坦组(ARB)、虾青素低剂量组(LASX)及虾青素高剂量组(HASX)。同窝雄性db/m小鼠为正常对照组(NG)。在实验动物适应性喂养2 w后,断尾法测定其空腹血糖水平,收集尿液标本,检测尿微量白蛋白/肌酐,即尿ACR水平。根据空腹血糖和尿ACR水平判断db/db小鼠糖尿病肾病的成模情况。实验干预阶段,每早固定时间以橄榄油作为载体对小鼠灌胃。正常对照组和模型对照组采用10 mL/(kg·d)BW橄榄油灌胃。氯沙坦组:氯沙坦10 mg/(kg·d)BW进行灌胃;虾青素低剂量组:虾青素30 mg/(kg·d)BW;虾青素高剂量组:虾青素 60 mg/(kg·d)BW。虾青素、氯沙坦均溶于橄榄油中,干预8 w。
1.2.3 标本收集 尿液:将小鼠单只饲养在小鼠专用代谢笼内,正常摄食和饮水。24 h后收集尿液,记录24 h尿量。用离心机3 500 r/min离心10 min,弃去沉渣,取上清,进行相关指标测量。血液:采用盐酸氯胺酮麻醉动物后,摘眼球取血进行血液样本收集,将收集好的血液用离心机5 000 r/min离心10 mg/(kg·d)BW,取上清至无菌EP管中保存。
1.3 方法
1.3.1 空腹血糖和OGTT 在小鼠禁食12 h后,鼠尾末端2~3 mm处剪断尾巴,将第一滴血弃去,第二滴血滴在血糖试纸上,以测得空腹血糖。OGTT:对各组小鼠给予20%葡萄糖溶液2 g/kg进行灌胃,同样方法检测0、30、60、120 min血糖,绘制血糖-时间曲线,并计算曲线下面积(AUC)。
1.3.2 肾功能及尿ACR测定 将采集的血液标本分离出血清后,采用全自动生化分析仪检测血肌酐、尿素氮等指标。采用ELISA法测定尿微量白蛋白及尿白蛋白。采用尿肌酐试剂盒(除蛋白法)测定尿肌酐水平,进而计算出尿ACR(尿微量白蛋白/肌酐)。
1.3.3 肾组织透射电镜标本留取及检测 将小鼠肾皮质切成1 mm3的立方小块。放入盛有4℃预冷的2.5%戊二醛溶液中固定,4℃冷藏保存。用1%四氧化蛾后固定,逐级脱水,环氧树脂Epon 812包埋,聚合后切成1.5~2 μm厚片。制备光镜半薄切片的包埋块,并选相应部位做超薄切片,采用H-500型电子显微镜观察。
1.4 统计学方法
实验结果以均数±标准差(±s)表示。数据分析采用SPSS 17.0软件。采用one-way ANOVA的方法进行统计分析,P<0.05表明差异有统计学意义。
2 结果与分析
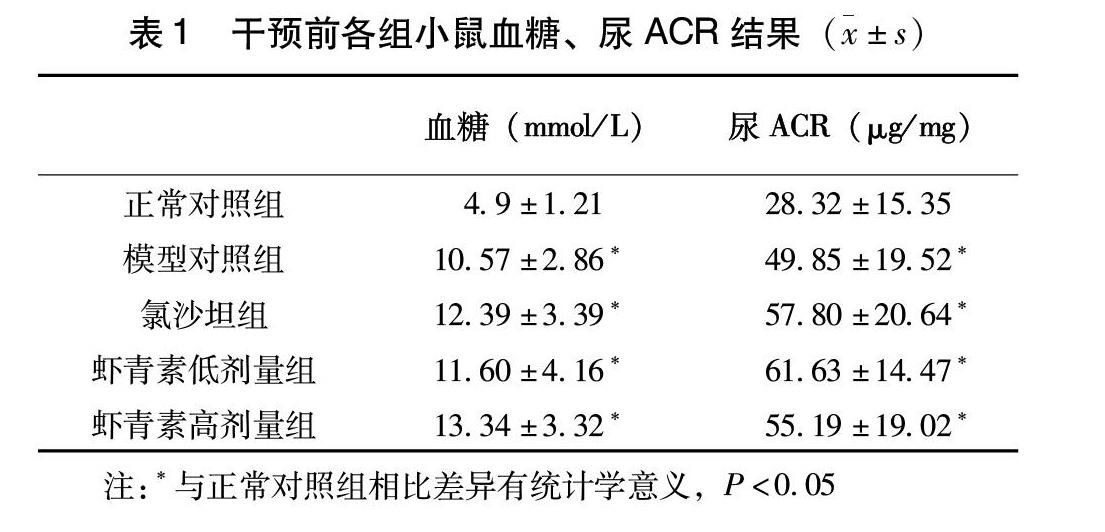
2.1 干预前各组空腹血糖、尿ACR水平
適应性喂养2 w后,db/db小鼠出现明显肥胖、并伴有多饮、多食、多尿症状。检测其空腹血糖及尿ACR水平,结果显示,db/db小鼠的空腹血糖和尿ACR均显著高于db/m小鼠(表1),说明糖尿病肾病模型造模成功。
2.2 OGTT结果
与正常对照组相比,模型对照组0、30、120 min血糖均显著升高,差异具有统计学意义,其60 min血糖水平亦有较明显升高趋势,但差异无统计学意义。氯沙坦组,虾青素低剂量组各时间点血糖与模型对照组相比无统计学差异,而虾青素高剂量组30、60、120 min血糖高于模型对照组,差异具有统计学意义(表2),这表明,低剂量虾青素对糖尿病肾病小鼠的血糖无不良影响,而高剂量虾青素可能会对血糖控制产生不利影响。
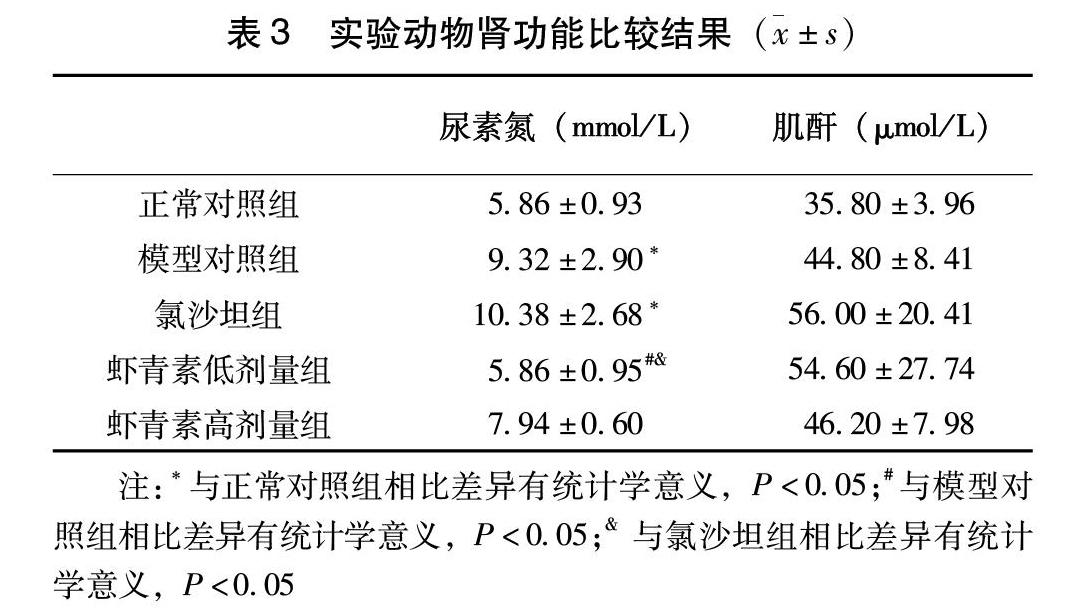
2.3 肾功能的比较
血尿素氮与血肌酐是反应肾功能的主要指标。肌酐是人体肌肉的代谢产物,尿素氮是蛋白质代谢的主要产物,而肾脏是排泄这些代谢废物的主要器官。当肾功能受到损伤,对这些代谢废物的排泄减少,则会导致尿素氮和肌酐在血液中的含量升高。本实验中,db/db小鼠的血肌酐水平与正常对照组相比有升高的趋势,但差异无统计学意义。但其血尿素氮水平较正常对照组显著升高,低剂量虾青素干预可显著降低其血尿素氮水平。高剂量虾青素组与模型对照组相比,血尿素氮水平有下降趋势,但差异无统计学意义(表3)。
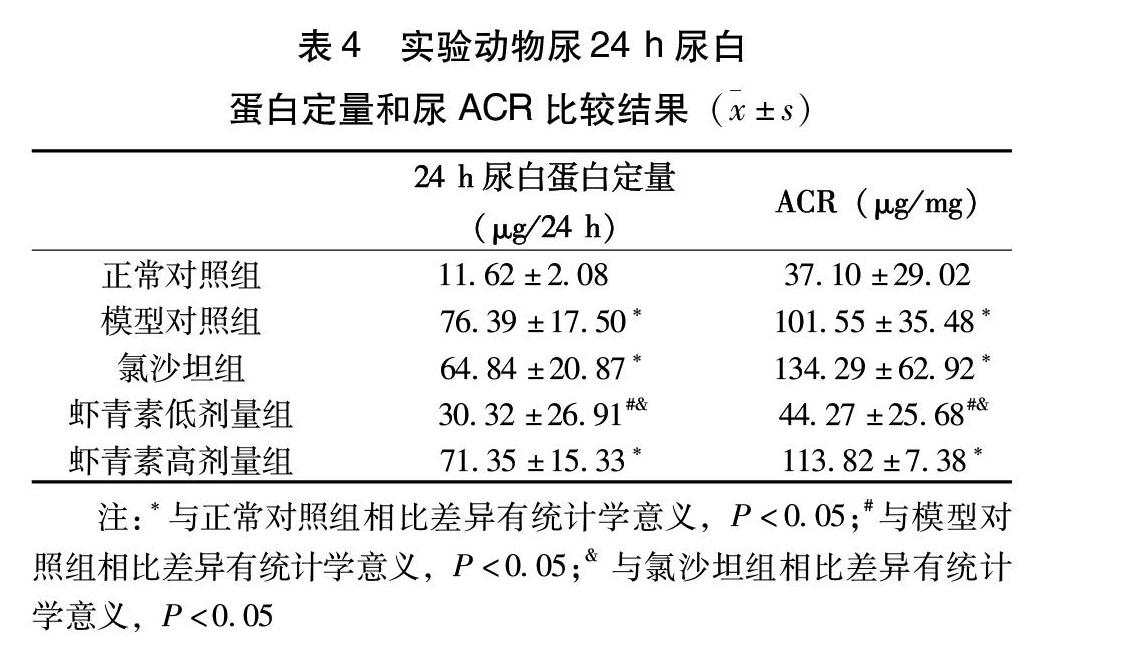
2.4 尿ACR和24 h尿蛋白排泄量的比较
模型对照组的24 h尿白蛋白与尿ACR均显著高于正常对照组,氯沙坦及高剂量虾青素并未显示出明显的降低尿蛋白或者尿ACR的作用,而虾青素低剂量组的24 h尿白蛋白及尿ACR与模型对照组相比显著降低(表4)。
2.5 电镜表现
电镜下,正常对照组小鼠肾小球基底膜结构清晰,足突排列整齐,分布均匀。而模型对照组肾脏结构可见肾小球基底膜结构欠清晰,走形僵硬,节段性增厚,亦可见足突广泛融合,系膜细胞增生,基质增生。虾青素高剂量组及ARB组小鼠肾脏病理改善不明显,而低剂量虾青素组肾脏组织形态改善显著,基底膜清晰,足突融合程度减轻,系膜区基质增生程度有所缓解(附图)。
3 讨论
糖尿病肾病作为糖尿病严重的微血管并发症之一,以其较高的致残率和致死率严重危害着广大糖尿病患者的生活质量和生命健康。糖尿病肾病主要临床表现为蛋白尿,进行性肾功能损害和高血压。蛋白尿的严重程度可以反映肾脏组织病变的程度,并会影响糖尿病肾病患者的生存率及预后。糖尿病肾病的病理改变主要为肾小球肥大,基底膜增厚,系膜细胞增生,足突融合等。系膜细胞作为肾小球固有细胞,增生后可导致细胞外基质生成过量并积聚,可导致肾小球硬化。高血糖引起的氧化应激增强是造成糖尿病并发症的重要病理生理机制之一[20]。体内和体外实验证实,代谢异常(高血糖、血脂异常)和血流动力学损伤(系统性和肾小球性高血压)是造成糖尿病肾脏氧化应激的两个主要驱动因素[21-22]。氧化应激水平升高可增加细胞外基质的合成,促使肾小球肥大,诱导转化生长因子β1、纤连蛋白和Ⅳ型胶原等表达增加。因此,氧化应激在糖尿病肾病的发生发展中起着重要作用。
C57BLKs/J背景的db/db小鼠是由于编码瘦素受体基因的碱基发生点突变,导致小鼠摄食过量,发生胰岛素抵抗,血糖水平升高,体型肥胖。并有研究表明,db/db小鼠易发生糖尿病肾病,表现为尿白蛋白升高,系膜细胞增生,细胞外基质积聚,基底膜增厚等肾脏结构破坏[23],是公认的研究2型糖尿病导致的糖尿病肾病的动物模型。本研究结果显示,虾青素可以显著降低db/db小鼠的尿蛋白水平,降低尿ACR,并改善其肾脏组织结构,具有肾脏保护作用。这可能与虾青素强大的抗氧化作用有关。但其肾脏保护作用不具有剂量依赖性,相反高剂量虾青素反而对糖尿病肾病小鼠的糖耐量产生不利影响,对尿蛋白及尿ACR也未见明显改善。这也提示,单纯抗氧化营养素并不是越多越好,而是要达到平衡状态。氧化剂是正常氧代谢的产物,在细胞信号传导,衰老和退行性疾病中都起着重要作用。氧化剂在细胞生理学也是重要的信号传导分子,而抗氧化剂可防止氧化剂过量积聚对组织细胞产生损伤。在健康人体中,氧化剂与抗氧化剂保持着复杂的平衡状态。当这种平衡状态被打破,无论是朝着哪个方向,对机体都是不利的。
本研究中低剂量虾青素呈现的肾脏保护效果令人鼓舞,但该实验尚存在许多不足之处,样本量较小,并没有深入探讨其具体机制。在接下来的研究中应该进一步摸索抗氧化营养素最佳剂量,为通过氧化应激平衡治疗糖尿病肾病提供新的思路与基础。◇
参考文献
[1]中华医学会糖尿病学分会.中国2型糖尿病防治指南(2013年版)[J].中华糖尿病杂志,2014,6(7):447-498.
[2]Wang L,Gao P,Zhang M,et al.Prevalence and ethnic pattern of diabetes and prediabetes in China in 2013[J].JAMA,2017,317(24):2515-2523.
[3]International Diabetes Federation.IDF Diabetes Atlas 9th edition 2019[R].2019:1-168.
[4]Hu F B.Globalization of diabetes the role of diet,lifestyle,and genes [J].Diabetes Care,2011,34(6):1249-1257.
[5]Shaw J E,Sicree R A,Zimmet P Z.Global estimates of the prevalence of diabetes for 2010 and 2030 [J].Diabetes Research and Clinical Practice,2010,87(1):4-14.
[6]De Boer I H,Katz R,Cao J J,et al.Cystatin C,albuminuria,and mortality among older adults with diabetes [J].Diabetes Care,2009,32(10):1833-1838.
[7]Ninomiya T,Perkovic V,De Galan B E,et al.Albuminuria and kidney function independently predict cardiovascular and renal outcomes in diabetes [J].Journal of the American Society of Nephrology,2009,20(8):1813-1821.
[8]Seshasai S R K,Kaptoge S,Thompson A,et al.Diabetes mellitus,fasting glucose,and risk of cause-specific death [J].The New England Journal of Medicine,2011,364(9):829.
[9]裘晖,朱晓立.虾青素的结构与功能 [J].食品工程,2007(1):16-18.
[10]Parisi V,Tedeschi M,Gallinaro G,et al.Carotenoids and antioxidants in age-related maculopathy italian study:multifocal electroretinogram modifications after one year[J].Ophthalmology,2008(115):324-333.
[11]Tominaga K,Hongo N,Karato M,et al.Cosmetic benefits of astaxanthin on humans subjects[J].Acta Biochim Pol,2012,59(1):43-47.
[12]Miyawaki H,Takahashi J,Tsukahara H,et al.Effects of astaxanthin on human blood rheology[J].J Clin Biochem Nutr,2008(43):69-74.
[13]Xu J,Gao H,Zhang L,et al.A combination of flaxseed oil and astaxanthin alleviates atherosclerosis risk factors in high fat diet fed rats [J].Lipids in Health and Disease,2014,13(1):1.
[14]Murillo E.Hypercholesterolemic effect of canthaxanthin and asta-xanthin in rats [J].Archivos Latinoamericanos De Nutrición,1992,42(4):409-413.
[15]Tanaka T,Kawamori T,Ohnishi M,et al.Suppression of azoxymethane-induced rat colon carcinogenesis by dietary administration of naturally occurring xanthophylls astaxanthin and canthaxanthin during the postinitiation phase [J].Carcinogenesis,1995,16(12):2957-2963.
[16]Kavitha K,Thiyagarajan P,Rathna J,et al.Chemopreventive effects of diverse dietary phytochemicals against DMBA-induced hamster buccal pouch carcinogenesis via the induction of Nrf2-mediated cytoprotective antioxidant,detoxification,and DNA repair enzymes [J].Biochimie,2013,95(8):1629-1639.
[17]Chew B,Park J,Wong M,et al.A comparison of the anticancer activities of dietary beta-carotene,canthaxanthin and astaxanthin in mice in vivo [J].Anticancer Research,1998,19(3A):1849-1853.
[18]Naguib Y M.Antioxidant activities of astaxanthin and related carotenoids [J].Journal of Agricultural and Food Chemistry,2000,48(4):1150-1154.
[19]呂亭亭,刘海丽,冯晓慧,等.虾青素对高糖诱导足细胞损伤的影响[J].中国血液净化,2016,14(12):736-738.
[20]Brownlee M,The pathobiology of diabetic complications,a unifying mechanism [J].Diabetes,2005,54(6):1615-1625.
[21]Gnudi L,Thomas S M,Viberti G.Mechanical forces in diabetic kidney disease:a trigger for impaired glucose metabolism [J].Journal of the American Society of Nephrology,2007,18(8):2226-2232.
[22]D.E.R.Group,et al.Intensive diabetes therapy and glomerular filtration rate in type 1 diabetes[J].N Engl J Med, 2011,365(25):2366-2376.
[23]Einbinder Y,Ohana M,Benchetrit S,et al.Glucagon-Like-Peptide-1 and Vitamin D:anti-inflammatory response in diabetic kidney disease in db /db mice and in cultured endothelial cells[J].Diabetes Metab Res Rev,2016,32(8):805-815.
Protective Effect of Astaxanthin on Diabetic Nephropathy in db/db Mice
LYU Ting-ting,GUI Ding-kun,GE Sheng
(Shanghai 6th People’s Hospital,Shanghai 200000,China)
Abstract:Objective To observe the protective effect of astaxanthin on diabetic nephropathy on db/db mice.Method Diabetic nephropathy model db/db mice was randomly divided into model group,losartan group,low dose astaxanthin group,high dose astaxanthin group.db/m mice in the same nest were used as normal controls.Among them,losartan group,low-dose astaxanthin group and high-dose astaxanthin group were separately given losartan 10 mg/(kg·d)BW,astaxanthin 30 mg/(kg·d)BW and astaxanthin 60 mg/(kg·d)BW.Losartan and astaxanthin were dissolved by olive oil,so the normal control group and model control group were given the same amount of olive oil.After 8 weeks of intervention,fasting blood glucose,OGTT,24-hour urine albumin,urine ACR,creatinine,urea nitrogen and other indicators were detected.Result Low dose astaxanthin had no adverse effect on glucose tolerance,and could significantly reduce the levels of serum urea nitrogen,urine protein and urine ACR.Conclusion Low dose astaxanthin has renal protective effect,but not dose-dependent.
Keywords:astaxanthin;diabetic nephropathy;renal function;antioxidant
