角蛋白酶生产菌株的筛选鉴定及酶学性质研究
2021-10-14徐志龙尹雅洁梁运祥赵述淼胡远亮
徐志龙,尹雅洁,夏 险,梁运祥,赵述淼,胡远亮*
(1. 湖北师范大学生命科学学院,食用野生植物保育与利用湖北省重点实验室,黄石 435002;2. 华中农业大学农业微生物学国家重点实验室,武汉 430070)
角蛋白是一种硬质蛋白,在羊毛、羽毛和指甲等物质中含量丰富[1],比如在禽类羽毛中粗蛋白的含量高达90%,其中主要为角蛋白[2]。这些物质通常是农产品加工副产物,无害化处理需要大量的资金投入。若有适宜的方法水解利用这些废弃蛋白资源,以代替畜禽日粮中价格昂贵的动物性蛋白原料,如鱼粉或肉粉等,将产生巨大的经济效益[3-5]。
角蛋白分子内和分子间存在大量的二硫键,其结构稳定,能抵抗大多数常见蛋白水解酶,如胃蛋白酶、胰蛋白酶和木瓜蛋白酶的降解作用[6]。采用传统的物理化学方法,高温、高压、强酸及强碱,不仅浪费大量的能源,增加环境负担,而且破坏氨基酸的生物学活性,大大降低了羽毛蛋白质资源的利用效率。
因此,筛选高效角蛋白降解菌,研究其所产角蛋白酶的性质,对羽毛粉资源化利用具有重要意义。本研究以羽毛粉为唯一碳氮源,从土壤环境中筛选高产角蛋白酶菌株,并对其酶学性质进行研究,为利用微生物发酵技术开发羽毛角蛋白饲料资源奠定基础。
1 材料与方法
1.1 土壤样品
从富含羽毛质的环境中采集土壤样品,3份样品分别采自江西省宜春市张巷镇、湖北省武汉市某家禽厂和咸宁市某家禽厂。
1.2 培养基
Luria-Bertani (LB)培养基:胰蛋白胨10 g⋅L-1,酵母提取物5 g⋅L-1,氯化钠10 g⋅L-1,pH 7.5,121 ℃灭菌、30 min。
羽毛粉培养基:羽毛粉10 g⋅L-1,K2HPO40.5 g⋅L-1,KH2PO41.2 g⋅L-1,NaCl 0.5 g⋅L-1,MgSO40.1 g⋅L-1,CaCl20.2 g⋅L-1,pH 7.5,121 ℃灭菌、30 min[7]。
1.3 初筛和复筛
称取10 g土壤样品,加入到90 mL的无菌水中,混合均匀并进行梯度稀释,然后涂布在羽毛粉平板上初筛培养,37 ℃、36 h。挑取生长良好的单菌落,在LB平板上进行分离纯化,纯化的单菌落继续接种至羽毛粉平板上验证培养,37 ℃、48 h,挑取生长情况良好的菌落保藏,同时按1.4方法所述测定角蛋白酶活力进行复筛。
1.4 角蛋白酶活力测定
将菌株接种至LB液体培养基,37 ℃、180 r⋅min-1培养24 h,取2 mL培养液接种至羽毛粉液体培养基,37 ℃、180 r⋅min-1培养36 h,离心8 500 r⋅min-1、5 min,取上清液1 mL,50 mmol⋅L-1的Tris-HCl缓冲液2 mL、羽毛粉50 mg,混匀,37 ℃水浴10 min,加入10%三氯乙酸2 mL作用15 min以终止反应。将终止反应液离心,10 000 r⋅min-1、5 min,取上清液于280 nm测定光吸收值。对照组首先加入10%三氯乙酸溶液2 mL抑制酶活性,然后加入上清液1 mL,其他条件保持一致[8-9]。酶活力单位定义:在该反应条件下,使稳定后280 nm光吸收值,每分钟增加0.01所需的酶量为1个单位[8-9]。计算公式如下:U=5n×ΔA280/(0.01×10)
式中:U为样品角蛋白酶活力(U⋅mL-1),5为终反应体积(mL),n为样品稀释倍数,ΔA280为实验组与对照组的光吸收值的差值,10为反应时间(min)。
1.5 菌株鉴定
将复筛获取的高产角蛋白酶菌株,在羽毛粉平板上划线培养,37 ℃,36 h。挑选单菌落,采用菌落PCR法,以通用引物27F/1492R扩增细菌16S rRNA基因进行鉴定,PCR反应程序为:预变性94 ℃,4 min;变性94 ℃,1 min,退火50 ℃,40 s,延伸72 ℃,45 s,循环30次;终延伸72 ℃,10 min[10]。将PCR产物纯化后送检测序,利用Genbank数据库中进行DNA序列BLAST,采用软件MEGA 5.0构建系统发育树。
1.6 酶学性质研究
pH值。分别配制不同pH值的柠檬酸-柠檬酸钠缓冲液(0.2 mol⋅L-1,pH 4.0~7.0)、Tris-HCl缓冲液(0.1 mol⋅L-1, pH 7.5~8.0)和甘氨酸-氢氧化钠缓冲液(0.1 mol⋅L-1,pH 9.0~10.0),测定不同pH值条件下角蛋白酶活力,研究pH值对酶活力的影响。用pH 4.0~10.0缓冲液,以1∶1稀释酶液,4℃处理1 h,最适pH条件下测定角蛋白酶活力,以未处理组的酶活力为100%,研究该酶的pH稳定性。
温度。保持其他条件不变,分别于不同温度条件下(30~65 ℃),测定角蛋白酶活力,研究温度对酶活性的影响。酶液分别于60 ℃和80 ℃下处理1 h、2 h、4 h和8 h,最适条件下测定酶活力,以未处理组的酶活力为100%,研究该酶的温度稳定性。
离子和EDTA对角蛋白酶活力的影响。以终浓度5 mmol⋅L-1分别向反应体系中加入不同的离子(NH42+、Ba2+、Co2+、Mn2+、Ca2+、Cu2+、Mg2+)或EDTA溶液,最适条件37 ℃,pH 7.5条件下测定酶活力,以蒸馏水为对照同时实验,计算相对酶活力。
表面活性剂、氧化剂和有机溶剂对酶活力的影响。反应体系以终浓度1%或5%的分别添加SDS,吐温80,H2O2;以终浓度1%分别添加甲醇、乙醇、二甲苯、异丙醇、异戊醇和甲醛,最适条件37 ℃,pH 7.5条件下测定酶活力,以蒸馏水为对照,分别计算相对酶活力。
2 结果与分析
2.1 菌株筛选
通过对3份土壤样品进行初筛,挑选生长良好的菌落进行分离纯化、保藏并测定角蛋白酶活力复筛(表1),结果表明编号KS12的菌株产角蛋白酶活力最高,达46.89 U⋅mL-1,选择该菌株进行鉴定并研究其角蛋白酶性质。
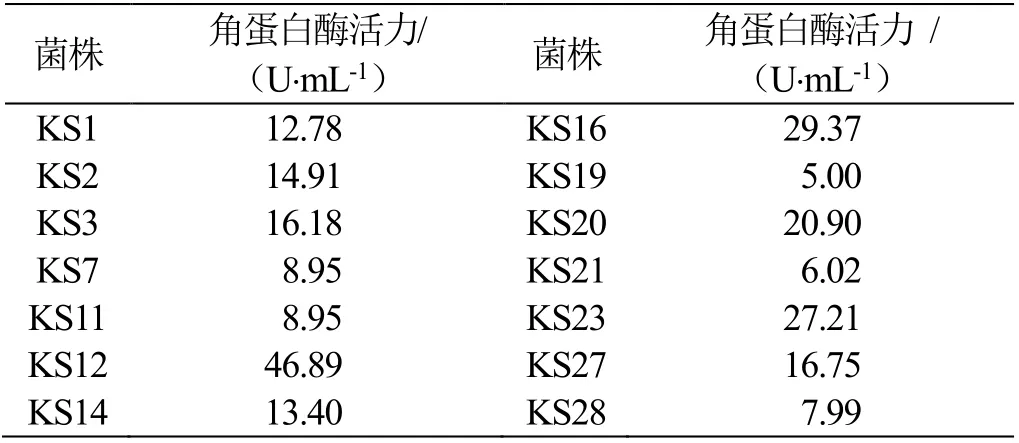
表1 测定角蛋白酶活力复筛结果Table 1 Result of keratinase activity
2.2 菌株鉴定
如图1A所示,LB平板上菌株KS12的菌落形态为半透明状,无反光,中间凹陷,边缘较厚,光滑且无规则。革兰氏染色镜检表明,菌体呈单个或链状排列,着色均匀,无荚膜,杆状,部分已产生孢子,初步认定为革兰氏阳性芽孢杆菌(图1)。
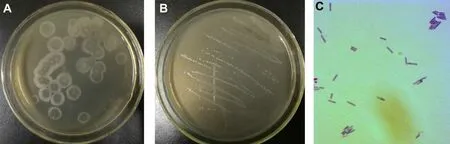
图1 KS12菌落形态和显微形态Figure 1 Colony morphologies and microscopic of strain KS12 on LB plate and feather powder plate
扩增16S rRNA鉴定表明,KS12菌株与Bacillus subtilisM015(KP192484.1)同源性最高,序列相似度为100%,且KS12菌株在系统发育树上进化距离与B. subtilis亲缘关系最近(图2)。因此,命名为B. subtilisKS12。
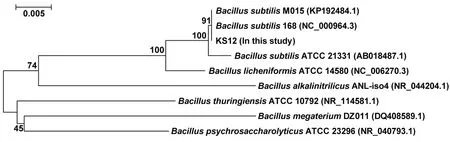
图2 系统发育树Figure 2 Phylogenetic tree of strain KS12 based on 16S rRNA
2.3 酶学性质研究
2.3.1 pH、温度对角蛋白酶活力和稳定性影响 如图3(a)所示,B. subtilisKS12产角蛋白酶在碱性环境中保持较高活力,最适pH值7.5;使用不同pH缓冲液处理1 h表明,该酶pH 8.0和9.0条件下,相对酶活力分别为97.2%和95.7%,见图3(b)。当pH<4.0或>9.0时,其稳定性快速下降,相对酶活力低于50%。
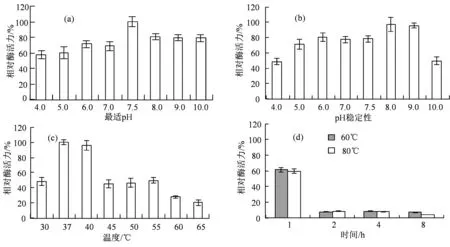
图3 pH和温度对角蛋白酶活力和稳定性的影响Figure 3 Effect of pH and temperature on activity and stability of the keratinase
研究发现,该酶最适反应温度37 ℃,当温度为30 ℃时,相对酶活力49.3%,达到45 ℃时,相对酶活力46.8%,见图3(c)。该酶于60 ℃,80 ℃水浴1 h,酶活力分别为61.4%,59.5%。随着保温时间的延长,角蛋白酶活力迅速下降,2 h酶活力不足5%,见图3(d)。这些结果说明,B. subtilisKS12产角蛋白酶对温度较为敏感。
2.3.2 不同离子对角蛋白酶活性的影响 如图4所示,5 mmol⋅L-1的Ca2+、Mg2+对B. subtilisKS12角蛋白酶活力有促进作用,其中Mg2+对角蛋白酶促进作用较强,相对酶活力达159%。EDTA则对酶活力基本没有影响,但Cu2+对角蛋白酶活力产生较强的抑制作用,相对酶活力仅有3.7%。
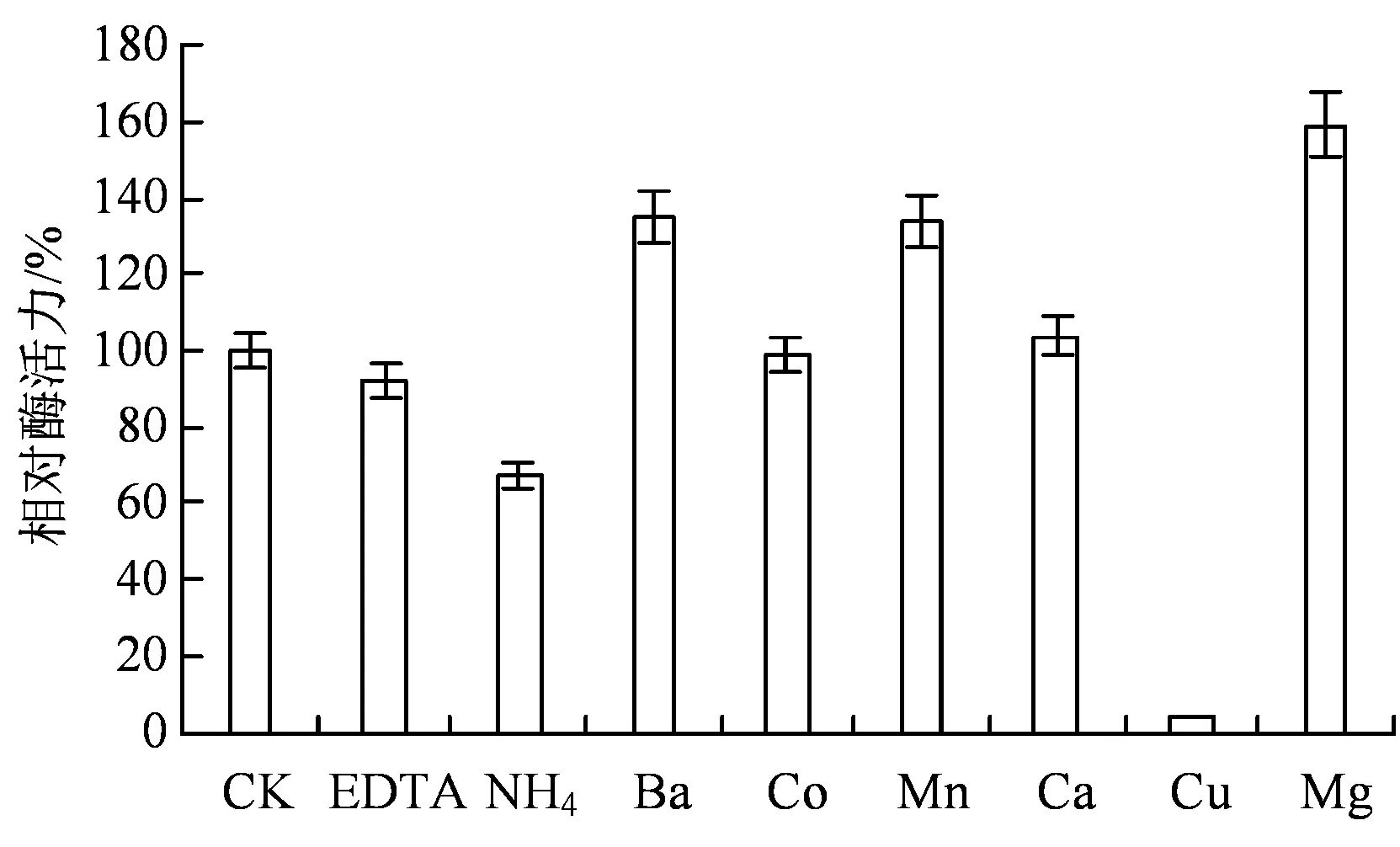
图4 金属离子对角蛋白酶活性的影响Figure 4 Effect of metal irons on keratinase activity
2.3.3 表面活性剂和氧化剂对角蛋白酶活性的影响由表2可知,SDS和H2O2抑制角蛋白酶活性。低浓度1%的吐温80对角蛋白酶激活作用不明显,但浓度为5%时,具有激活作用,相对酶活力达140.4%。
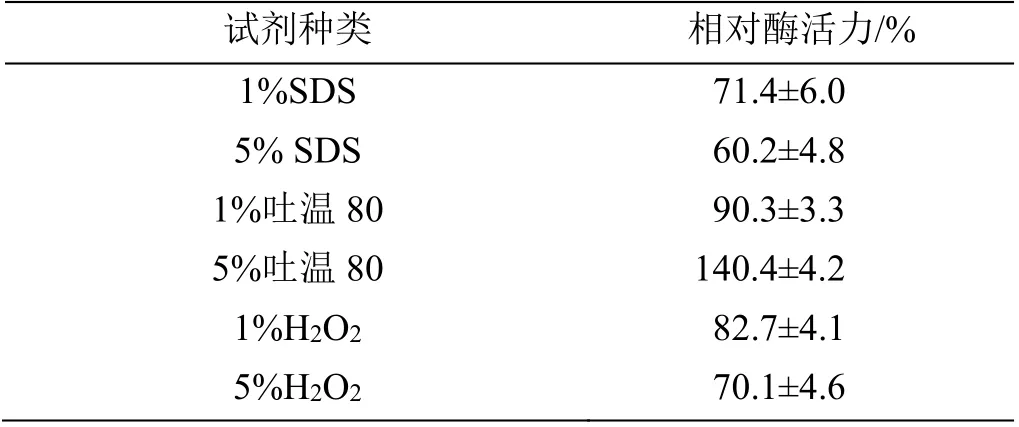
表2 表面活性剂和氧化剂对角蛋白酶活性的影响Table 2 Effect of various surfactants and oxidizer on keratinase activity
2.3.4 有机溶剂对角蛋白酶活性的影响 体系中以1%加入不同有机溶剂,发现角蛋白酶活力均受到抑制,说明该酶对有机溶剂的耐受性较差,其中,二甲苯的抑制效果最为明显,相对酶活力仅有34.1%(表3)。
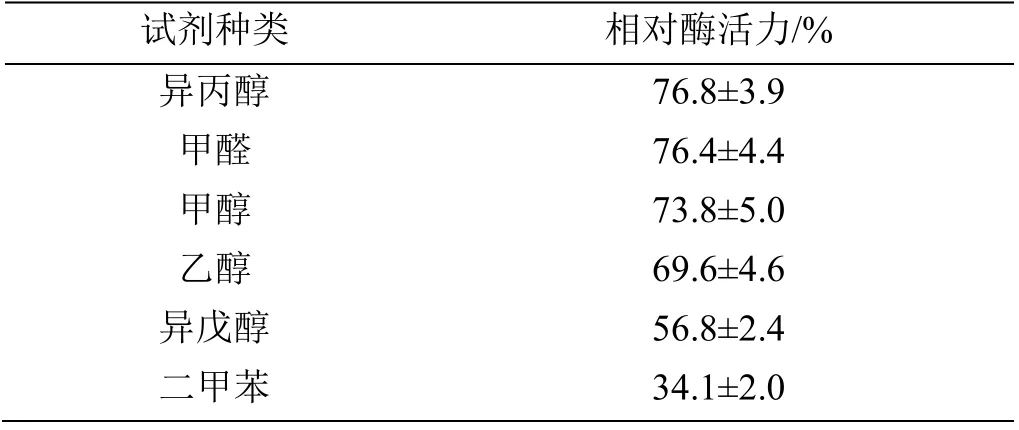
表3 有机溶剂对角蛋白酶活性的影响Table 3 Effect of various organic solvent on keratinase activity
3 讨论与结论
以羽毛粉作为唯一的碳、氮源,筛选得到1株角蛋白酶产生菌,经鉴定并命名为B. subtilisKS12。芽孢杆菌被认为是极具潜力的角蛋白酶产生菌,研究表明Brevibacillus brevisUS575菌株所产的胞外角蛋白酶KERUS相比NUE 12 MG和KOROPON MK EG角蛋白酶具有更高的水解作用、底物特异性和催化活性,能够独立完成全部的羽毛降解[11];来自B. tequilensisQ7的角蛋白酶KERQ7相比一些商业酶也具有更强大的角蛋白降解能力[12]。质谱分析KERUS单体分子量为29.1 KD,KERQ7为28.4 KD,两种酶都能够被PMSF和DFP完全抑制,表明属于丝氨酸蛋白酶家族[11]。
角蛋白酶的理化性质根据微生物的来源有所不同,大多数最适pH范围7.0~9.5,最适作用温度40~70℃[13-15]。来源于Purpureocillium lilacinumLPS#876的角蛋白酶在pH 4.0~9.0,37℃保温1 h,相对酶活力92%以上,65℃保温50 min,仍保持15%的相对酶活性[16]。少数角蛋白酶可以在极碱和更高温度下保持较高酶活性,比如来源于细菌Streptomyces的角蛋白酶,其最适作用pH和温度分别为11.5和75℃[17]。本研究中B. subtilisKS12酶学性质与多数角蛋白酶相似,在37℃和pH 7.5~9.0的碱性条件下较稳定。
金属离子Ca2+和Mg2+对B. subtilisKS12角蛋白酶活性有一定的促进作用,但重金属Co2+、Mn2+和Cu2+抑制角蛋白酶活性,通常Co2+[18]、Cu2+[19]和Hg2+[11,20]会不同程度的抑制角蛋白酶活性。螯合剂EDTA对B. subtilisKS12角蛋白酶的影响小,但对Bacillus thuringiensisAD-12分泌的角蛋白酶BtKER产生抑制作用[21],该菌分泌的角蛋白酶与金属相关,因此,添加EDTA使其活性受到影响。
角蛋白酶活性受到表面活性剂SDS、氧化剂H2O2和有机溶剂不同程度的抑制。1%吐温80对B.subtilisKS12角蛋白酶无激活作用,但高浓度5% 吐温80提高角蛋白酶活性。研究结果与链霉菌分泌的角蛋白酶性质相似,当吐温80浓度为0.1%时,相对酶活力仅98%,但浓度为0.5%时,相对酶活力达到109%[21]。此外,有机溶剂的存在,均对该角蛋白酶产生抑制作用。
由于角蛋白性质坚硬,在环境中难被降解,因此,从自然界中很难筛选到可以高效分解羽毛角蛋白的微生物。以自然界中筛选的降解微生物为基础,构建基因工程菌,提高角蛋白酶在菌体中的表达量,其应用前景将更为广阔。
