外源鲨烯和茉莉酸甲酯对印楝素生物合成代谢网络的影响
2021-10-14谢婷婷王煜炜
邱 枫,谢婷婷,荀 航,王煜炜,姚 曦,汤 锋*
(1. 安徽农业大学植物保护学院,合肥 230036;2. 国际竹藤中心,国家林业和草原局竹藤科学与技术重点实验室,北京100102)
印楝素(Azaidrachtin)是从印楝(Azadirachta indica)中提取的一类四环三萜类化合物,具有拒食、趋避和干扰昆虫生长发育等多种生物活性,是目前开发最成功的植物源杀虫剂之一,已在中国、美国、加拿大和印度等多个国家登记使用,市场需求巨大[1]。其主要活性成分是印楝素A和B,约占99%,其中印楝素A的含量最高,活性最强[2-3]。
目前对印楝素生物合成途径的认识,基本停留于推理和假说层面。Akhila等利用14C标记研究印楝素、nimbin及茄碱苷的生物合成途径,证明甲羟戊酸参与了3种物质的合成[4];Seigler等推测2,3-环氧鲨烯在酶的催化下形成大戟二烯醇,再经一系列反应生成印楝素A[5]。谢婷婷等利用印楝素A无细胞合成体系,通过外源添加底物,证明羊毛甾醇不是印楝素A的合成前体,2,3-环氧鲨烯和丁酰鲸鱼醇是印楝素A的前体,nimbin、大戟二烯醇、脱乙酰茄碱苷和茄碱苷极可能是印楝素A的合成前体,并且茄碱苷位于合成途径较下游的位置[6]。
印楝素生物合成涉及多种酶促反应,在植物体内开展研究难度极大,进展缓慢。因此,借助现代组学技术,探讨印楝素生物合成途径,受到科学家的关注。Krishnan等完成了印楝基因组的测序,筛选出8个可能与印楝素生物合成相关的基因[7-8];Kurvadi等通过高通量测序和UPLC技术,获得150余个可能涉及印楝素合成的候选基因[9]。代谢轮廓分析是连接代谢组学和功能基因组学的纽带,无论是在细胞和植株层面上实施诱导,还是分子水平上操纵基因,都需要知道代谢产物的应答表现[10]。
因此,本研究在前期研究基础上,以印楝愈伤组织为材料,研究前体(鲨烯)和诱导子(茉莉酸甲酯)处理后印楝代谢轮廓的变化,分析差异代谢产物,探讨鲨烯和MeJ对印楝素生物合成代谢网络的影响,以期为揭示印楝素生物合成途径,深入认识印楝素代谢网络和调控机制提供依据,为利用生物技术合成和提高印楝素产量提供思路。
1 材料与方法
1.1 材料与试剂
1.1.1 植物材料 印楝为4年生植株。印楝种子采于中国林业科学研究院资源昆虫研究所元江试验站(云南省元江县),常规消毒后,室温浸种48 h,播种于营养钵中育苗。实生苗转盆后,置于中国林业科学研究院温室中常规盆栽。
1.1.2 主要试剂及仪器 (1)主要试剂。Azadirachtin B、Azadirachtin D、Azadirachtin H、Azadiradoine、Nimbin及Salannin为实验室分离制备所得[11];Azadirachtin A购于Sigma公司。色谱级甲醇、乙腈及乙醇购于默克公司;超纯水由Milli-Q超纯水系统制备得到。
(2)主要设备仪器。超高效液相色谱系统(日本岛津实验器材有限公司Shimadzu CBM30A);串联四极杆-飞行时间质谱仪,配有电喷雾离子源(ESI)(美国赛默飞世尔科技有限公司);研磨仪(德国弗尔德仪器设备有限公司MM 400)。
1.2 研究方法
1.2.1 样品制备与提取 愈伤组织分别饲喂100 μmol·L-1MeJ、500 μmol·L-1鲨烯及同时饲喂100 μmol·L-1MeJ和500 μmol·L-1鲨烯,培养24 h后收集,真空冷冻干燥7 d后备用,以无菌水为对照,每处理重复3次。
用研磨仪按30 Hz的频率,将冻干后的愈伤组织样品研磨1.5 min,至粉末状。称取100 mg样品粉末,加1.0 mL 70%甲醇,4 ℃静置提取24 h;10 000 g离心10 min,收集上清液,经吸附柱(CNWBOND Carbon-GCB SPE,250mg,3mL)和微孔滤膜(0.22 μm)过滤,待检测。
1.2.2 检测条件 (1)色谱条件。Waters Acquity UPLC HSS T3 C18(100 mm×2.1 mm,1.8 µm)色谱柱,流动相A和B分别为0.04%乙酸水溶液和含0.04%乙酸的乙腈溶液。采用梯度洗脱,梯度设置为:0 min,A∶B = 95∶5;11.0 min,A∶B = 5∶95;12.0 min,A∶B = 5∶95,12.1~15.0 min,A∶B = 95∶5。流速0.4 mL·min-1,柱温40℃,进样量2 μL。
(2)质谱条件。电喷雾正离子电离模式,质量扫描范围50~2 000 Da,碰撞气为高纯氮气(N2)。电喷雾离子源(ESI)温度500℃,毛细管电压5 500 V,帘气25 psi,碰撞诱导电离参数设置为高。通过去簇电压和碰撞能优化进行扫描检测。
1.2.3 定性定量分析 基于武汉迈特维尔生物科技有限公司自建数据库MWDB(metware database)及代谢物信息公共数据库,根据一级和二级谱信息,去除对数据分析有影响的同位素信号和含K+、Na+和NH4+等离子及大分子量物质的碎片离子等重复信号,对代谢物进行定性。利用三重四级杆质谱的多反应监测模式,以特征离子峰面积进行定量。
1.2.4 试验数据处理 运用主成分分析法(PCA)进行无监督分析,预判不同处理的整体趋势,随后利用有监督的正交偏最小二乘法(OPLS-DA)进行数据分析,验证OPLS-DA模型的拟合程度。基于OPLS-DA结果,差异倍数(fold change,FC)与VIP结合筛选差异代谢物。筛选标准为FC≥1.5或≤0.66,且VIP值≥1。
2 结果与分析
2.1 数据质量及代谢物总体分析
2.1.1 主成分分析结果 在PC1维中,MeJ、鲨烯(SS)以及MeJ和鲨烯共处理(MS)样品与对照组(CK)存在显著的分离趋势,表明3种处理代谢物与对照组存在显著差异(图1)。SS组与MeJ和MS组之间分离显著,表明鲨烯对代谢物影响与MeJ存在差异。MeJ、SS、MS和CK4种处理在PC2维上分离显著。

图1 主成分分析结果Figure 1 Results of principal component analysis
2.1.2 OPLS-DA分析结果 MeJ、鲨烯以及MS分别与对照组比较,3组的预测参数R2X、R2Y和Q2均接近1,表明模型稳定可靠,可以做后续的差异成分的筛选(图2)。

图2 OPLS-DA分析图Figure 2 OPLS-DA analysis diagram
2.1.3 代谢物种类及其分布 基于MWDB数据库及代谢物信息公共数据库,通过质谱信息检索,共鉴定出767种代谢物。442个代谢物分布在初生代谢途径,其中有机酸及其衍生物、氨基酸及其衍生物和脂质3类物质数目最多,分别占初级代谢物的26.7%、21.9%和15.6%。鉴定次生代谢产物287个,其中黄酮类代谢物最多(169个),占次生代谢物的58.9%,萜类代谢物14个。有38个代谢物未得到明确分类(图3)。

图3 代谢物总分布Figure 3 Metabolite profile
2.2 鲨烯和MeJ对印楝愈伤组织初生代谢的影响
2.2.1 MeJ对印楝愈伤组织初生代谢的影响 MeJ处理影响印楝52种初级代谢物,27种表达上调,25种表达下调,见图4(a)。涉及糖类、氨基酸和脂类等8类,其中对有机酸及衍生物(17种)、脂质(14种)和氨基酸及衍生物(10种)影响较大。除5种奎宁酸类物质外,其余有机酸类均有明显的增加。MeJ强烈促进脂肪酸十三烷内脂的合成,多数甘油磷脂的代谢明显提高。L-高瓜氨酸、高精氨酸和N-(3-吲哚乙酰基)-L-丙氨酸代谢降低,其余氨基酸类代谢均增强。
2.2.2 鲨烯对印楝愈伤组织初生代谢物的影响 鲨烯影响49种初生代谢物的合成,其中36种表现为下调,见图4(b)。共有8类差异代谢物,对有机酸及衍生物影响最大(15种),除3,5-二羟基-3-甲基戊酸、6-氨基己酸、延胡索酸和D-泛酸等4种上调,其余有机酸均受到抑制。13种胺类代谢物受到影响,酚胺类物质受到抑制,色胺类物质代谢增强。
2.2.3 鲨烯和MeJ共同作用对印楝愈伤组织初生代谢物的影响 鲨烯和MeJ的协同作用显著调控愈伤组织的初生代谢,影响7类53种初生代谢物,34种表现下调,19种为上调,见图4(c)。有机酸及衍生物受影响最大(17种),8种表现为上调。与单独处理结果一致,两者共处理抑制奎宁酸的代谢。其次为胺类物质(10种),其中酚胺和色胺类物质的代谢受到抑制。10种氨基酸及衍生物受到两者共同调控,其中4种氨基酸的代谢上调。
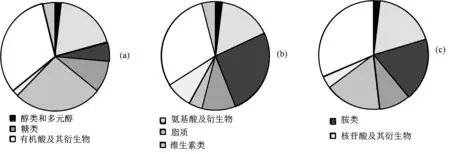
图4 MeJ和鲨烯处理影响初生代谢物分布Figure 4 The distribution of primary metabolites treated with MeJ and squalene
2.3 鲨烯和MeJ对印楝愈伤组织次生代谢物影响
2.3.1 MeJ对印楝愈伤组织次生代谢的影响 经MeJ处理后,差异次生代谢物有80种,47表达上调,33种下调,包括4种生物碱类、4种萜类和72种苯丙烷类及衍生物。其中黄酮类物质最多(47种),大部分受到抑制;其次为酚类物质(25种),13种代谢上调。这与甘草、蒙古黄芪等植物中的研究结果一致[12-15]。MeJ调控的4种萜类物质为印楝素B、诺米林、葫芦素E和Azadiradione,其中前3种代谢受到抑制。
2.3.2 鲨烯对印楝愈伤组织次生代谢物的影响 鲨烯处理后差异次生代谢物共88种,20种上调,68种下调(图5)。苯丙烷类及衍生物中差异代谢物最多(80种),其中黄酮类物质65种,占74.7%。其次为萜类物质,包括印楝素A、B、H及Salannin、Nimbin。除印楝素B外,其余物质代谢均上调。

图5 MeJ和鲨烯影响次生代谢物分布Figure 5 The distribution of secondary metabolites treated with MeJ and squalene
2.3.3 MeJ和鲨烯对印楝愈伤组织次生代谢物的共同影响 MeJ和鲨烯对印楝代谢有协同增效作用。MeJ和鲨烯共处理有79种差异次生代谢物,33种上调,46种下调。6种萜类物质代谢发生明显变化,其中印楝素A、Azadiradione和Nimbin代谢上调,印楝素B、诺米林和葫芦素E代谢受抑制。此外,MeJ和鲨烯的协同作用对4种生物碱的代谢也有明显调控。
2.4 种柠檬苦素类物质的靶向代谢分析结果
选取印楝素A、B、D、H及Azadiradione、Nimbin、Salannin等7种柠檬苦素类物质进行靶向代谢分析,结果表明,鲨烯、MeJ以及两者共存时,均能显著促进印楝素A、Azadiradione、Nimbin和Salannin的合成,对印楝素B、D的合成具有抑制作用。鲨烯促进印楝素H的合成,MeJ不仅抑制印楝素H的合成,并能抵消鲨烯的作用(表1)。MeJ和鲨烯处理后印楝素A合成增加,印楝素B、D合成受到抑制,表明其存在竞争关系。印楝素A和B结构相似,仅丁烯酯部分环氧结构上的-H和-OH不同[16]。说明MeJ可能通过调控印楝素B合成后期修饰酶活性,使更多的前体进入印楝素A的代谢流。
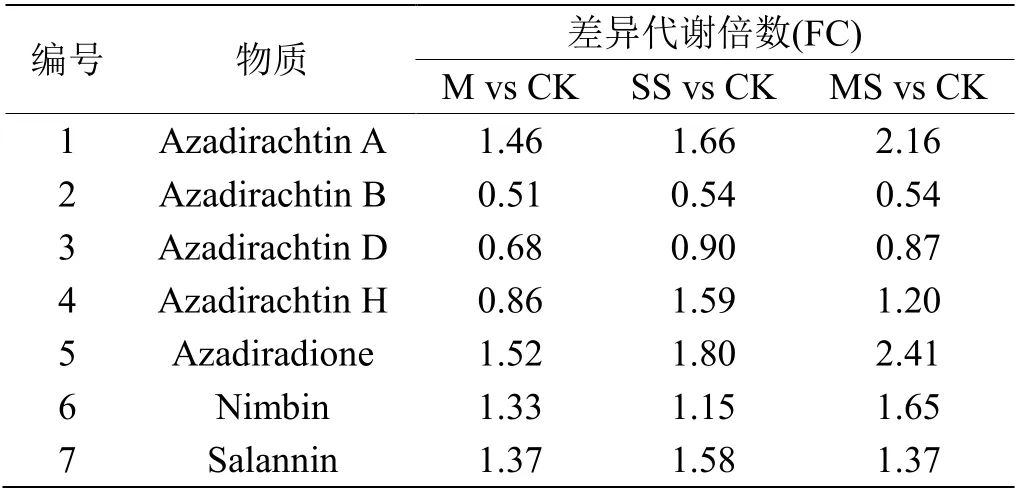
表1 MeJ和鲨烯处理对柠檬苦素类代谢物的影响Table 1 Effects of MeJ and squalene on 7 limonin metabolites
前人研究发现,紫外灯照射下,印楝粗提物溶液通氧后Salannin和Nimbin可分别氧化为含有印楝素结构和高生物活性的Isosalanninolide和Isonimbinolide,在植物体内亦发现了此类物质[17-18]。谢婷婷等亦发现,以Nimbin和Salannin为底物时印楝素A的产量显著增加,认为两者是印楝素A的合成前体[6],代谢物差异分析结果进一步验证Nimbin和Salannin是印楝素A合成前体。
Hansen等发现,Azadirone经氧化、环化及质子化等反应,最终可合成Salannin和Nimbin[19]。由于具有特有的氧化模式,Azadiradione和Azadione是许多柠檬苦素类和四环三萜类化合物的合成前体[20]。Azadiradione合成与印楝素A变化趋势一致,可推测Azadiradione亦为印楝素A合成前体。
2.5 鲨烯和MeJ对印楝素合成代谢网络的影响
2.5.1 MeJ和鲨烯对印楝素合成初生代谢网络的影响 印楝中碳水化合物代谢为MVA及MEP途径提供乙酰CoA、丙酮酸和3-磷酸甘油醛。三萜类物质的前体主要来自MVA途径,MVA途径和MEP途径在植物体中可通过IPP进行交流,因此两种途径均调控三萜物质的合成(图6)。

图6 萜类代谢相关网络Figure 6 Network diagram of terpenoids metabolism
MeJ和鲨烯影响葡糖酸内酯、葡萄糖酸、D-果糖-6-磷酸和D-葡萄糖-6-磷酸等4种糖类物质的代谢。葡糖酸内酯和葡萄糖酸可通过Entner-Doudoroff pathway反应产生3-磷酸甘油醛,D-果糖-6-磷酸和D-葡萄糖-6-磷酸经糖酵解过程生成丙酮酸。乙酰CoA不仅是MVA途径合成萜类物质的前体,也是三羧酸循环不可或缺的参与者。经鲨烯处理后,愈伤组织中延胡索酸和苹果酸含量有不同程度地增加,而柠檬酸和α-酮戊二酸含量减少,表明TCA循环增强且向合成更多的乙酰CoA的方向进行,释放大量的能量,利于印楝素的合成。此外,乙酰CoA还是一种重要的乙酰基供体[21],从鲨烯到印楝素的合成过程,涉及多步乙酰化反应,大量乙酰CoA的合成有利于鲨烯向印楝素的合成。
MeJ和鲨烯调控豆蔻酸的代谢,且多种不饱和脂肪酸产量显著变化。研究表明,豆蔻酸调控MVA途径,不饱和脂肪酸通过提高胞压和影响酶活促进MVA途径的代谢[22]。因此MeJ利用调控部分糖类和脂类的代谢影响印楝素的合成,鲨烯通过部分糖类和脂类的代谢以及TCA循环影响印楝素的合成。
2.5.2 MeJ和鲨烯对印楝素合成次生代谢网络的影响 鲨烯是植物三萜和固醇类物质的共同前体,减少固醇类物质的合成有利于鲨烯参与三萜类化合物的合成。MeJ处理后,愈伤组织中印楝素A合成增加,而固醇类物质维生素D的含量下降。同时添加MeJ和鲨烯,愈伤组织中维生素D含量仍明显减少,印楝素A的增加量高于MeJ单独处理,表明MeJ可通过抑制固醇类物质的合成促进印楝素代谢。磷酸吡哆醛是140多种细胞酶的辅酶,涉及氧化还原酶、转移酶、水解酶、裂解酶、异构酶及合成酶6大酶类,在众多细胞代谢中不可或缺[23]。印楝素生物合成涉及多种氧化、环化和异构等酶的参与,鲨烯促进磷酸吡哆醛的合成,有利于提高印楝素后期结构修饰相关酶的活性。
综上所述,MeJ通过促进Entner-Doudoroff pathway反应,糖酵解等初生代谢,抑制固醇类物质合成等次生代谢,进而调控印楝素的合成。鲨烯除影响Entner-Doudoroff pathway反应和糖酵解外,还通过调控三羧酸循环、脂质代谢以及结构修饰相关酶的活性,影响印楝素的合成。
3 结论
MeJ和鲨烯显著影响印楝愈伤组织的代谢活动,MeJ处理后共检132种差异代谢物,包括52种初生代谢物和80种次生代谢物。MeJ调控有机酸、脂质、氨基酸以及黄酮类和酚类物质的代谢,抑制印楝素B、诺米林和葫芦素E的合成。鲨烯处理检出137种差异代谢物,32种代谢物表达上调。靶向代谢组分析表明,MeJ和鲨烯显著促进印楝素A、Azadiradione、Nimbin和Salannin的合成,对印楝素B,D的合成具有抑制作用。表明Nimbin和Salannin是印楝素A生物合成途径的中间代谢物,Azadiradione参与印楝素A的合成。
基于差异代谢物的分析,绘制了MeJ和鲨烯影响印楝素合成的相关代谢网络,MeJ通过促进Entner-Doudoroff pathway反应,糖酵解等初生代谢,抑制固醇类物质的次生代谢,调控印楝素A的合成。鲨烯影响Entner-Doudoroff pathway反应和糖酵解,通过干预三羧酸循环、脂质代谢以及结构修饰相关酶的活性影响印楝素A的合成。
