猪圆环病毒2型/3型双重荧光定量PCR检测方法
2021-10-14王林青田润博崔建涛韩昊莹陈红英
王林青,樊 霖,赵 宇,田润博,崔建涛,韩昊莹,赵 丽,陈红英,3*
(1. 郑州师范学院分子生物学郑州市重点实验室,郑州 450044;2. 河南农业大学动物医学院,郑州 450002;3. 郑州市猪重大疫病防控重点实验室,郑州450002;4. 河南牧业经济学院动物医药学院, 郑州 450008)
猪圆环病毒(Porcine circovirus,PCV)是一种呈球形、无囊膜且单股闭合环状DNA病毒,属于圆环病毒科圆环病毒属,为目前已知的最小的动物病毒[1]。在全球范围的猪群中,迄今发现PCV有3个血清型:猪圆环病毒1型、2型和3型(PCV1、PCV2和PCV3)。PCV1于1974年首次被发现存在于猪肾细胞PK-15中,但不产生细胞病变[2],且对猪无致病性[3]。而PCV2于1997年首次被报道,能够引起猪发生包括仔猪断奶后多系统衰竭综合征(PMWS)、猪皮炎与肾病综合征(PDNS)和繁殖障碍等猪圆环病毒相关疾病(PCVAD)[4-6],给世界养猪业造成了巨大的经济损失。
2016年,美国Palinski等[7]和Phan等[8]分别从患有PDNS、繁殖障碍的母猪和关节肿胀和消瘦等疾病的母猪或仔猪检测到PCV3。PCV3基因组为2 000个碱基,与PCV2相似,含有2个主要的开放阅读框(ORF1和ORF2),分别编码rep和cap蛋白。PCV2和PCV3临床表现相似且难以区分,并且常以单独或混合感染的方式感染猪[9],使我国乃至世界养猪业面临巨大的挑战。因此,建立一种能同时检测和鉴别PCV2和PCV3的方法,为提供有价值的流行病学信息以及启动适当的预防和控制策略至关重要。
荧光定量PCR作为一种新技术,因其与普通PCR相比,具有更加快速、敏感、特异性强和自动化程度高等特点而不断发展,并广泛地应用于生命科学研究的各个领域。因此,本试验根据GenBank中已发表的PCV2和PCV3基因组核苷酸序列,分别设计了2对特异性引物,在同一个PCR反应管中进行两种病原的荧光定量检测,旨在为同时检测和鉴别两种病原提供一种新方法。
1 材料与方法
1.1 病毒、菌株及临床样品
PCV3阳性病料由郑州市猪重大疫病防控重点实验室对疑似PCV3感染的病料样品进行PCR扩增和测序而获得,作为PCV3的阳性对照。pMD18-PCV2阳性全基因组质粒、猪伪狂犬病毒(PRV)、猪蓝耳病病毒(PRRSV)、猪瘟病毒(CSFV)、猪流行性腹泻病毒(PEDV)以及猪细小病毒(PPV)均由郑州市猪重大疫病防控重点实验室保存。DH5α感受态细胞购自北京康为世纪有限公司。
66份临床样品(包括血清、淋巴结和脾脏等)为2017—2019年,采自河南省郑州、原阳和许昌等7个地市猪场。临床样品中一部分来源于河南各地健康猪群组织,另一部分为患有腹泻、流产死胎及圆环病毒感染相关疾病的病死猪组织。取适量组织进行研磨,于–80 ℃反复冻融3次,12 000 r·min-1离心6 min。取上清液,–80 ℃保存备用。
1.2 主要试剂
pMD18-T载体购自宝生物工程(大连)有限公司;2×Taq MasterMix(中国北京)购自北京康为世纪有限公司;DNA凝胶回收试剂盒、SanPrep柱式DNA和RNA小量抽提试剂盒购自生工生物工程(上海)股份有限公司;ChamQ TM Universal SYBR qPCR Master Mix、Trizol和反转录试剂盒均购自南京诺唯赞生物科技有限公司。
1.3 引物的设计与合成
利用DNAstar(version5.0)软件MegAlign程序对GenBank中已发表的PCV2全基因组序列( KT719404.1、DI434116.1和MH169117.1)进行同源性分析,应用Primer6.0引物设计软件,基于PCV2基因组上393~665 bp高度保守区域,设计1对特异性引物PCV2-F/R(表1),针对PCV3基因组上168~305 bp保守区域并参考Xu等设计的引物[10],两对引物均由奥科鼎盛(武汉)生物科技有限公司合成。
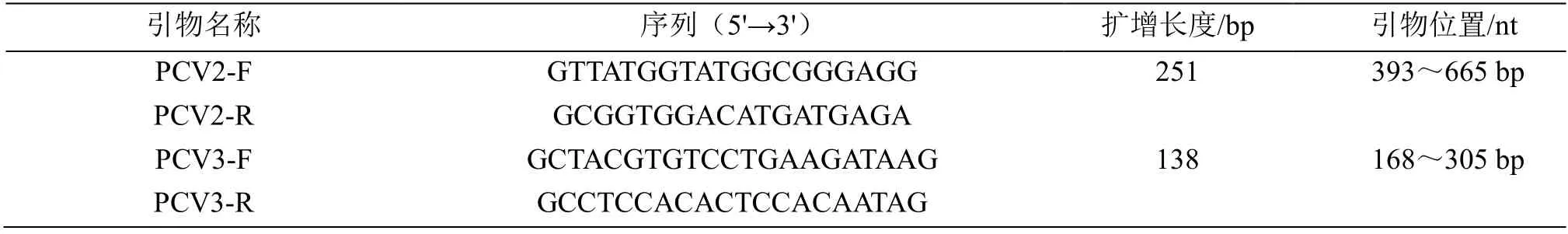
表1 PCV2和PCV3检测引物Table 1 Primers for the detection of PCV2 and PCV3
1.4 标准品模板的制备
根据SanPrep柱式DNA提取试剂盒说明书,提取PCV3、PRV和PPV的 DNA,根据Trizol说明书提取PEDV、PRRSV和CSFV总RNA,按照反转录试剂盒说明书合成cDNA,并于–80 ℃保存备用。利用PCV2和PCV3特异引物PCV2-F/R和PCV3-F/R,以pMD18-PCV2全基因组质粒以及提取的PCV3 DNA为模板,分别进行PCR扩增。反应条件为:95 ℃5 min;95 ℃ 20 s , 60 ℃ 20 s,72 ℃ 30 s,共35个循环;最终72 ℃延伸10 min。反应结束后,扩增产物经3.0%琼脂糖凝胶电泳检测。将胶回收试剂盒回收纯化的PCR产物,克隆至pMD18-T载体中,构建重组质粒(pMD18-PCV2和pMD18-PCV3)并测序。测序正确的质粒pMD18-PCV2和pMD18-PCV3作为PCV2和PCV3的标准品, 经紫外分光光度计检测其浓度,并根据公式:质粒浓度(ng·μL-1)× 6.022 × 1023/质粒长度× 660 × 109,换算为拷贝数/μL。
1.5 双重荧光定量PCR反应条件优化及标准曲线的建立
为了寻求最合适的双重荧光定量PCR反应体系和反应条件,对退火温度(55~65℃)、引物量以及延伸时间进行摸索。将标准品分别用去离子水作10倍系列稀释,选取6个稀释度(10-3~10-8)为模板,每个梯度标准品设立3个重复,用CFX96TM型荧光定量PCR仪进行荧光定量扩增。用荧光定量PCR仪的分析软件对荧光定量扩增结果进行分析,并建立标准曲线。
1.6 特异性和敏感性试验
采用优化的双重荧光定量PCR反应体系和反应条件,以PCV2、PCV3、PPV、PRV、CSFV、PEDV和PRRSV的核酸为模板,同时以去离子水为阴性对照,进行荧光定量PCR检测。选取标准品的8个稀释度(10-10~10-3)为模板,同时以去离子水为阴性对照, 进行荧光定量PCR(每个稀释度作3个平行试验),确定PCV2和PCV3的最低检测线,同时进行常规PCR检测,比较其敏感性。
1.7 重复性试验
将1.5中所用样品保存至4 ℃,每隔2周,同等条件下取3个稀释度(如10-3、10-5和10-8)标准品为模板进行批内试验,每个稀释度做3个平行试验;另对不同批次样品按前述方法稀释后定期进行荧光定量PCR检测,重复进行3次检测,分别计算其变异系数。
1.8 临床样品检测
对2017—2019年河南省郑州、原阳和许昌等地猪场的66份临床样品采用已建立的PCV2和PCV3双重SYBR GreenⅠ荧光定量PCR方法和常规PCR方法进行检测,比较这两种检测方法的检出率,评价其临床实用性。
2 结果与分析
2.1 标准品模板的制备结果
利用PCV2和PCV3的特异引物,以pMD18-PCV2全基因组质粒和PCV3的DNA为模板进行扩增和电泳,分别扩增出约251 bp和138 bp的特异性条带(图1),与预期扩增片段长度相一致。将回收纯化的PCR产物克隆至载体pMD18-T中,构建重组质粒(pMD18-PCV2和pMD18-PCV3),作为标准品模板。经测序鉴定,结果显示所克隆的PCV2和PCV3 基因序列分别为251 bp和138 bp,分别与参考序列KT719404和KX898030相应的区域同源性为100%,表明PCR扩增的产物是特异的。
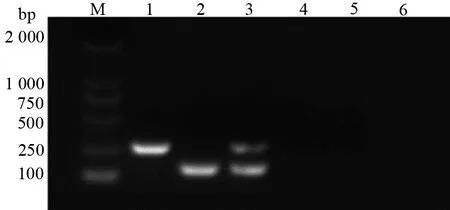
图1 PCV2/3单一及双重PCR扩增结果Figure 1 PCV2/3 single and double PCR amplification results
2.2 双重荧光定量PCR的优化与标准曲线的绘制结果
经优化双重SYBR GreenⅠ荧光PCR的反应条件和反应体系,确定PCV2和PCV3双重SYBR GreenⅠ实时荧光PCR反应体系为:SYBR GreenⅠPremix Ex Taq酶 10 μL,上、下游引物各0.5 μL,标准阳性质粒1 μL,补充 ddH2O至20 μL;扩增条件为:95℃5 min;95℃15 s,60℃ 15 s,72℃ 20 s,共35个循环;最终72℃延伸10 min。
按照双重荧光定量PCR反应体系和扩增条件,分别以PCV2和PCV3标准品的6个稀释度(10-8~10-3)作模板进行荧光定量PCR扩增,PCV2获得扩增曲线,见图2(a),PCV3获得扩增曲线,见图2(b)。根据PCV2,PCV3扩增曲线,以标准品拷贝数对数值为横坐标,Ct为纵坐标分别绘制PCV2和PCV3标准曲线(图3),PCV2直线方程为y=–3.5731x+42.456,R2=0.999,截距为42.456;PCV3直线方程为y= –3.373 4x+ 40.513,R2= 0.999 3,截距为40.513。二者相关系数均为0.999,具有良好的线性相关。
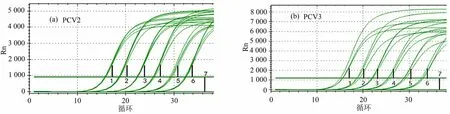
图2 PCV2/PCV3荧光定量PCR扩增结果Figure 2 PCV2/PCV3 real-time PCR amplification results
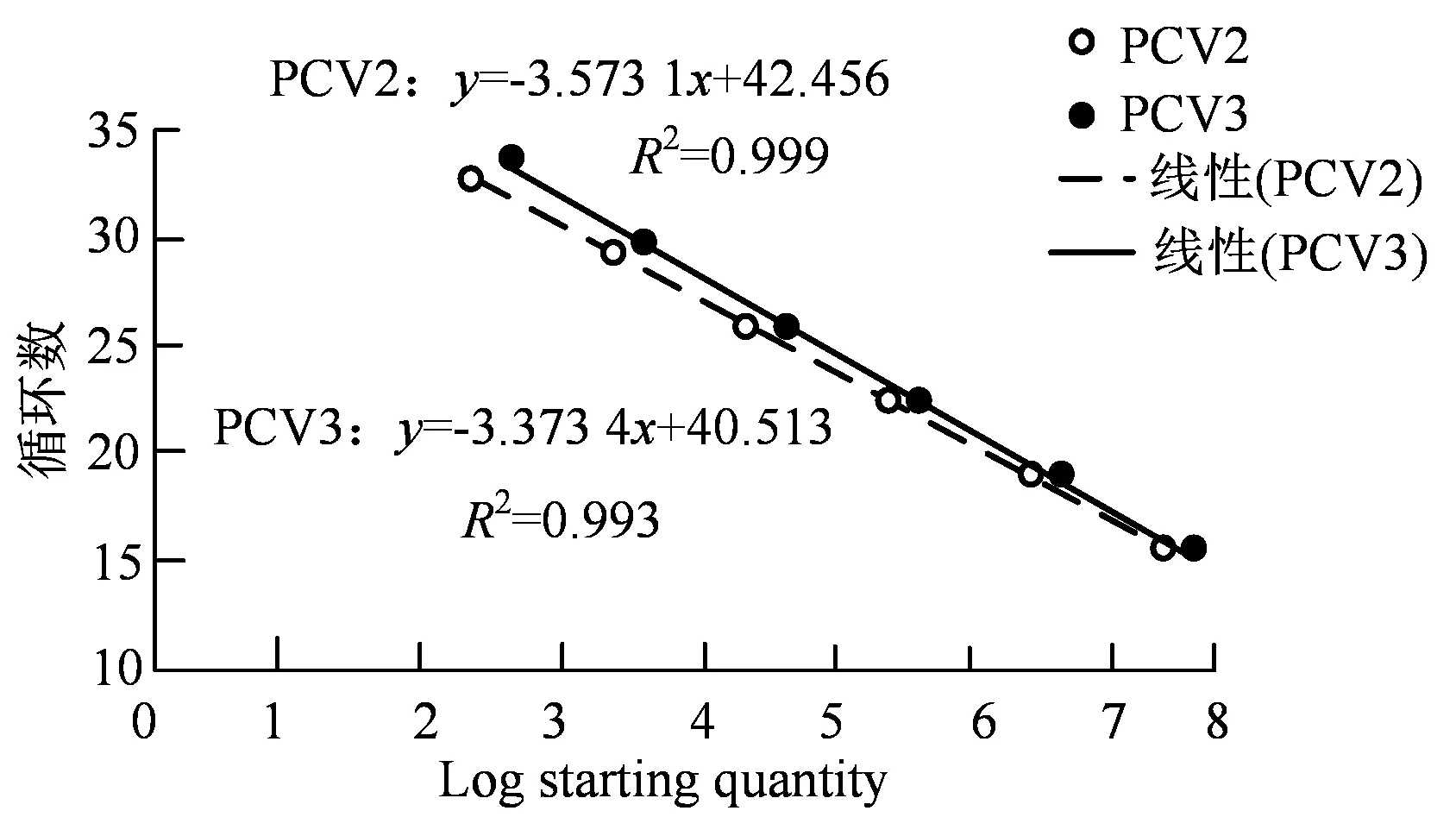
图3 双重SYBR Green I实时荧光定量PCR检测PCV2/3的标准曲线Figure 3 Standard curve of PCV2/3 detection by dual SYBR Green I real-time PCR
2.3 特异性试验和敏感性试验结果
采用建立的PCV2,PCV3 双重SYBR GreenⅠ实时荧光定量PCR,对PRV、PRRSV、PPV、CSFV和PEDV核酸进行检测。结果显示,均无特异性吸收峰值和扩增曲线,而PCV2和PCV3有扩增曲线(图4),表明该方法具有良好特异性。
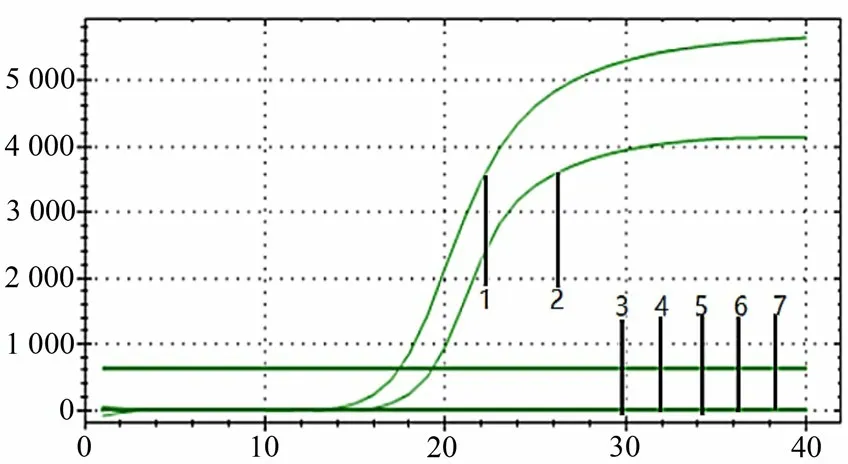
图4 荧光定量PCR特异性试验结果Figure 4 Fluorescence quantitative PCR specific test results
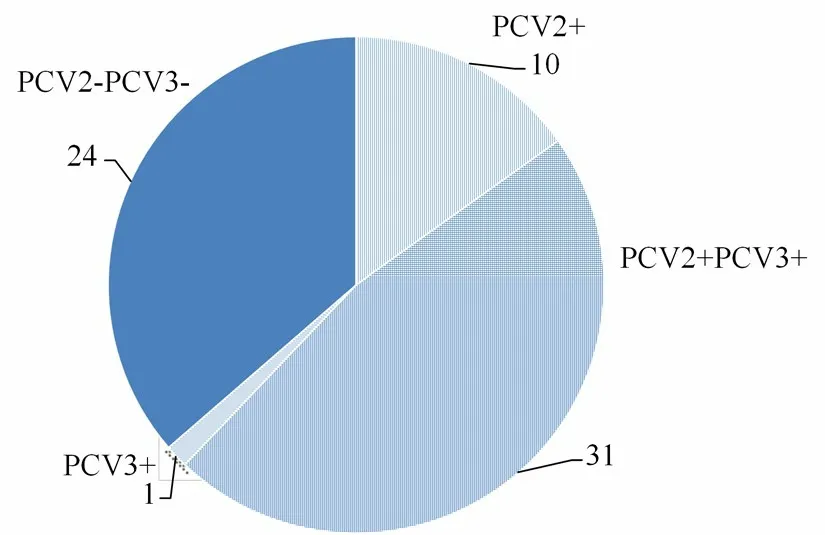
图5 临床样本双重PCR检测结果Figure 5 PCR results of clinical samples
选取8个稀释度(10-10~10-3)的标准品作为模板,进行双重SYBR GreenⅠ实时荧光定量PCR。结果显示,PCV2和PCV3的检测下限分别为41.1 copies·μL-1和27 copies·μL-1;而常规PCR检测时,PCV2和PCV3的检测下限分别为4.11×102copies·μL-1和2.7×102copies·μL-1,说明所建立的荧光定量PCR检测方法灵敏度优于普通PCR检测方法。
2.4 重复性检测
选取3个稀释度(10-3、10-5和10-8)的标准品作为模板,进行荧光定量PCR检测。检测结果显示,不同浓度标准品模板的批内变异系数为0.320%~0.727%;而批间的变异系数为0.725%~0.886%,且批内和批间的变异系数均小于1%。表明本研究建立的双重荧光定量PCR检测方法具有重复性高且稳定性良好的特性。
2.5 临床样品PCV2和PCV3的检测
采用建立的PCV2/PCV3双重荧光定量PCR,对2017—2019年采集的66份临床样品进行检测。结果显示,PCV2阳性41份,阳性率62.12%(41/66);PCV3阳性32份,阳性率48.48%(32/66);混合感染31份,阳性率46.96%(31/66)。普通PCR方法检测为阳性的病料,荧光定量PCR检测均为阳性,且荧光定量PCR检出的阳性率高于普通PCR阳性率,表明本研究建立的双重荧光定量PCR检测方法更为灵敏。
3 讨论与结论
自2016年Palinski等[7]报道美国猪场中检测到PCV3以来,中国、波兰和意大利等国家也相继报道PCV3的存在[9-12],这些研究结果证明,PCV3已在世界范围内广泛传播,对养猪业造成巨大的威胁。由于PCV3与PCV2临床表现相似,且对PCV2和PCV3混合感染的检测与鉴定仍存在困难[9],因此,建立一种敏感且特异地同时检测和区分PCV2和PCV3的方法十分必要。目前,季程远等[13]、贺会利等[14]以及徐朋丽等[15]分别建立了能够同时检测PCV2和PCV3的双重PCR检测方法,该方法具有快速、准确和方便等方面的优势,但普通的PCR方法在感染早期病毒量含量较少时,往往不能做出准确的检测,而荧光定量PCR具备普通PCR的特点,并且能够更加灵敏地对健康的或有疑似症状的猪进行早期的诊断,以便提前采取预防或治疗等有效措施,并且方法省去了电泳环节,避免了核酸染料对环境的污染以及操作人健康的危害,因此,本研究针对PCV2基因组上393~665 bp保守区域和PCV3基因组上168~305 bp保守区域,建立了PCV2/PCV3双重SYBR GreenⅠ荧光定量PCR方法。
结果表明,该方法能特异地检测PCV2和PCV3,对PRV、PRRSV、PPV、CSFV和PEDV等5种其他猪病原的检测结果均为阴性,说明该方法具有良好的特异性;PCV2和PCV3检测下限分别为41.1 copies·μL-1和27 copies·μL-1,其中PCV2的检测下线明显低于季程远等[13]和徐朋丽等[15]所建立的常规PCR检测方法,而PCV3的检测下线明显低于季程远等[13]所建立的常规PCR检测方法,并与徐朋丽等[15]所建立的常规PCR检测方法,李卓昕等[16]所建立的SYBR GreenⅠ实时荧光定量PCR检测方法以及张志等[17]所建立的Taqman实时荧光定量PCR检测方法相当,表明该方法具有良好的敏感性;运用所建立的PCV2/PCV3 双重SYBR GreenⅠ荧光定量PCR方法对2017—2019年采自河南地区的66份临床样品进行检测,评价该方法的临床实用性,结果显示,PCV2阳性率为62.12%(41/66),PCV3的阳性率为48.48%(32/66),PCV2和PCV3的混合感染率为46.96%(31/66),并且荧光定量PCR方法的阳性率高于普通PCR方法的阳性率,表明荧光定量PCR更适合少量病毒的检测且PCV2和PCV3的混合感染情况在河南省已经普遍存在。
本研究成功地建立了一种能同时检测和鉴别PCV2和PCV3的双重SYBR GreenⅠ荧光定量PCR方法。该方法对临床样品的检测具有敏感、特异和可靠等特点,适合于PCV2和PCV3单独或混合感染的早期诊断、定量检测及流行病学调查,以便采取及时地防控和治疗,为我国控制PCV2和PCV3感染提供有效的技术支持。
