蜜薯的脱毒培养及脱毒苗的生理变化
2021-10-14丁明珠邓竹根胡克玲甘德芳
丁明珠,邓竹根,胡克玲,甘德芳*
(1. 安徽农业大学园艺学院,合肥230036;2. 安徽江淮园艺种业股份有限公司,合肥230031)
甘薯(Ipomoea batatas(L.) Lam)又称山芋、红芋、红薯、番薯、白薯、地瓜等,是一种蔓生性草本植物,属旋花科甘薯属。甘薯叶具有促进胃肠蠕动、维持动脉血管良好的弹性、润滑关节腔、保护呼吸道和消化道、预防便秘等功效。甘薯叶含有的绿原酸具有抗衰老、抗菌消炎和清热解毒等功效,能够抑制消化道癌症,同时还能够有效调节免疫系统,具有较强的抗菌作用,成为多种药材的主要成分[1-3]。甘薯含有的膳食纤维和亚油酸有助于清除和减少血液中的胆固醇,有利于防止胃肠系统疾病。研究证实,甘薯在具有防癌保健作用的12种蔬菜中功效居首位,被誉为“抗癌之王”[4-5]。
近年来,随着甘薯栽培面积的逐年扩大和生态条件的改变,甘薯病毒病逐年加重,病毒种类增多,严重阻碍了甘薯的生产。甘薯病毒病是通过系统性感染而影响甘薯的生长发育,从而造成产量和品质的下降及甘薯种性的退化[6-8]。我国每年因甘薯病毒病造成的损失价值高达40亿元。目前,我国发现的甘薯病毒主要有甘薯羽状斑驳病毒(sweet potato feathery mottle virus,SPFMV)、甘薯潜隐病毒(sweet potato latent virus,SPLV)、甘薯脉花叶病毒(sweet potato vein mosaic virus,SPVMV)、甘薯轻斑驳病毒(sweet potato mild mottle virus,SPMMV)、甘薯黄矮病毒(sweet potato yellow dwarf virus,SPYDV)、甘薯卷叶病毒(sweet potato leaf curl virus,SPLCV)和甘薯凹脉病毒(sweet potato sunken vein virus,SPSVV)等[9-10]。其中,甘薯羽状斑驳病毒和甘薯潜隐病毒被认为是中国最流行和危害最大的两种病毒,感病植株出现幼苗长势弱、返苗慢,薯块小,薯皮色浅且薯块开裂褐变等症状[11-13]。目前防治甘薯病毒病最经济有效的方法是采用茎尖培养获得无病毒种苗[14-16]。Feng等[17]研究表明,茎尖大小影响甘薯的脱毒率,且脱毒率与茎尖大小成反比,但茎尖过小,取材难且再生率低。陈选阳等[18]研究表明,脱毒甘薯在整个生育期内叶绿素、净光合速率、N代谢等指标均有不同程度的提高。张海茹等[19]研究发现,脱毒甘薯能有效防止病毒病造成的产量和品质下降等问题,是恢复品种优良特性、实现增产增收的有效途径。研究发现,SPFMV感染甘薯对甘薯的产量影响不显著,而甘薯褪绿矮化病毒(sweet potato chlorotic stunt virus,SPCSV)感染甘薯后产量显著下降,两种病毒的双重感染导致产量下降幅度大于单独感染[20-22]。
目前研究多集中在脱毒对甘薯个别指标或少数指标的影响上,系统性研究脱毒对甘薯生长状况及生理生化指标影响的报道较少。本研究在前人研究的基础上,以云南高原蜜薯为试验材料,采用两因素四水平正交试验设计方法,研究不同激素浓度配比对茎尖再生植株的影响,筛选出茎尖离体再生的最佳激素配比;采用RT-PCR检测试管苗的带毒情况并获得脱毒种苗;研究脱毒甘薯种苗的生长情况、叶片的光合能力、主要营养和功能性成分含量以及相关保护酶的活性等方面。综合探讨脱毒对甘薯植株生长的影响,以期为甘薯脱毒种苗的生产以及推广提供重要的理论依据。
1 材料与方法
1.1 材料
云南高原蜜薯购自安徽江艺天汇农业科技有限责任公司。Nanodrop 2000微量核酸测定仪(Thermo Fisher Scientific)、日本Hirayama全自动灭菌器(华粤企业集团有限公司)、接种器械灭菌器(济南格艾特仪器设备有限公司)、SW-CJ-1D型单人单面垂直送风净化工作台(上海鼎科科学仪器有限公司)、UV-1800紫外分光光度计(日本京都岛津公司)、HW﹒SY11-K型电热恒温水浴锅(北京市长风仪器仪表公司)和D-37520台式冷冻高速离心机(Thermo Fisher Scientific)等。
1.2 方法
1.2.1 外植体材料的选择与培养 甘薯出苗后,剪取生长良好植株的茎尖顶端2 ~ 3 cm,在流水下冲洗30 min,置于无菌超净工作台上,用75%酒精消毒30 s,然后用0.1%升汞灭菌15 min,再用无菌水冲洗5 ~ 6遍,用无菌滤纸吸去表面多余的水分。用无菌的解剖刀和镊子切取0.1 ~ 0.2 mm微茎尖作为脱毒培养的外植体,置于蔗糖30 g·L-1+ 琼脂9 g·L-1以及含不同激素配比的MS培养基上培养,其中萘乙酸(naphthylacetic acid, NAA)的添加浓度分别为0、0.05、0.1 和0.5 mg·L-1,6-苄氨基腺嘌呤(6-Benzylaminopurine,6-BA)的添加浓度分别为0、0.1、0.5 和1.0 mg·L-1,pH值为5.8 ~ 6.0;采用正交试验设计方法,每个激素4个浓度水平,共16个处理,每个处理3次重复(表1)。 培养温度为(24 ± 2)℃,光照强度2 500~3 000 Lx,光照时间为12 h/d。当茎尖分化形成小苗时,将无菌苗的单茎叶侧芽向上,转接到生根培养基中诱导生根,生根培养基的基本成分为1/2 MS,分别添加浓度为0、0.1、0.3 和0.5 mg·L-1的NAA,每瓶接种4株,每个处理接种4瓶,重复3次。

表1 甘薯茎尖培养正交设计试验Table 1 Orthogonal experiments on meristem tip culture of sweet potato
当试管苗长到5 ~ 7片叶时,提取试管苗叶片总RNA,RT-PCR检测试管苗的带毒情况,引物序列如表2所示。经检测为无毒的试管苗一部分继续快繁保存,一部分移入覆盖有防虫网的无菌基质中培养。

表2 病毒引物序列Table 2 Virus primer sequences
1.2.2 无菌苗生长相关指标的测定 取无菌苗和对照苗(三叶一心)进行扦插,扦插苗成活后,每隔30 d记录甘薯蔓长、叶片数、叶宽、叶长、分枝数及茎粗等;利用Li-6800型光合测定仪测定叶片的光合参数,计算净光合速率,叶绿素的含量参照蔡蕊[23]的方法测定;还原糖、可溶性糖、可溶性蛋白质含量参照王学奎的测定方法[24],维生素C含量的测定参照马宏飞等[25]的方法;叶片黄酮类化合物的测定参照张匀等[26]的方法,绿原酸含量参照王静[27]的方法测定,多酚类物质的测定参照赵文静[28]和Liu[29]等的方法;过氧化物酶(Peroxidase, POD)活性测定参照吴晓宇[30]的方法,超氧化物歧化酶(Superoxide dismutase, SOD)、过氧化氢酶(Catalase, CAT)、丙二醛(Malondialdehyde, MDA)等酶活性参照王学奎的方法测定[24]。
1.2.3 数据分析 试验数据采用Excel 2013、SPSS 13.0、SigmaPlot.v10.0进行统计分析(P< 0.05为差异显著,P< 0.01为差异极显著)。
2 结果与分析
2.1 不同激素配比对甘薯茎尖分生组织培养的影响
在MS固体培养基中添加不同浓度的NAA和6-BA,利用正交试验设计研究不同浓度NAA和6-BA配比对茎尖培养再生的影响。结果发现,NAA在甘薯茎尖培养再生过程中起主要作用,6-BA起次要作用。从根的生长情况看,X7高于其他试验处理,为3.54 cm;从新生叶片数来看,X7、X12和X13高于其他试验处理,分别为7.08、6.04和6.04片;从茎节增长数来看,X7、X13和X15高于其他处理,分别为7.50、7.17和5.04 cm。因此,综合根生长数、新生叶片数、茎节增长数等指标来看,X7为甘薯脱毒试管苗再生较优的处理组合,即MS + 0.1 mg·L-16-BA + 0.1 mg·L-1NAA + 30 g·L-1蔗糖 + 7 g·L-1琼脂(表3)。

表3 不同激素配比对茎尖培养再生的影响Table 3 Effects of different hormone ratios on regeneration of shoot tip culture
2.2 试管苗的继代增殖
以1/2 MS为基本培养基,加入终浓度分别为0.1、0.3 和0.5 mg·L-1的NAA溶液,以不加NAA的处理为对照。结果发现,不同浓度的NAA对试管苗的生根数影响不同,以0.1 mg·L-1NAA 处理最好,达到显著水平。另外,培养基含0.1 mg·L-1NAA也有利于试管苗生长,其新生叶片数和茎节数也都显著高于其他处理(表4)。

表4 不同NAA浓度对甘薯试管苗增殖的影响Table 4 Effect on proliferation of NAA concentration in vitro
2.3 试管苗的病毒检测
试验利用羽状斑驳病毒、褪绿矮化病毒及潜隐病毒核酸序列的特异性引物分别对试管苗进行RT-PCR扩增。结果显示,23个样本中有9个样品扩增到羽状斑驳病毒的核酸序列,脱毒率为60.9%(图1 A);利用褪绿矮化病毒及潜隐病毒核酸序列特异性引物分别对14个样品进行扩增,结果均未检测到病毒的存在,脱毒率均为100%(图1 B,C)。
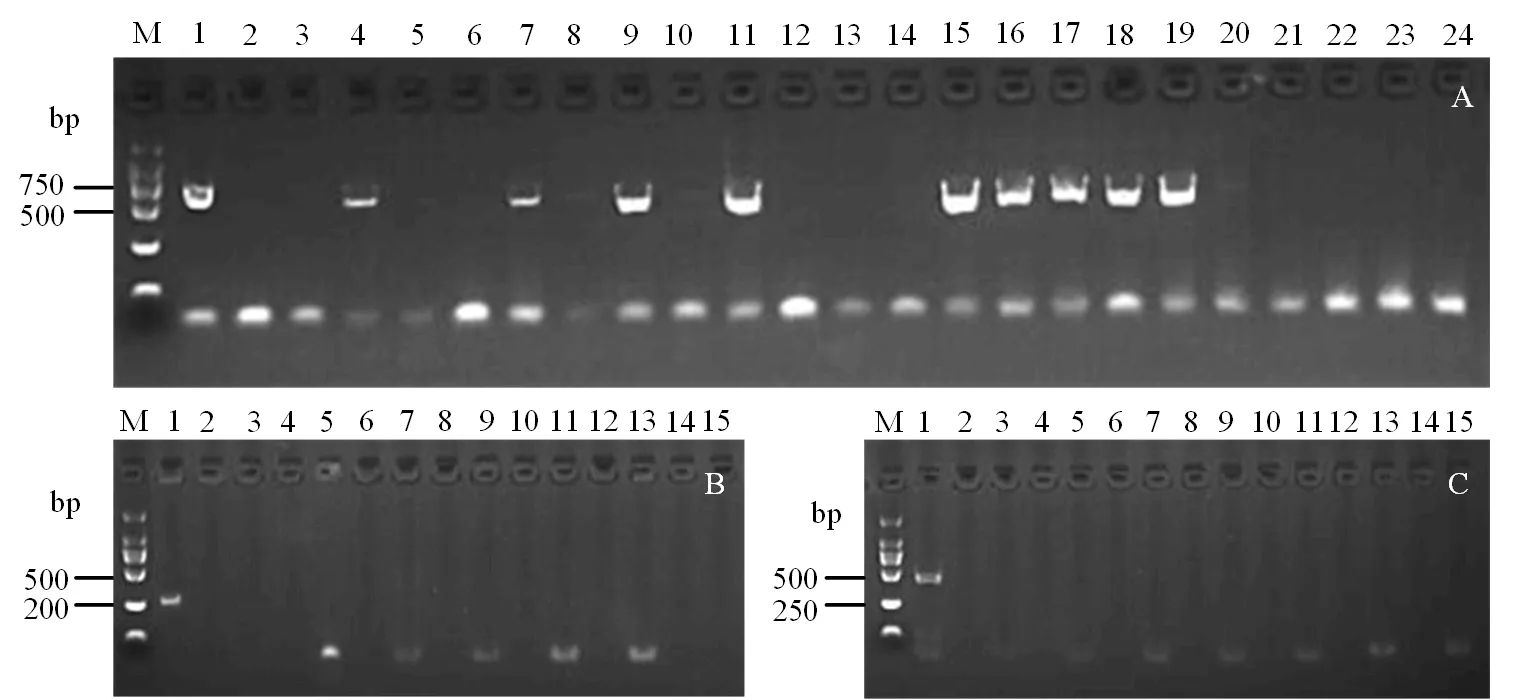
图1 甘薯病毒的RT-PCR检测结果Figure 1 RT-PCR detection results of sweet potato virus
2.4 甘薯脱毒苗的主要形态指标变化
试验剪取脱毒甘薯苗(三叶一心),扦插于安徽农业大学农萃园蔬菜基地,以未脱毒甘薯苗为对照,按照常规管理,分别在扦插后30、60、90、120 及150 d统计植株的茎粗、蔓长、分枝数、主蔓叶片数、叶宽、叶长等。结果发现,随着扦插时间的延长,扦插苗的各项指标增长迅速,以扦插后90 d达到生长高峰,且脱毒苗各时间点的形态学指标均高于未脱毒苗;随着时间的推移,各项指标变化趋向平缓,说明植株地上部分的生长速度开始趋向缓慢,但脱毒植株的生长状态一直优于对照(图2)。

图2 甘薯脱毒苗主要形态指标的变化Figure 2 Changes of main morphological indexes in sweet potato leaves
2.5 甘薯脱毒苗的生理指标变化
2.5.1 甘薯脱毒苗的光合指标变化 叶绿素是叶片吸收光能的基质,扦插后30、60和90 d分别测定脱毒苗及未脱毒苗叶片中的叶绿素含量。图3表明,扦插苗叶片叶绿素含量逐渐上升,在扦插后60 d达到最高,随着扦插时间的推移,扦插苗叶绿素含量呈现下降趋势。在整个测定期内,脱毒苗叶片的叶绿素含量均高于未脱毒苗,达到显著水平。

图3 甘薯脱毒苗光合指标的变化Figure 3 Changes of photosynthetic indexes in sweet potato leaves
净光合速率是植株光合作用的重要指标,利用Li-6800型光合测定仪测定脱毒苗及未脱毒苗的光合参数。结果表明,随着光合有效辐射(PAR)的增加,净光合速率(Pn)呈上升趋势,当PAR= 200 μmol·m-2·s-1时,Pn数值开始急剧上升;随着光合有效辐射的增加,脱毒植株与普通苗的净光合速率差距增大,在PAR= 2 000 μmol·m-2·s-1时,净光合速率达到最大值,为30.08 μmol·m-2·s-1(图3)。另外,甘薯脱毒苗在净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)等指标上明显优于未脱毒植株,其中,Pn增幅为26.81%,差异显著;Tr增大100%,差异显著;Gs增幅为25.61%,差异极显著;Ci降低了1.11%,差异显著。
2.5.2 甘薯脱毒苗的营养成分及功能性成分变化
为研究脱毒甘薯叶片中主要营养成分及功能性成分的含量变化,试验测定了扦插后30、60 和90 d甘薯叶片中可溶性糖、还原糖、可溶性蛋白及维生素C的含量变化。结果发现,在测定时间内,所有指标的含量均比对照高,而且随着扦插时间的延长,各项指标呈现增加的趋势。扦插后30、60 和90 d,脱毒苗较普通苗叶片可溶性糖含量增幅分别为28.89%、80.85%和24.74%,差异显著;还原糖含量在扦插后60 d差异不显著,而扦插后90 d,可溶性糖增幅为62.69%,与对照差异显著;可溶性蛋白的变化趋势与可溶性糖相似,在扦插后30、60 和90 d时间内,脱毒苗较普通苗叶片可溶性蛋白质增幅分别为41.03%、16.80%和43.90%,差异达显著水平;扦插后30 d,脱毒苗较普通苗叶片VC含量增幅为138.66%,差异达极显著水平,后期增幅平稳(图4)。黄酮类化合物是一种良好的活性自由基清除剂,具有调整免疫和内分泌作用;绿原酸是在植物代谢过程中产生的有机酸,可以清除细胞中的氧自由基,保护组织免受氧化胁迫,防止细胞发生癌变;多酚类物质具有抗氧化、降血糖、抗菌消炎、抗肿瘤、保护肝脏和免疫调节等作用。试验测定了脱毒苗及对照苗叶片中黄酮类化合物、绿原酸及多酚类化合物的含量变化,结果发现脱毒苗和普通苗叶片黄酮类化合物、绿原酸以及多酚的变化趋势相同,均随扦插天数的增加而升高。扦插30 d和60 d时脱毒苗较普通苗叶片中黄酮类化合物含量的增幅分别为25.83%和16.80%,差异显著;扦插后90 d,增幅达到64.79%,差异达极显著水平,而多酚和绿原酸含量在整个生长期两者均差异显著(图4)。

图4 甘薯脱毒苗的营养成分及功能性成分变化Figure 4 Changes of nutritional and functional components in sweet potato leaves
2.5.3 甘薯脱毒苗相关酶活性的变化 植物在正常代谢过程中以及受到病源物侵染都会引起氢氧根负离子(OH-)、羟基自由基(.OH)、过氧化氢(H2O2)、超氧阴离子自由基(O2-)等活性氧自由基的产生和积累。正常情况下,植物细胞内活性氧自由基的产生与清除处于动态平衡状态,但当植物遭到病毒入侵时,植物细胞正常的生理代谢活动受到影响,造成体内活性氧自由基积累增加。为了清除体内活性氧自由基的积累,植物体内相关的保护酶系统被激活,用来清除体内的活性氧、保护细胞质膜和维持自由基平衡。试验测定了脱毒苗和对照组叶片中SOD、POD及CAT酶的活性。结果显示,在扦插后不同时间,脱毒苗的3种保护酶活性均显著高于对照组,其中扦插后90 d,脱毒苗较对照组叶片POD活性增幅为136.1%,差异达极显著水平(图5)。
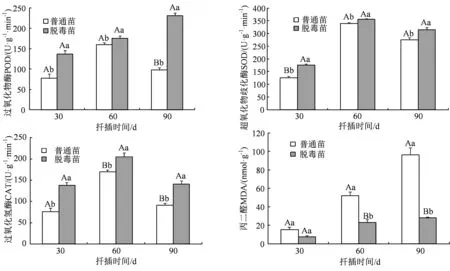
图5 甘薯脱毒苗相关酶活性的变化Figure 5 Changes of related enzymes in sweet potato leaves
MDA作为膜脂过氧化的重要指标,MDA含量高,植物细胞膜的过氧化程度就高,细胞膜受到的伤害就严重。因此MDA含量高低在一定程度上反映植物细胞膜脂过氧化水平和膜结构受伤害程度及植株自我修复的能力。试验测定了脱毒苗及对照组叶片的MDA含量,结果发现,扦插后不同时间,对照组叶片中MDA的含量均显著高于脱毒苗,在扦插后30、60和90 d,脱毒苗叶片中MDA比对照组分别降低了107.76%、125.23%和244.25%(图5)。
3 讨论与结论
植物病毒对园艺植物的侵染造成产量下降和品质降低,导致巨大的经济损失[31-32],采用茎尖分生组织培养是目前行之有效的脱毒方法。Verma等[33]以菊花茎尖作为外植体,以MS + 2 mg·L-1BAP +0.05 mg·L-1IBA培养基进行芽增殖,获得了72%的脱毒效率;Wondimu等[34]研究表明,MS + 0.5 mg·L-1BAP + 0.5 mg·L-1Kin进行甘薯茎尖芽增殖最好,脱毒率高达99%。本研究结果表明,脱毒苗快速繁殖的关键技术在于对剥离的茎尖组织的诱导分化,在培养基中加入适量的6-BA和NAA有利于芽的诱导分化,但浓度大小要适中,过高或过低不仅不能诱导分化,反而起抑制作用。
Ying等[35]研究表明,甘薯脱毒植株的叶绿素含量、叶面积、叶片数、基部直径和侧蔓数均显著高于普通苗。本研究采用微茎尖分生组织培养技术得到的脱毒苗,长势快、叶数多、叶片大、分枝数多、蔓长而粗,叶绿素含量增加,净光合速率和净同化率均比对照高。另外,本研究结果显示,甘薯脱毒苗的黄酮类化合物、绿原酸、多酚等功能性成分的含量也明显提高,而这些功能性成分具有抗菌、消炎、提高免疫力、抗癌和延缓衰老等作用[36-38]。正常情况下,植物细胞内活性氧自由基的产生与清除处于动态平衡状态,但当病毒入侵时,植物细胞正常的生理代谢活动受到影响,会使活性氧自由基积累增加,植物体内超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)等植物内源保护酶共同担负着清除活性氧、保护细胞质膜、维持自由基平衡的重要功能[39-40]。Wang等[41]研究表明,随着生育期的进行,甘蔗脱毒苗体内超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)的活性逐渐高于感染苗,脱毒苗的抗逆能力、产量和品质也得到提高,还原糖和蔗糖等含量也均高于感染苗。本研究的结果也证实,脱毒苗的保护酶活性、糖含量、维生素C和可溶性蛋白等均高于普通苗。MDA含量常作为膜脂过氧化的指标之一,MDA含量高低可在一定程度上反映植物细胞膜脂过氧化水平和膜结构受伤害程度及植株自我修复的能力。有研究表明,菊花脱毒苗的MDA含量明显低于带毒苗,其膜脂稳定性也高于非脱毒苗[42-43]。本研究测得甘薯脱毒苗的MDA含量明显低于普通苗,说明脱毒苗比普通苗可能具有较强的抵抗逆境胁迫能力。
植物感染病毒后,导致光合作用减弱,呼吸作用增强,加速植株衰老。陈选阳等[18]认为,脱毒可能避免了病毒对叶绿素或光合传递链的破坏,消除了对营养物质的竞争或对其他结构的负面影响,从而提高了净光合速率。吴玉霞[40]认为病毒进入植物细胞后,病毒的核酸在植物细胞内不断复制,干扰植株的正常生理机能,植物膜系统发生改变,膜脂过氧化程度提高。脱毒提高了保护酶活性,这可能是因为脱毒苗细胞中的病毒颗粒水平较低,从而对细胞亚显微结构的破坏程度较轻,细胞活性氧自由基含量也相应较低,是植物适应和抵抗病害的一种有效方式,从而改善和恢复植株的正常代谢,对提高产量、改善品质起到重要作用。本试验中甘薯植株部分性状易受栽培环境条件的影响,造成了研究结果之间存在一定的偏差,但本研究结果可以证实,在整个测定期内脱毒苗的各项生理生化指标均明显优于普通苗。该研究结果可为甘薯的脱毒培养以及脱毒苗的推广应用提供重要的理论依据。
