适宜药渣栽培的灵芝优良菌株筛选与鉴定*
2021-10-14亓小妮郭雅琳刘养山杜秀菊
张 鑫,谢 苗,亓小妮,郭雅琳,刘养山,张 景,杜秀菊
(聊城大学生命科学学院,山东 聊城 252000)
灵芝是中药之宝,素有“仙草”之美誉。最早关于灵芝的记载是《神农本草经》,其中评价灵芝为“上上之药,方中妙品”[1],现代药理学和临床实践进一步证实了灵芝的药理作用,并证实了多糖和三萜是灵芝的主要活性成分,具有抗氧化、抗肿瘤、保肝护肝、降血糖、治疗神经衰弱等药理作用,可以强身健体,延年益寿[2]。目前,灵芝常以生药材、药用制剂、保健品饮品等商品面向市场[3]。
我国药渣年产量每年高达3.4×107t,大多作为废弃物堆放、填埋或焚烧[4],造成了严重的环境污染和资源浪费。研究表明,药渣保留了粗纤维和粗脂肪等有效成分,是培养药用真菌的优良原料[5]。
为找出适合中药渣培养的灵芝品种,对9种来源不同的灵芝菌株进行了菌种长势观察和出芝试验,基于ITS基因序列同源性关系建立系统发育树并鉴定其亲缘关系[6]。为合理开发中药渣剩余价值变废为宝提供理论依据,对灵芝产业的代料栽培拓展空间。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株来源
9种灵芝菌株名称及来源见下表1。
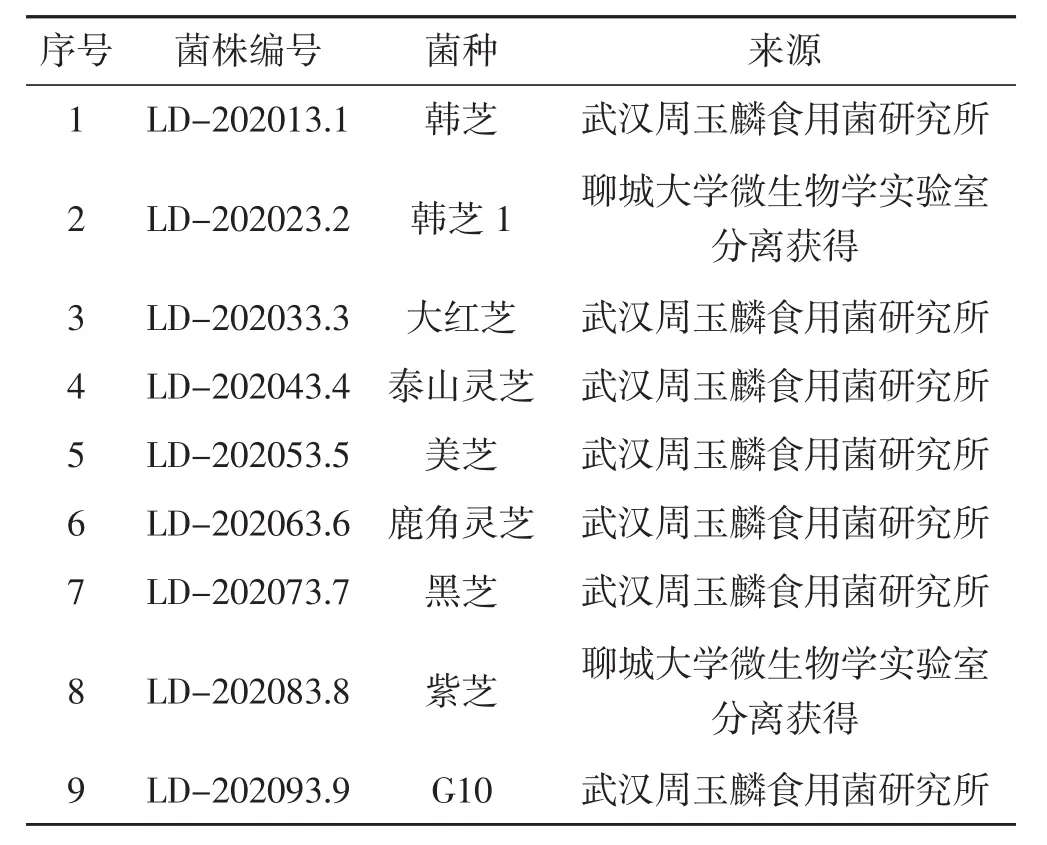
表1 供试菌株编号及其来源Tab.1 Numbers and sources of tested strains
如表1所示,9种灵芝菌株中,7种菌株购于武汉周玉麟食用菌研究所,其他2种灵芝菌株(LD-202023.2和LD-202083.8) 为聊城大学微生物学实验室从灵芝组织中分离获得,其子实体来源于山东冠县灵芝栽培基地,冠县是全国最大灵芝栽培基地,但冠县灵芝长期存在量多价低的现象。
1.1.2 培养基
菌种活化培养基CPDA:马铃薯200 g、葡萄糖20 g、琼脂20 g、磷酸二氢钾3 g、硫酸镁1.5 g,补足纯水至1 000 mL,pH自然。
菌种扩繁培养基CYPDA:马铃薯200 g、葡萄糖20 g、琼脂20 g、磷酸二氢钾3 g、硫酸镁1.5 g、药渣200 g,纯水补足至1 000 mL,pH自然。
菌丝体培养液体培养基:马铃薯200 g、葡萄糖20 g、磷酸二氢钾3 g、硫酸镁1.5 g、药渣200 g,纯水补足至1 000 mL,pH自然。
二级药渣栽培料配方:中药渣60%、麦麸38%、石膏1%、葡萄糖1%、磷酸二氢钾0.4%,料液比约为 1∶1.1~1∶1.3。
1.2 试验方法
1.2.1 菌种活化及扩繁
在无菌环境下,从9株灵芝菌种的CPDA试管培养基中,挑取菌丝浓、白、健壮的小块菌丝体接入到CYPDA扩繁平板培养基,27℃培养箱中暗培养5 d~7 d。
1.2.2 灵芝菌株的平板菌丝长势
用打孔器从每块扩繁平板中均匀选取相同数量、大小相等的纯化菌丝体接入到新的CYPDA平板培养基中,每个平板接种1块。每日测量菌块直径大小,观察其形态、色泽、密度、边缘整齐程度[7],计算菌丝的日生长速率,每个菌株设置3次平行试验。
1.2.3 液体培养基中菌丝长势
1.2.1中的CYPDA培养基培养5 d~7 d后,选取2块直径1 cm的圆形菌块,接入到150 mL液体培养基。接种后的液体培养基于摇床25℃、150 r·min-1恒温避光培养1周,观察菌丝球形态、颜色、大小、密度、培养基颜色及生物量等指标[8]。
1.2.4 瓶式栽培培养基中菌丝长势
通过一级培养(1.2.2和1.2.3)观察菌丝在固体培养基和液体培养基中的长势,筛选出长势较好的灵芝菌种进行瓶栽二级培养。观察菌丝在二级药渣栽培料中适应程度及生长特征,进一步筛选出药渣适栽培优良灵芝菌种。
1.2.5 菌丝体DNA提取及凝胶电泳检测
DNA的提取参照童森淼等[9]和张杰等[10]的方法,并略有改进。选取形态大小适宜的菌丝球,用无菌水清洗后离心去沉淀,-80℃冷冻过夜用于提取DNA[11]。冷冻的菌丝体经高通量组织研磨器研磨,使用CTAB法提取DNA,苯酚∶氯仿∶异戊醇(25∶24∶1) 去除蛋白,异丙醇沉淀DNA,酒精洗涤,在TE缓冲液中溶解并保存。1.0%的琼脂糖凝胶,50×TAE为电泳缓冲液,上样量为1 μL,121 V电压电泳35 min,检测DNA样品纯度[12]。
1.2.6 ITS-PCR扩增及序列测定
采用真菌核糖体基因间隔区通用引物ITS1和ITS4(ITS1:TCCGTAGGTGAACCTGCGG;ITS4:TCCTCCGCTTATTGATATGC) 进行PCR扩增[13]。引物由金唯智生物科技有限公司合成,扩增在Bio-Rad T100 PCR仪上进行。
采用25 μL反应体系:2×Taq mix(东盛生物科技有限公司) 12.5 μL,DNA 模板 2 μL,ddH2O 8.5 μL,下游引物(10 μmol·L-1)各1 μL,总体积25 μL。反应条件:95℃预变性5 min,95℃变性30 s,48℃退火30 s,72℃延伸1 min,30个循环;72℃延伸10 min。
PCR扩增产物用1.0%琼脂糖凝胶电泳检测,在UVP凝胶成像系统下成像保存。PCR扩增产物由金唯智生物科技有限公司进行单向测序。测得的序列用BioEdit软件处理后提交至GenBank[14]。
1.2.7 ITS序列分析
测得的序列根据GenBank上已有的灵芝菌株序列运用Blast对获得的同源序列进行对比分析。通过对9个样品的ITS序列对比,用BioEdit对构树进行编辑[15],再用Muscle进行多次序列排列,最后用MEGA X构建系统发育树:按照N.J.(Neighbor-joining) 邻接法,以猴头菌属(Hericium) 为外群,经Bootstrap重复构建循环1 000次,来检验所构建进化树的可靠性。
2 结果分析
2.1 试验灵芝菌株的菌丝长势
采用Duncan新复极差法[16],得到9个灵芝菌株在相同CYPDA药渣培养基中的生长状况,详见表2。
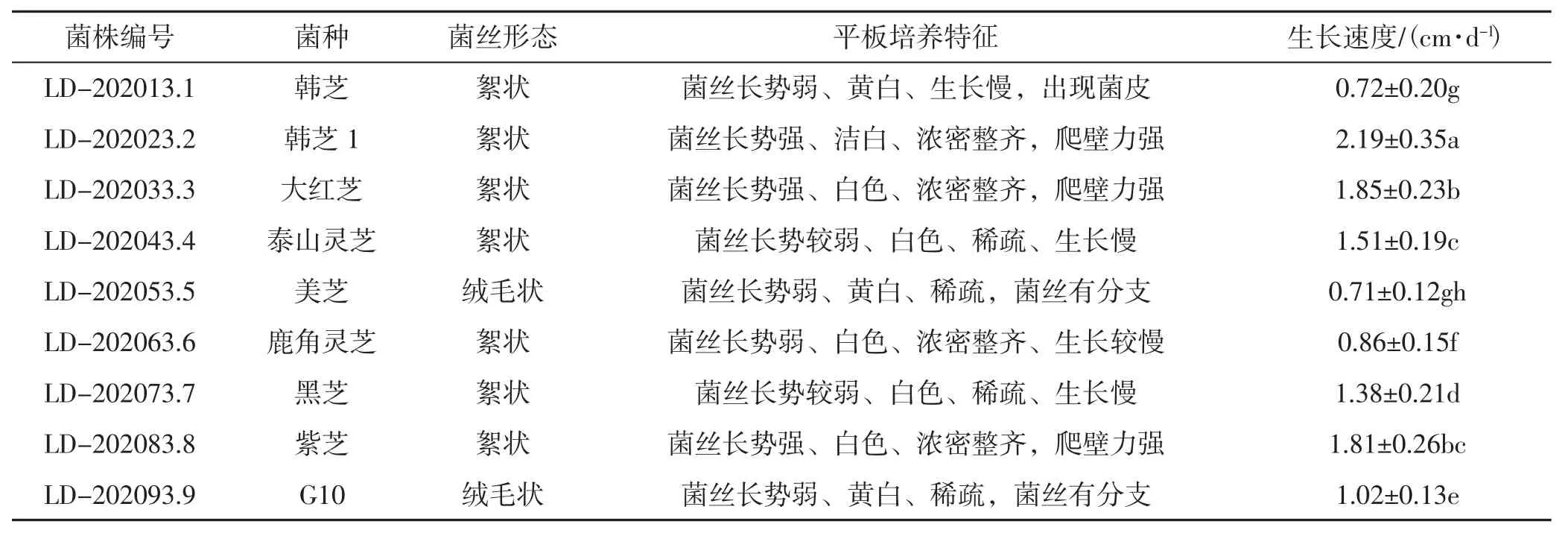
表2 9种灵芝菌株的平板菌丝长势Tab.2 mycelial growth of nine Ganoderma lucidum strains on plate
如表2所示,韩芝1(LD-202023.2) 生长速度最快,可达(2.19±0.35) cm·d-1;其次是大红芝 (LD-202033.3) 和紫芝 (LD-202083.8) 生长速度较快,分别达到 (1.85±0.23) cm·d-1和(1.81±0.26) cm·d-1;美芝 (LD-202053.5) 和韩芝 (LD-202013.1) 生长速度较慢,分别为(0.71±0.12) cm·d-1和 (0.72±0.20) cm·d-1。
2.2 液体培养基菌种长势
在25℃、150 r·min-1恒温避光摇床的相同培养条件下,9种灵芝菌株在液体培养基中的生长状况见表3。

表3 9种灵芝菌株液体培养长势Tab.3 Growth of nine Ganoderma lucidum strains with liquid cultivation
如表3所示,韩芝(LD-202013.1)、泰山灵芝(LD-202043.4)、鹿角灵芝 (LD-202063.6) 和 G10(LD-202093.9) 的菌丝球为刺状;大红芝(LD-202033.3) 和紫芝 (LD-202083.8) 的菌丝球为梭状;美芝 (LD-202053.5) 和黑芝 (LD-202073.7)的菌丝球为圆球状;韩芝1(LD-202023.2) 的菌丝球为颗粒状。韩芝1(LD-202023.2)、大红芝(LD-202033.3) 和紫芝(LD-202083.8) 的菌丝球数量较多且生长较快,且除韩芝 (202013.1) 和美芝(202053.5)以外,其他菌株的菌丝球大小都均匀。
2.3 瓶式栽培培养基中菌丝长势
结合平板培养和液体培养菌丝生长情况,挑选了韩芝1(LD-202023.2)、大红芝(LD-202033.3)、泰山(LD-202043.4)、黑芝(LD-202073.7)、紫芝(LD-202083.8) 5个菌种进行瓶式栽培,培养菌丝生长状况见表4。

表4 瓶式栽培培养基中5种灵芝菌种的菌丝长势Tab.4 Mycelial growth of five Ganoderma lucidum strains in bottle culture medium
如表4所示,在药渣培养基中,大红芝、韩芝、紫芝3个菌株的菌丝生长速度较快且菌丝最为粗壮、浓密、纯白。黑芝和泰山灵芝,生长速度较慢,菌丝长势一般。菌株的菌丝长势强弱可以作为评价灵芝菌株优劣的重要指标[17],综合各项指标,大红芝、韩芝、紫芝3个菌株更适合于药渣培养基进行栽培。
2.4 子实体形态及生物学效率比较
一级、二级培养优良菌株中,选择韩芝1(LD-202023.2)、紫芝(LD-202083.8) 2种长势较好的灵芝菌株进行三级栽培管理,采用直径10 cm、长30 cm的高密度聚乙烯菌袋。其菌盖生长情况和生物学效率见表5。

表5 子实体形态及生物学效率Tab.5 Fruit body morphology and biological efficiency
如表5所示,紫芝(LD-202083.8) 和韩芝1(LD-202023.2)的生物学效率均达到30%以上。
2.5 DNA电泳图分析
9个灵芝ITS-PCR电泳图见图1。
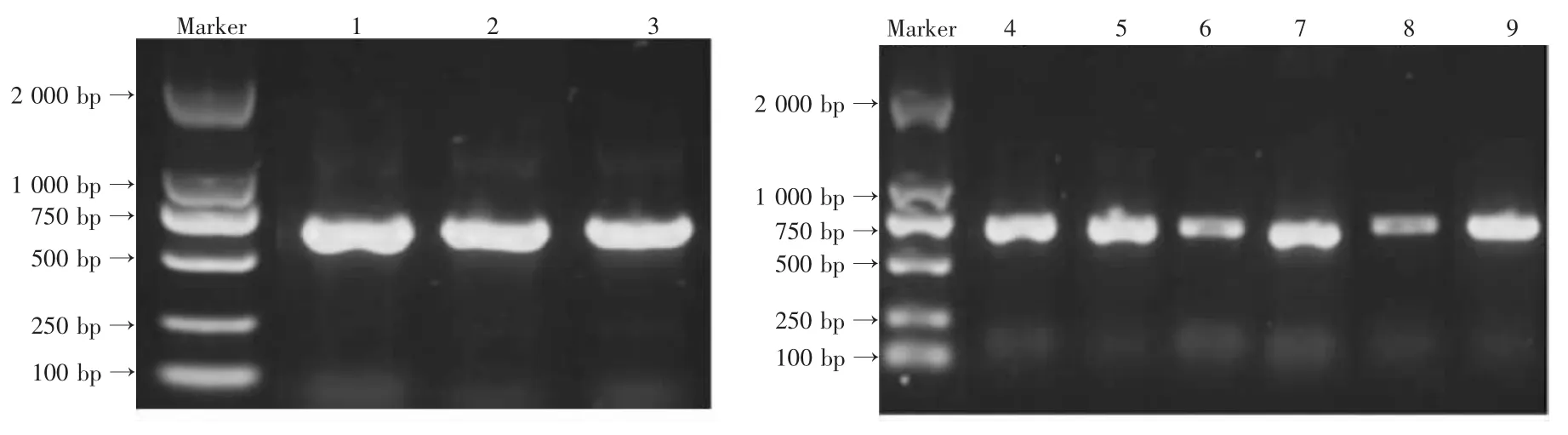
图1 供试灵芝菌种ITS-PCR电泳图Fig.1 ITS-PCR electrophoresis of tested Ganoderma lucidum strains
如图1所示,9个灵芝菌株样品均有较为清晰的扩增条带,菌株的ITS-PCR序列的片段在750 bp左右,在长度上具有比较好的保守性,表明此特异引物具有较强的特异性,适用于灵芝菌种的分子鉴定[18]。
2.6 系统发育树分析
测序结果登录NCBI经Blast比对。韩芝1(LD-202023.2) 与 NR 164049.1(G.sandunense) 的期待值(E值)为0,有效序列长度高达97%,相似度为95.95%;大红芝 (LD-202033.3) 与 NR 132919.1(G.desttructans) 的期待值为0,有效序列长度高达100%,相似度为94.77%;紫芝(LD-202083.8) 与NR 132919.1(G.desttructans) 的期待值为0,有效序列长度高达100%,相似度为94.86%,确定这三个菌株均为Ganoderma的不同株系。选取相似度高的前7个序列,基于ITS基因使用邻近法所构建的系统发育树见图2。
由图2可以看出,菌株韩芝(LD-202013) 与NR 152892.1(G.sichuanense)、泰山灵芝 (LD-202043.4)、美芝(LD-202053.5)、鹿角灵芝(LD-202063.6)、G10(LD-202093.9) 等菌株的 ITS序列同源性较高,序列一致为99.26%;黑芝(LD-2020273.7) 与 NR 164048.1 (G.nasalanense) 菌株的同源性较高,序列一致性为94.21%;紫芝(LD-202083.8) 与韩芝1(LD-202023.2)、大红芝(LD-202033.3)的菌株的同源性较高。
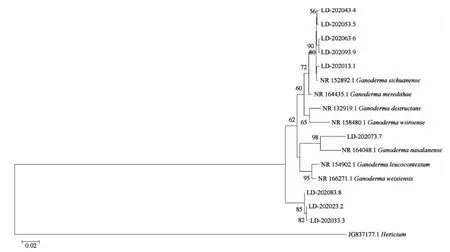
图2 基于ITS的系统发育树Fig.2 Phylogenetic tree based on ITS
系统发育树结果显示,韩芝(LD-202013.1)、泰山灵芝 (LD-202043.4)、美芝 (LD-202053.5)、鹿角灵芝 (LD-202063.6)、G10(LD-202093.9) 与NR 164435.1(G.meredithae) 聚为一支,与 NR 152892.1(G.sichuanense)的遗传距离最小,亲缘关系最近;黑芝(LD-2020273.7) 与NR 158431.1(G.angustisporum) 聚为一支,与NR 164048.1(G.nasalanense)的遗传距离最小,亲缘关系最近[19];菌株紫芝(LD-202083.8)与韩芝1(LD-202023.2)、大红芝(LD-202033.3)聚为一支且遗传距离最小,亲缘关系最近。
3 结论与讨论
经过一级、二级、三级菌种的药渣栽培试验,以9个菌株的菌丝长势和灵芝子实体性状为主要依据进行筛选。结果表明,韩芝1(LD-202023.2)、大红芝(LD-202033.3) 和紫芝(LD-202083.8) 更适合药渣栽培。
已有的研究表明,灵芝属ITS序列的种间序列相似性低于94%,种内相似性高于98%[20]。通过对9种灵芝菌株的ITS序列与NCBI中检索的7种相似序列进行系统发育树分析,表明韩芝(LD-202013.1)、黑芝 (LD-2020273.7) 分别与 NR 164435.1(G.meredithae)、NR 132919.1 (G.destructans) 相似度高达100%,应属于同一种;紫芝(LD-202083.8) 与韩芝1(LD-202023.2)、大红芝(LD-202033.3) 相似度高达99%,应属于同一种[21]。
适合药渣栽培的3个菌株:韩芝1(LD-202023.2)、大红芝 (LD-202033.3) 和紫芝 (LD-202083.8),韩芝1菌丝长势最强,为药渣栽培的最佳菌株。得到最佳菌株,即可充分利用药渣的剩余价值,变废为宝,有望能够完全或部分替代木糖醇渣或棉籽壳等传统主料,节约成本、提高投入产出比,有助于乡村振兴,促进生态文明建设。
