左卡尼汀联合高通量血液透析改善尿毒症患者贫血及微炎症状态的影响
2021-10-13陈奕蒙
陈奕蒙
(辽宁省辽阳市中心医院,辽宁辽阳 111000)
尿毒症发病率呈逐年上升的趋势,且具有较高的死亡率,主要临床表现为食欲不振、恶心呕吐、水肿、意识障碍等症状。目前,临床多采用高通量血液透析治疗该病,虽然高通量血液透析能清除患者体内大部分毒素,但长期治疗易导致相关并发症,贫血为其中最常见的并发症[1]。部分患者在应用重组人类促红细胞生成素治疗后能有效改善贫血状态,但也有部分患者由于存在耐药性,治疗效果不佳。此外,长期的血液透析还会使患者由于肾脏合成障碍、摄入不足及透析丢失等原因造成体内左卡尼汀缺乏,从而加重患者微炎症,导致心血管疾病的发生,危及患者的生命安全[2-3]。左卡尼汀能通过外源性补充患者体内左卡尼汀,改善微炎症状态。基于此,本研究旨在探讨左卡尼汀联合高通量血液透析对改善尿毒症患者贫血及微炎症状态的影响,现报道如下。
1 资料与方法
1.1 临床资料回顾性分析2019年1月至2020年1月本院收治的120例尿毒症患者的临床资料,根据不同的治疗方式分为对照组和观察组,每组60例。观察组男32例,女28例;年龄25~70岁,平均年龄(45.89±15.26)岁;原病理分型:慢性肾炎27例,糖尿病肾病20例,高血压肾病7例,多囊肾病6例。对照组男33例,女27例;年龄24~72岁,平均年龄(46.15±15.67)岁;原病理分型:慢性肾炎28例,糖尿病肾病21例,高血压肾病6例,多囊肾病5例。两组患者临床资料比较差异无统计学意义,具有可比性。所有患者均对本研究知情同意,并自愿签署知情同意书。本研究已通过本院医学伦理委员会审核批准。
1.2 纳入及排除标准纳入标准:符合尿毒症诊断标准[4]者;Hct<25%,Hb 60.00~90.00 g/L者;有认知、书写、沟通能力者;临床资料完整者。排除标准:存在肝功能异常、心血管等严重疾病者;1个月内出现大出血、严重性急性感染或病毒感染者;严重精神系统疾病者;存在严重高血压、心力衰竭及消化性溃疡者;过敏体质者;先天性心脏疾病者;凝血功能障碍者。
1.3 方法
1.3.1 对照组给予高通量血液透析,采用一次性空心纤维高通量透析器(江苏朗生生命科技有限公司,国械注准20153450479,型号:LSHT200-A),透析液为碳酸氢盐,离子浓度为钙离子1.5 mmoL/L,钠离子138 mmoL/L,钾离子2.0 mmoL/L,透析液温度为36℃,环境温度为23℃,每周3次,每次4 h;透析同时皮下注射重组人红细胞生成素注射液(山东阿华生物药业有限公司,国药准字S19980001)50 IU/kg。
1.3.2 观察组在对照组基础上加用左卡尼汀(瑞阳制药有限公司,国药准字H20193102,规格:5 mL∶1 g),于透析结束后2~3 min内,根据患者体质量10~20 mg/kg,静脉推注。两组均治疗3个月。
1.4 观察指标①比较两组血常规:分别于治疗前、治疗3个月后,采集患者晨起空腹静脉血5 mL,采用血液细胞分析仪(济南金浩峰技术有限公司,鲁械注准20182400095,型号:SMART-I)检测红细胞计数(RBC)、血红蛋白(Hb)、血细胞比积(Hct)。②比较两组生化指标:分别于治疗前、治疗3个月后,采用血液细胞分析仪检测血清肌酐(Cr)、尿素氮(BUN)、白蛋白(ALB)、β2微球蛋白(β2-MG)。③比较两组微炎症指标:分别于治疗前、治疗3个月后,采集患者晨起空腹静脉血5 mL,3 500 r/min离心10 min,取血清,采用酶联免疫吸附测定白细胞介素-6(IL-6)、肿瘤坏死因子(TNF-α)水平,采用免疫比浊法测定超敏C-反应蛋白(hs-CRP),试剂盒购自北京普恩光德生物科技开发有限公司,严格按照说明书操作。④比较两组不良反应发生率,包括恶心呕吐、头痛、皮肤瘙痒。
1.5 统计学方法采用SPSS 23.0统计软件进行数据分析,计量资料以“±s”表示,比较采用t检验,计数资料以[n(%)]表示,比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组治疗前后血常规比较治疗后,两组RBC、Hb、Hct均高于治疗前,且观察组高于对照组,差异有统计学意义(P<0.05),见表1。
表1 两组治疗前后血常规比较(±s)Table 1 Comparison of blood routine before and after treatment between the two groups(±s)
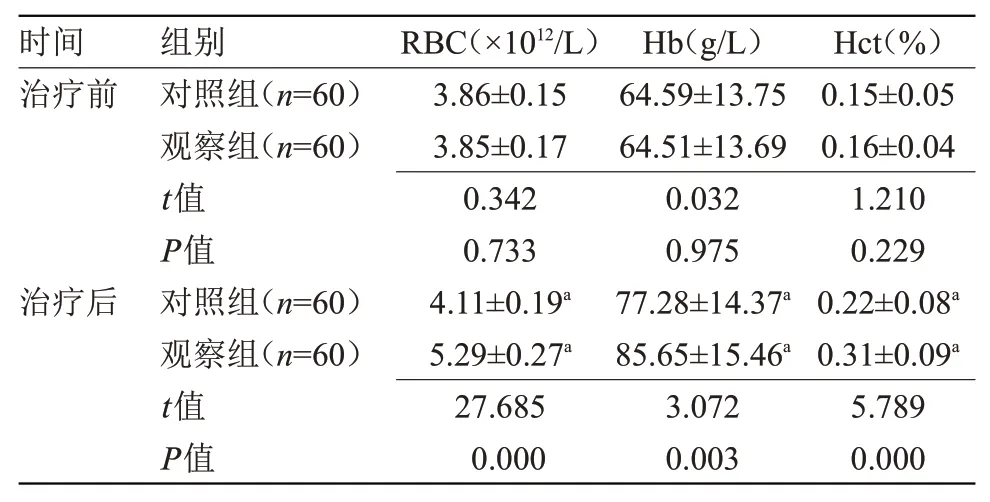
表1 两组治疗前后血常规比较(±s)Table 1 Comparison of blood routine before and after treatment between the two groups(±s)
注:RBC,红细胞计数;Hb,血红蛋白;Hct,血细胞比积。与本组治疗前比较,aP<0.05
时间治疗前治疗后组别对照组(n=60)观察组(n=60)t值P值对照组(n=60)观察组(n=60)t值P值RBC(×1012/L)3.86±0.15 3.85±0.17 0.342 0.733 4.11±0.19a 5.29±0.27a 27.685 0.000 Hb(g/L)64.59±13.75 64.51±13.69 0.032 0.975 77.28±14.37a 85.65±15.46a 3.072 0.003 Hct(%)0.15±0.05 0.16±0.04 1.210 0.229 0.22±0.08a 0.31±0.09a 5.789 0.000
2.2 两组治疗前后生化指标比较治疗后,两组Cr、BUN、β2-MGa均低于治疗前,且观察组低于对照组;两组ALB均高于治疗前,且观察组高于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组治疗前后生化指标比较(±s)Table 2 Comparison of biochemical indexes between the two groups before and after treatment(±s)

表2 两组治疗前后生化指标比较(±s)Table 2 Comparison of biochemical indexes between the two groups before and after treatment(±s)
注:Cr,清肌酐;BUN,尿素氮;β2-MG,β2微球蛋白;ALB,白蛋白。与本组治疗前比较,aP<0.05
时间治疗前治疗后组别对照组(n=60)观察组(n=60)t值P值对照组(n=60)观察组(n=60)t值P值Cr(μmol/L)861±152 859±147 0.073 0.942 804±142a 752±132a 2.078 0.040 BUN(mmol/L)28.61±7.84 28.56±7.69 0.035 0.972 22.57±6.15a 16.91±4.27a 5.856 0.000 β2-MG(mg/L)23.56±10.15 23.66±10.08 0.054 0.957 20.17±8.22a 14.34±6.84a 4.223 0.000 ALB(g/L)31.17±6.73 31.08±6.61 0.074 0.941 38.15±7.12a 45.12±7.38a 5.265 0.000
2.3 两组治疗前后微炎症指标比较治疗后,两组hs-CRP、IL-6、TNF-α均低于治疗前,且观察组低于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组治疗前后微炎症指标比较(±s)Table 3 Comparison of microinflammation indexes between the two groups before and after treatment(±s)
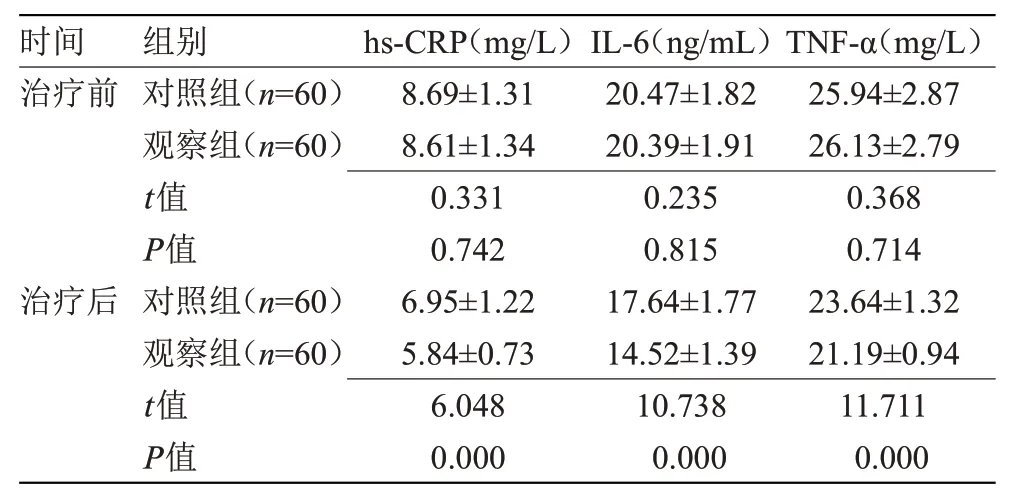
表3 两组治疗前后微炎症指标比较(±s)Table 3 Comparison of microinflammation indexes between the two groups before and after treatment(±s)
注:hs-CRP,超敏C-反应蛋白;IL-6,白细胞介素-6;TNF-α,肿瘤坏死因子。与本组治疗前比较,aP<0.05
时间治疗前治疗后组别对照组(n=60)观察组(n=60)t值P值对照组(n=60)观察组(n=60)t值P值hs-CRP(mg/L)8.69±1.31 8.61±1.34 0.331 0.742 6.95±1.22 5.84±0.73 6.048 0.000 IL-6(ng/mL)20.47±1.82 20.39±1.91 0.235 0.815 17.64±1.77 14.52±1.39 10.738 0.000 TNF-α(mg/L)25.94±2.87 26.13±2.79 0.368 0.714 23.64±1.32 21.19±0.94 11.711 0.000
2.4 两组不良反应发生率比较 治疗后,观察组不良反应总发生率为1.67%,低于对照组的13.33%,差异有统计学意义(P<0.05),见表4。

表4 两组不良反应发生率比较[n(%)]Table 4 Comparison of adverse reaction rates between the two groups[n(%)]
3 讨论
尿毒症患者多存在代谢紊乱、糖脂代谢异常、心力衰竭、免疫功能下降及运动功能受限等症状,同时,还可引起心血管系统、呼吸系统及血液系统等多种并发症,其中血液系统的主要并发症为贫血和出血倾向,而贫血的发生一方面是由于机体缺乏红细胞生成素及红细胞寿命缩短导致,其次由于患者体内存在的毒素使红细胞无法正常生成,若患者体内毒素未得到有效清除,给予患者促红细胞生成素也无法改善贫血状态;另一方面则是患者体内缺乏左卡尼汀。相关报道表明,尿毒症患者由于长期透析导致食欲不振而造成左卡尼汀摄入减少,且由于左卡尼汀无法与血浆蛋白结合,在透析过程中大量流失,最终导致血液透析患者长期处于缺乏左卡尼汀的状态[5]。
由于尿毒症患者体内有多种毒素积聚,加上透析器的刺激,导致体内单核巨噬细胞往往处于激活状态,从而释放出大量炎症因子,最终使患者机体多存在微炎症状态,临床上一般无明显症状,其实质是免疫性炎症[6]。微炎症状态主要表现为炎症因子水平升高,hs-CRP是炎症的敏感标志物,IL-6、TNF-α是细胞因子中重要的促炎性细胞因子,可激活其他炎症介质发挥作用,使肾脏疾病恶化,因尿毒症患者体内本身处于微炎症状态,加之透析过程中透析器材使用的不同反应,常会使患者机体受到刺激,导致hs-CRP、IL-6、TNF-α等炎性因子异常增加,最终加重患者病情。此外,微炎症状态还会增加心血管事件发生率,加重患者病情并引起严重并发症,增加尿毒症患者死亡率,因此,贫血及微炎症状态的防治研究对提高尿毒症透析效果和降低死亡率至关重要。
高通量透析器膜材料的透析膜孔径较低通量透析透析膜孔径大,可更有效的清除中、大分子毒素,另外,其清除方式为弥散、对流及吸附三者的结合,能有效吸附体内毒素分子,从而加强毒素分子清除效果,促进红细胞生成,降低患者机体炎性因子水平,但长期使用高通量透析亦会产生相关不良反应,如人体内微量元素、蛋白质会大量丢失,导致患者营养状态下降,且由于患者体内处于微炎症状态,则会使患者营养物质丢失越来越严重,产生营养不良的恶性循环,从而加重患者贫血状态,降低疗效,为增强治疗效果,联合左卡尼汀使用可弥补高通量血液透析引起的蛋白质流失,对改善患者贫血及微炎症状态发挥一定作用[7]。本研究结果显示,治疗后,两组RBC、Hb、Hct均高于治疗前,且观察组高于对照组(P<0.05);治疗后,两组Cr、BUN、β2-MG均低于治疗前,且观察组低于对照组,两组ALB均高于治疗前,且观察组高于对照组(P<0.05);治疗后,两组hs-CRP、IL-6、TNF-α均低于治疗前,且观察组低于对照组(P<0.05);观察组不良反应总发生率低于对照组,表明尿毒症患者采用左卡尼汀联合高通量血液透析可有效改善贫血及微炎症状态,降低不良反应发生率。分析原因为,左卡尼汀又名左旋肉碱,属于四价胺化物,可通过其抗氧化作用于患者体内肝脏、肾脏等多器官合成,达到改善红细胞脆性的作用,保护红细胞活性,促进红细胞生存,减轻患者机体炎症状态,从而改善贫血症状[8]。高通量血液透析主要通过清除体内毒素、细胞炎性因子,增加红细胞生成,从而改善患者贫血状态,其还可更好的清除体内的炎症介质,改善透析患者微炎症状态,从而降低患者死亡率[9]。高通量血液透析联合左卡尼汀可促进红细胞生成,改善体内微环境和微炎症状态及贫血症状的氧化应激状态,降低其他并发症发生率,从而有效改善患者病情,促进患者恢复[10]。
综上所述,左卡尼汀联合高通量血液透析治疗尿毒症患者效果显著,可有效改善贫血及微炎症状态,降低不良反应发生率,值得临床推广运用。
