DNA 合成技术与仪器研发进展概述
2021-10-13江湘儿
江湘儿 王 勇 沈 玥
1(深圳华大生命科学研究院 深圳 518083)
2(广东省高通量基因组测序与合成编辑应用重点实验室 深圳 518120)
3(中国科学院深圳先进技术研究院 深圳合成生物学创新研究院 深圳 518055)
1 引 言
合成生物学促进了生命科学从基于观测、描述及经验的科学跃升为可预测、可定量及可工程化的科学,并在医疗、能源、工业、农业、环境、信息等领域的应用日益广泛,潜力巨大,已成为各国科技战略布局的必争之地[1-5]。DNA 合成作为合成生物学的关键基础性技术,其重要性堪比测序技术对基因组学的支撑[6]。合成技术及核心工具合成仪的创新,将解决合成生物学发展的限速问题;合成技术及核心工具合成仪的自主,也将标志着合成生物学领域中关键“卡脖子”技术取得重要突破,并保障生命科学产业自主发展。
DNA 合成原理主要包括化学法及生物法。其中,化学法(尤其是固相亚磷酰胺三酯合成法)最为成熟且被广泛应用,而有关生物法合成技术的一系列产业布局也陆续在欧美国家出现,但总体仍处于原理验证阶段。自 20 世纪 80 年代开始,基于化学法原理的 DNA 合成仪经历了从柱式合成到高通量芯片合成的两个关键时期。本文围绕DNA 合成技术与仪器,系统阐述 DNA 合成方法及配套设备研制的进展,并结合日益增长的需求与法律法规的完善对未来发展方向进行了展望。
2 DNA 合成技术
2.1 寡核苷酸合成技术概述
寡核苷酸(Oligonucleotide)是一类多个相邻核苷酸残基以磷酸二酯键连接的短链核苷酸(包括脱氧核糖核酸(DNA)或核糖核酸(RNA)内的核苷酸)的总称,其人工化学合成过程是一个多步连续的反应,目标产物的得率受合成过程中副反应发生(如脱嘌呤等)的影响。因此,化学合成过程中一般先将不参与反应的基团暂时保护起来,经过一轮缩合反应后再将上一轮被保护基团上的保护基脱除下来,以形成目标磷酸二酯键[7]。
寡核苷酸化学合成起步于 20 世纪 40 年代末。1955 年,剑桥大学的 Todd 实验室,第一次化学法成功合成了简单二聚寡核苷酸,并获得1957 年诺贝尔奖(图 1)[8]。1965 年,Khorana 等利用化学方法大量合成脱氧核苷的单一聚合物或2 种、3 种脱氧核苷的重复序列,同时将人工合成的 64 种核糖三糖苷用于研究蛋白质的生物合成过程,从而确定了氨基酸的三联密码子,并获得 1968 年诺贝尔奖[8]。
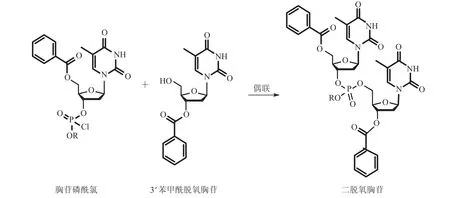
图1 首次化学合成寡核苷酸[8]Fig.1 The first attempt of oligonucleotides synthesis by chemistry[8]
随后的 60 至 70 年代,寡核苷酸的化学合成方法不断被完善,主要包括改善亚磷酰胺单体的稳定性和反应活性以提高单体偶联步效率,以及优化保护基团的反应活性和产物的稳定性以提高氧化环节的氧化效率等。逐渐形成了今天被广泛应用的固相亚磷酰胺三酯合成法,该方法于 20世纪 80 年代由 Marvin Caruthers 课题组提出[7]。然而,由于每一步化学反应的不完全性和副反应的发生,随着寡核苷酸合成链的延长,合成错误率急剧上升,合成产物得率也显著下降。此外,由于合成过程中需要大量使用有毒化学试剂,所产生的废液、废气也需要特殊处理。为此,近年来科研人员发展了很多方法来提高合成效率、降低副反应发生率。同时,尝试开发不依赖有毒化学试剂的合成方法,主要包括光化学脱保护合成法、电化学脱保护合成法、氢膦酸酯合成法、两步合成法、双碱基单体合成法等寡核苷酸化学合成技术,以及基于末端脱氧核苷酰转移酶(Terminal deoxynucleotidyl Transferase,TdT)等生物合成技术[9]。总体而言,DNA 合成技术发展历程如图 2 所示。
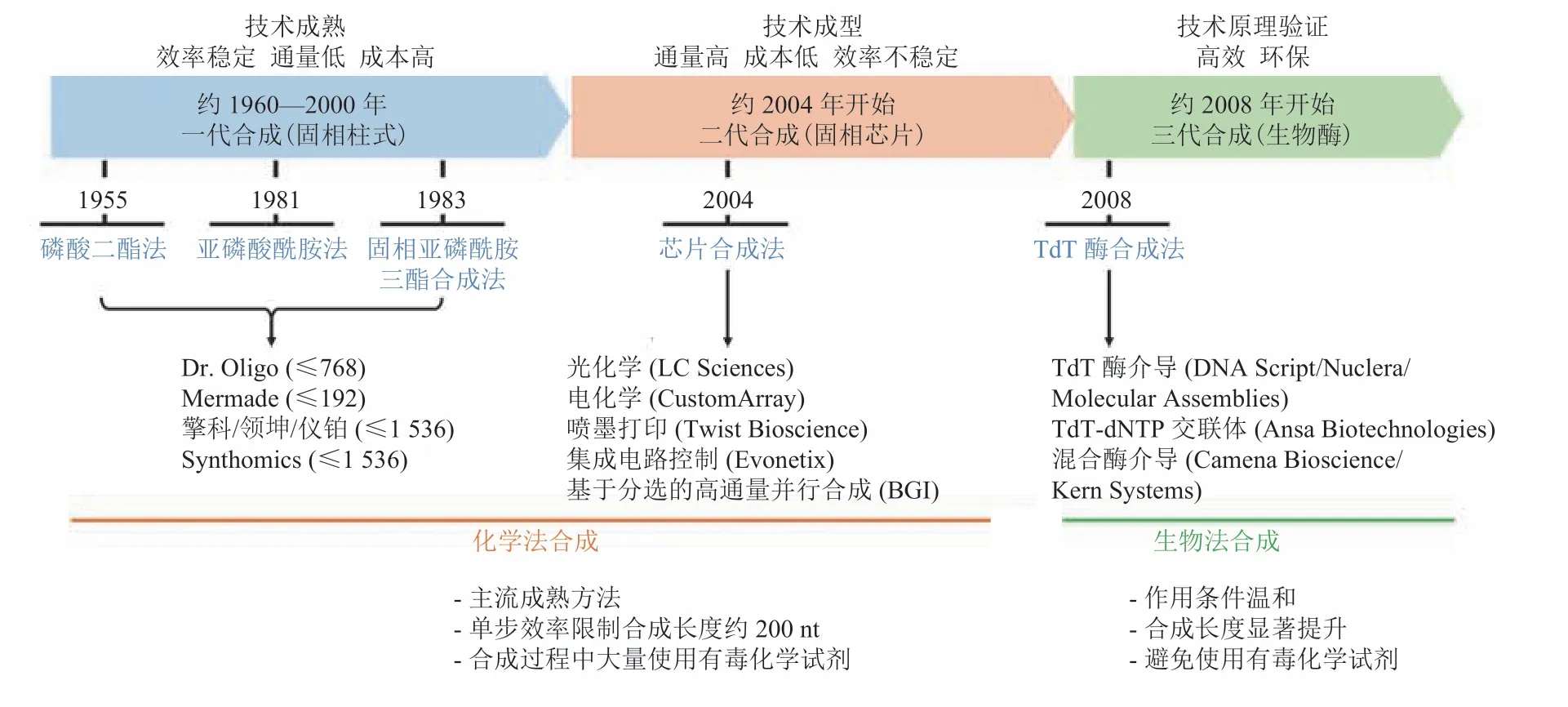
图2 DNA 合成技术发展历程Fig.2 The development of DNA synthesis technology
2.2 寡核苷酸化学法合成技术
2.2.1 亚磷酰胺三酯合成法
亚磷酰胺三酯合成法是最为广泛使用的寡核苷酸合成法,也是目前国内外主流 DNA 合成仪采用的合成方法,包括脱保护、偶联、盖帽和氧化 4 步循环(图 3)[8-9]。按照预定碱基序列,通过液路系统依次在提前做好表面修饰的固相载体上加入相应的 4 种亚磷酰胺合成单体(A、T、C、G)及其他必须的化学试剂,以完成指定寡核苷酸序列的合成。待合成后,通过氨气或利用其他碱性条件,将产物从固相载体上切除并收集,即可获得目标碱基序列的寡核苷酸。但由于每一步化学反应的不完全性和副反应的发生(如脱保护过程中的脱腺苷等),寡核苷酸合成链越长,合成效率越低,合成错误率也越高,这极大地限制了寡核苷酸合成的长度及合成质量。
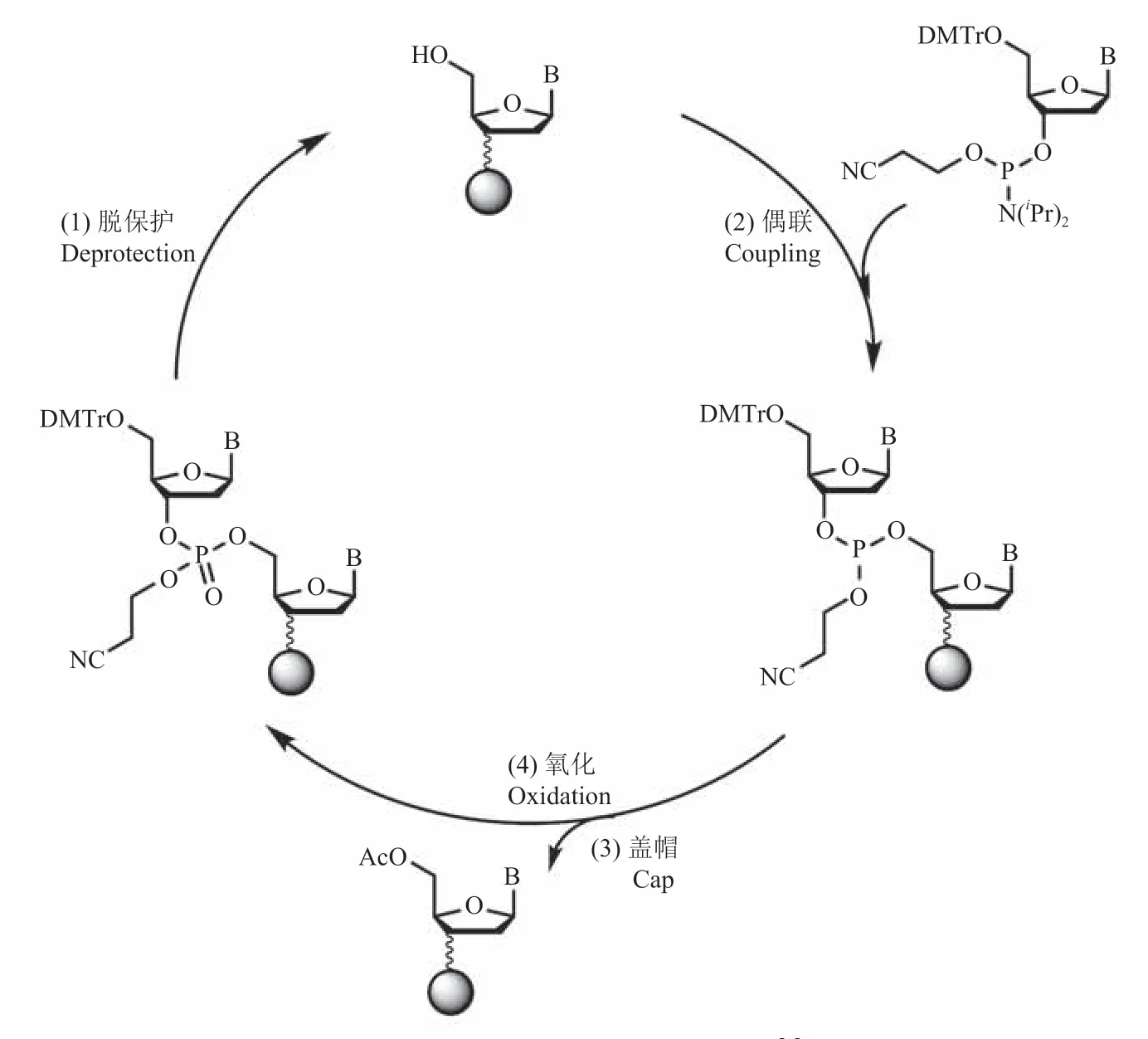
图3 亚磷酰胺三酯合成法原理[9]Fig.3 The mechanism of phosphoramide chemistry[9]
2.2.2 光化学脱保护合成法
按合成原理,光化学脱保护合成法可细分为光制酸脱保护合成法和光敏单体介导光控脱保护合成法(图 4)[10-16]。光制酸脱保护技术原理为,光制酸前体通过光照产生酸,从而进行 5′-二甲氧基三苯甲基(N,N-Dimethyltryptamine,DMT)保护基团的脱保护。该技术遵循成熟的化学合成工艺,可以确保高效的偶联效率和高保真的合成质量。同时,该方法非常灵活,任意修饰的单体分子都可以用来合成一系列修饰寡核苷酸。但光制酸效率较低,需要复杂的光控条件,且仪器设计及操作也相对比较繁琐。光敏单体介导光控脱保护合成法需要特定光敏保护基团的合成单体,与传统合成单体相比,同样需要特殊避光保存,但反应效率显著降低,合成过程中容易产生更多随机合成突变,导致合成序列保真度较低,因此限制了该方法的应用。
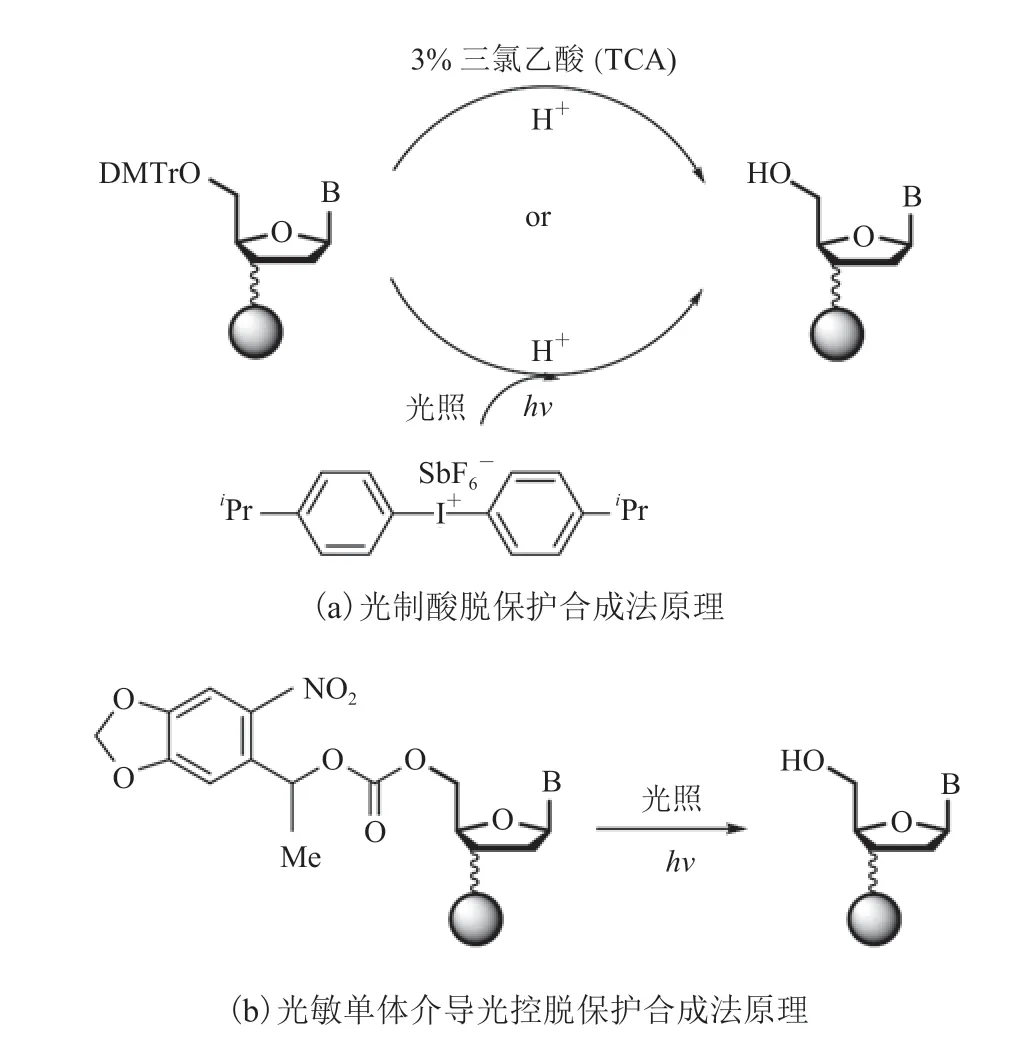
图4 光化学脱保护合成法原理[10]Fig.4 The mechanism of DNA synthesis by photochemical deprotection[10]
2.2.3 电化学脱保护合成法
与经典亚磷酰胺 4 步法直接加入有机酸或利用光制酸脱保护技术光照原位生产酸相比,电化学合成法中脱保护过程所需酸的来源不同。该方法利用通电条件下,在电极阳极表面原位产生质子酸,来脱除 DMT 保护基团,随后进行常规的偶联、盖帽和氧化步骤,并进行下一个循环。尽管该合成方法脱保护体系中加入了 2,6-二甲基吡啶作为有机碱,用来中和扩散出来的酸以避免相邻电极上的 DMT 基团脱保护,但在高密度阵列反应点中,当相邻距离过近时,则无法有效控制扩散(图 5)[17-21]。此外,该方式产生酸的效率较低,需要较长时间通电,且电化学过程对反应环境较为敏感,致使合成稳定性较低、合成错误率偏高。
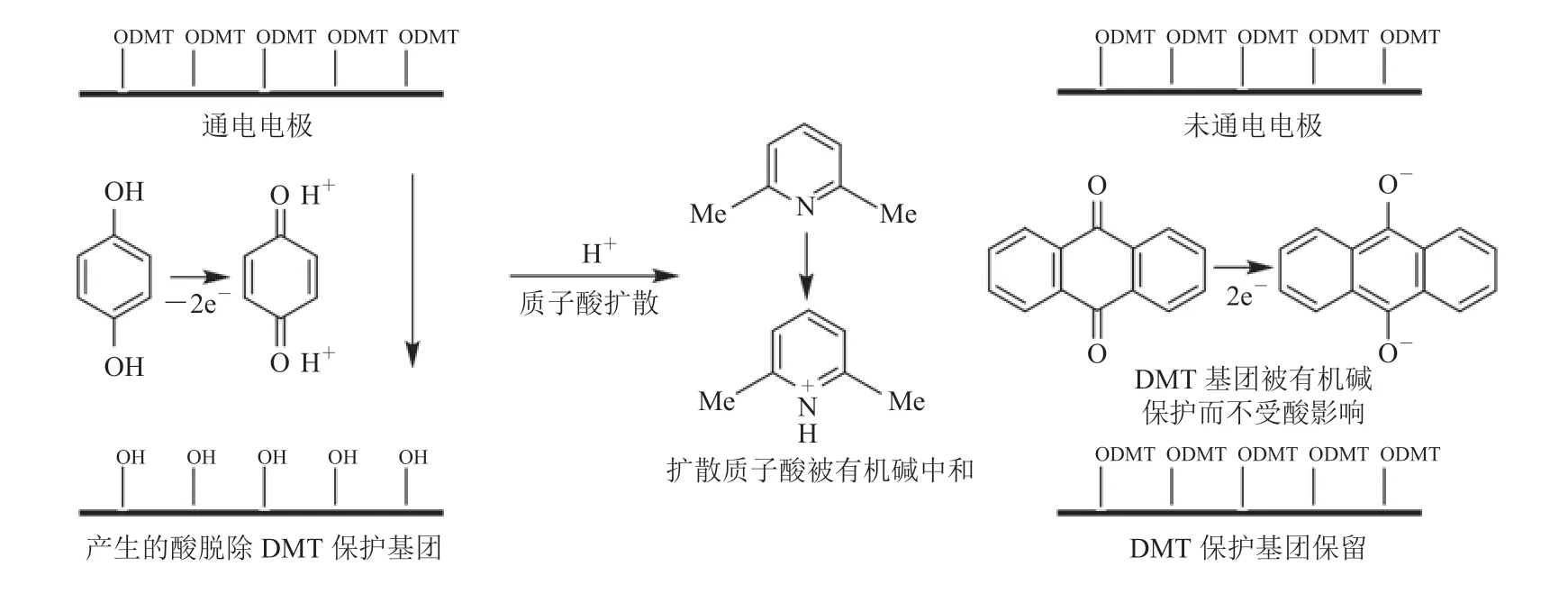
图5 电化学脱保护合成法原理[21]Fig.5 The mechanism of DNA synthesis by electrochemical deprotection[21]
2.2.4 氢膦酸酯合成法
经典亚磷酰胺 4 步法中,采用三价磷的亚磷酰胺为合成单体,该三价磷分子结构易被氧化或与水反应而变质。为了保证高效的偶联效率以及高保真的合成质量,整个偶联反应过程需要严格的无水无氧环境,这不可避免地增加了寡核苷酸合成过程控制的难度,继而影响合成的成本。而氢膦酸酯合成法是将传统的三价亚磷酰胺单体发展为五价磷单体,该单体在空气环境下相对稳定,理论上可以降低经典亚磷酰胺四步法对水氧环境的要求(图 6)[22-23]。然而,由于该方法的偶联反应活性比三价亚磷酰胺的低,导致合成效率也较低,因此限制了该方法的进一步应用。
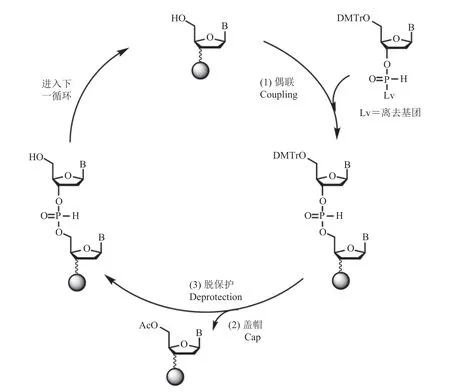
图6 氢膦酸酯合成法原理[22-23]Fig.6 The mechanism of DNA synthesis by H-phosphonate chemistry[22-23]
2.2.5 两步合成法
两步合成法的关键是用芳氧基羰基(Aryloxycarbonyl)取代 5′-DMT 封闭基团,并且利用 N-二甲氧基三苯甲基保护腺嘌呤和胞嘧啶的环外氨基。通过这些修饰,每个 2′-脱氧核苷-3′-亚磷酰胺与固相载体上延伸的寡聚脱氧核苷酸偶联之后,可用过氧阴离子缓冲溶液(pH<10)处理。该过氧阴离子溶液不仅具有较强的亲核性,还具有温和的氧化性。其中,该试剂的强亲核性能不可逆地除去 5′-氧-碳酸酯保护基团,且其温和的氧化电位能定量地氧化核苷酸之间的亚磷酸三酯,而不会氧化杂环碱基,一并完成氧化和脱保护两个步骤。与此同时,在合成较短寡核苷酸链过程中,可以省略盖帽步骤,从而实现两步法合成(图 7)[24]。但该方法所涉及的缓冲体系稳定性较差,需要现配现用,且省略盖帽步骤会产生很多偶联不完全的副产物,难以应用于长链寡核苷酸的合成。
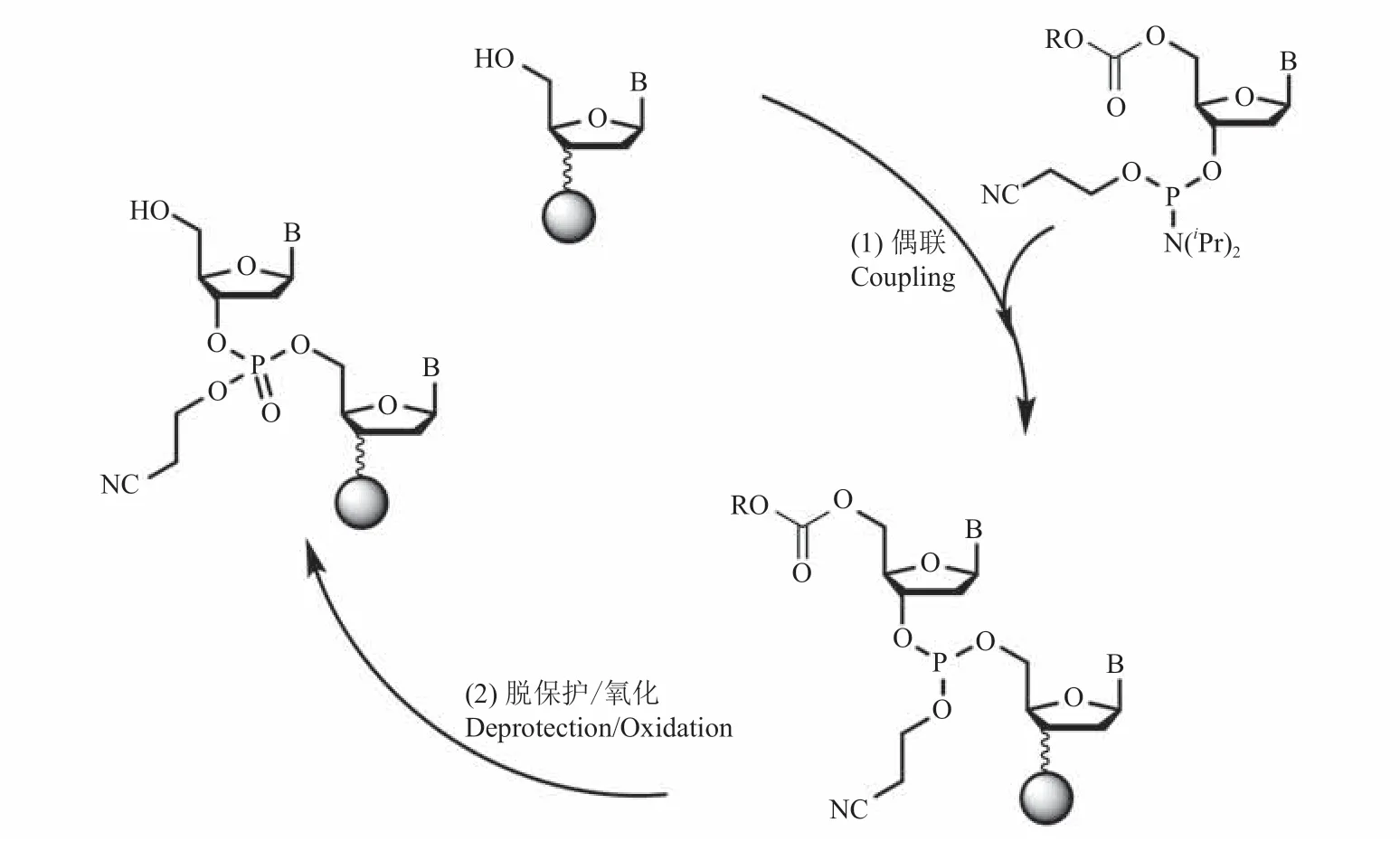
图7 两步合成法原理[24]Fig.7 The mechanism of DNA synthesis by two-step cycle chemistry[24]
2.2.6 双碱基单体合成法
与经典的亚磷酰胺三酯合成法相比,光化学脱保护合成法、电化学脱保护合成法、氢膦酸酯合成法和两步合成法等新发展的生化体系,普遍存在合成效率不高及稳定性较差等问题,较难实现长链寡核苷酸的高质量合成,而双碱基单体合成法则有望解决这些问题。其原理是基于较成熟的亚磷酰胺 4 步循环法,采用双碱基亚磷酰胺单体作为基本反应单元进行合成反应(图 8)[25]。合成同样长度的寡核苷酸序列,双碱基单体合成法所需反应循环数较亚磷酰胺 4 步循环法减半,因此双碱基反应效率大幅提升,且反应错误率也会相应地降低。而在同样的反应循环数下,采用双碱基合成法能快速高效地得到长链寡核苷酸目标序列。其中,在>200 nt 长链寡核苷酸高效合成时,双碱基合成法更具优势。然而,当前该方法的单体成本较高,且双碱基单体溶解度较差而易结晶堵塞试剂管道,所需配套的仪器液路系统复杂度高,因此暂未形成基于该方法的设备与应用。随着双碱基单体大规模制备工艺的逐步完善,及硬件系统设计与搭建能力的不断提升,有望研制出基于该方法的合成仪,从而在合成成本、合成错误率及合成长度等方面实现技术突破。
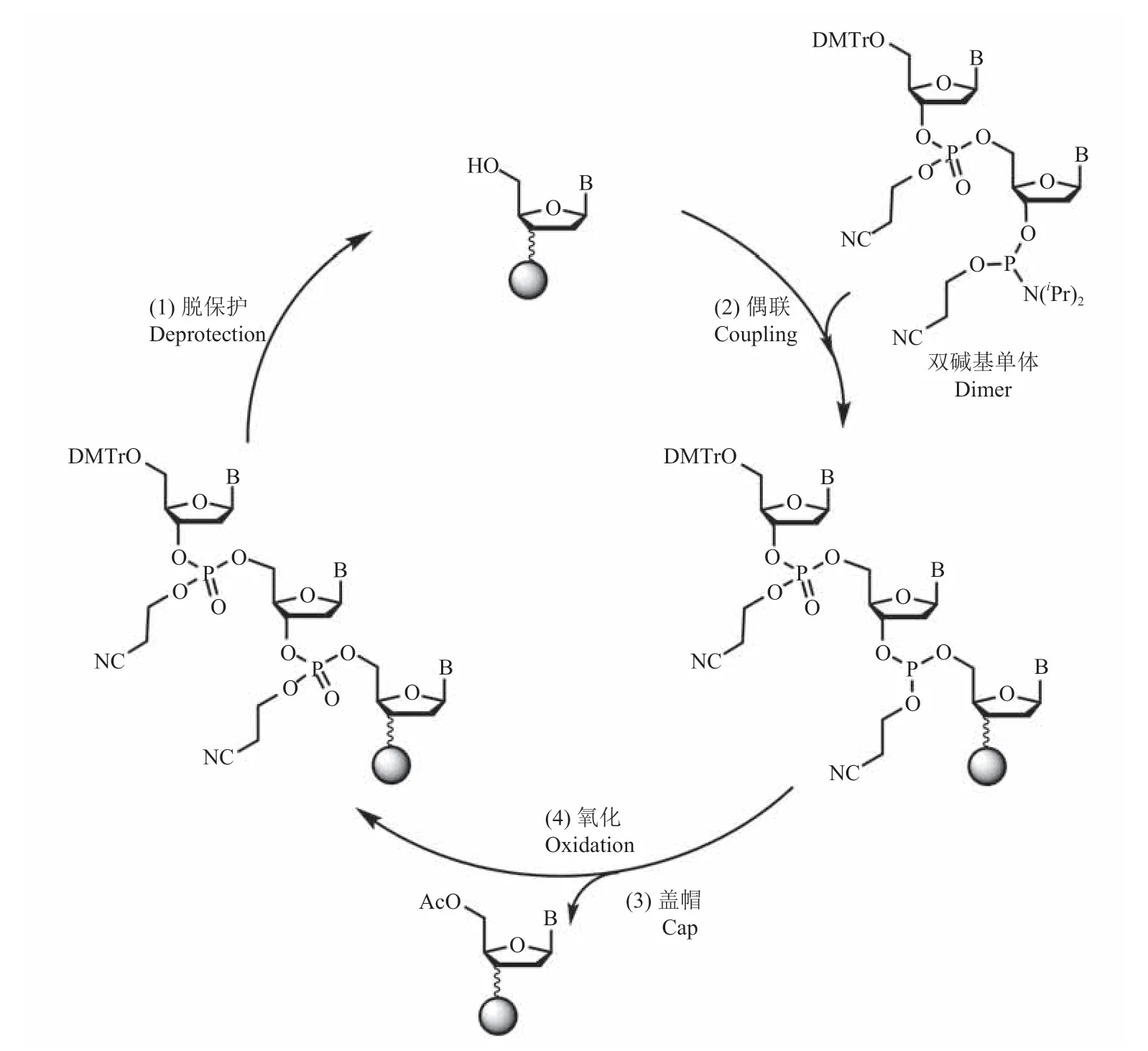
图8 双碱基单体合成法原理[25]Fig.8 The mechanism of DNA synthesis by dimer phosphoramide chemistry[25]
2.3 寡核苷酸生物法合成技术
如上所述,传统亚磷酰胺化学合成法受化学反应效率限制,DNA 合成产物长度仅能达到约 200~250 nt[26],极大地限制了下游应用。合成过程中涉及强酸、强氧化剂,产生较多对环境有害的化学废液,导致后续处理费用高昂。而生物酶法 DNA 合成技术通常在水相环境下进行,可有效避免上述问题,并有望以更低的成本合成更长的 DNA 分子[27-31]。2020 年 10 月,Nature Biotechnology《自然生物技术》杂志在题为“Enzymatic DNA synthesis enters new phase”的新闻报道中提到,一些新创公司把酶法合成作为更快且更高效合成长链 DNA 分子的新技术手段,同时极大地降低了合成和 DNA 链的组装成本[32]。
DNA 分子的体内合成主要是由各种 DNA 聚合酶催化并依赖于 DNA 模板进行合成。DNA 末端转移酶和部分种类的 DNA 聚合酶却可以不依赖于已有的 DNA 模板分子,直接催化 DNA 链的合成[33-34]。发展基于生物酶的 DNA 合成新技术,并结合同源重组等体内组装方法,可以使寡核苷酸合成长度和准确度提升数个量级,这将极大地提高利用合成生物学设计与构建的能力。同时,这一技术也将促进如 DNA 数据存储和新材料的设计制造等新兴领域的重大突破。与 DNA 化学法合成相比,生物酶法合成潜力巨大,有望在合成长度和产量方面实现显著提升,并大幅降低成本[35]。
2.3.1 TdT 酶介导的酶促合成反应
TdT 酶介导的酶促合成反应是目前酶法合成DNA 的研究热点。TdT 是一种非模板依赖性酶,通常以随机方式延伸 DNA 链,可将 4 种天然碱基加到 DNA 链的 3′端[33-34,36]。如何控制反应的启动与终止,实现某一特定序列的片段合成,是利用该酶促反应实现从头合成 DNA 的关键问题。此外,酶促反应的催化效率、酶对修饰单体的特异性以及单体的特异性添加问题,亦是难点。
从 2013 年开始,3 家以 TdT 酶为基础的DNA 合成公司:Molecular Assemblies、DNA Script 和 Nuclera 相继成立。该方法本质上都是通过修饰核苷酸分子,化学合成带有可逆终止基团的核苷酸单体,然后利用 TdT 酶将碱基不断地添加到所合成序列的末端。其原理是通过化学反应控制核苷酸分子上的化学修饰基团,使该酶每次只能延伸目标单碱基,随后除去终止基团并开始下一个目标碱基的合成,最终实现控制 DNA链中目标碱基的有序连接(图 9)[29-30,37-40]。鉴于TdT 酶对其所修饰的基团要求极高,该方法前期投入较大,需耗费大量的人力和物力进行蛋白质改造研究及化学修饰基团筛选。
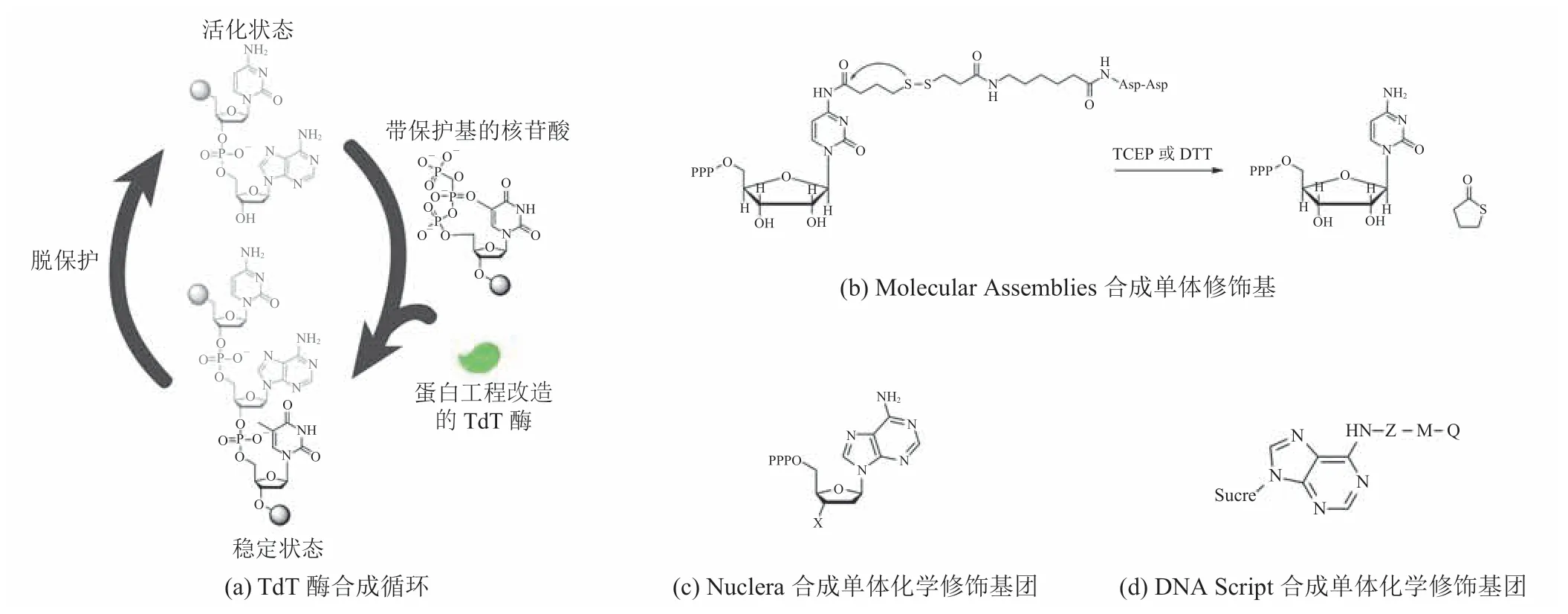
图9 TdT 酶介导的酶促合成反应[29-30,37-40]Fig.9 Enzymatic DNA Synthesis by TdT[29-30,37-40]
2.3.2 TdT-dNTP 交联体介导的酶促合成反应
由 Dan Arlow 和 Sebastian Palluk 等人于 2018年共同成立的 Ansa Biotechnologies 公司(https://ansabio.com/),针对 TdT 酶难以接受修饰核酸的问题,提出 TdT-dNTP 交联体介导的可逆终止合成法。TdT 酶与单独 3′端带可逆接头的脱氧核苷三磷酸(dNTP)结合,当新合成链的 3′端暴露出来时,该 TdT 酶与核苷酸的偶联物就能连接上去,新目标碱基也随之被引入。同时,TdT酶继续停留在 3′端上阻止其他偶联物继续添加(图 10)[34,41-42]。与 TdT 酶介导的生物酶法合成相比,该策略由于要先将 TdT 酶与核苷酸偶联,导致 TdT 酶消耗量更大。
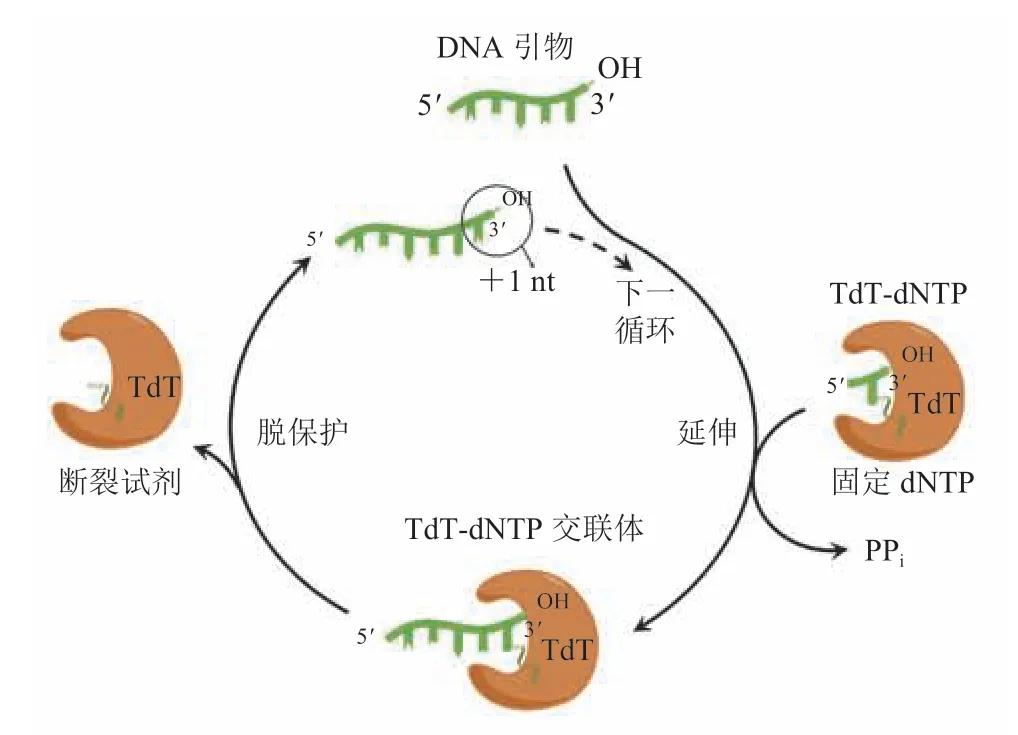
图10 TdT-dNTP 交联体介导的酶促合成反应原理[34]Fig.10 TdT-dNTP conjugates for reversible termination of primer elongation[34]
2.3.3 混合酶介导的酶促反应
成立于 2016 年的英国 Camena Bioscience 公司利用特定组合的酶在三核苷酸异构体中实现无模板的 DNA 合成。它们的从头酶法合成和基因组装技术叫 gSynthTM,每条引物的 3′端都由可逆终止核苷酸(rtNTP)组成,包含特定组合的酶或有末端转移酶活性的核糖酶,通过不断的重复延伸,合成 300 nt 长度的引物(图 11)[43-44]。与同为 300 nt 长度碱基的合成片段相比,因其减少了连接步骤,故准确率较化学法合成有明显提升。该公司于 2020 年初,利用自己特有技术与平台从头合成了 2.7 kb 长度的质粒(pUC19),亦证明该方法具有实际应用价值,未来可应用于蛋白改造及微生物菌株构建等领域。
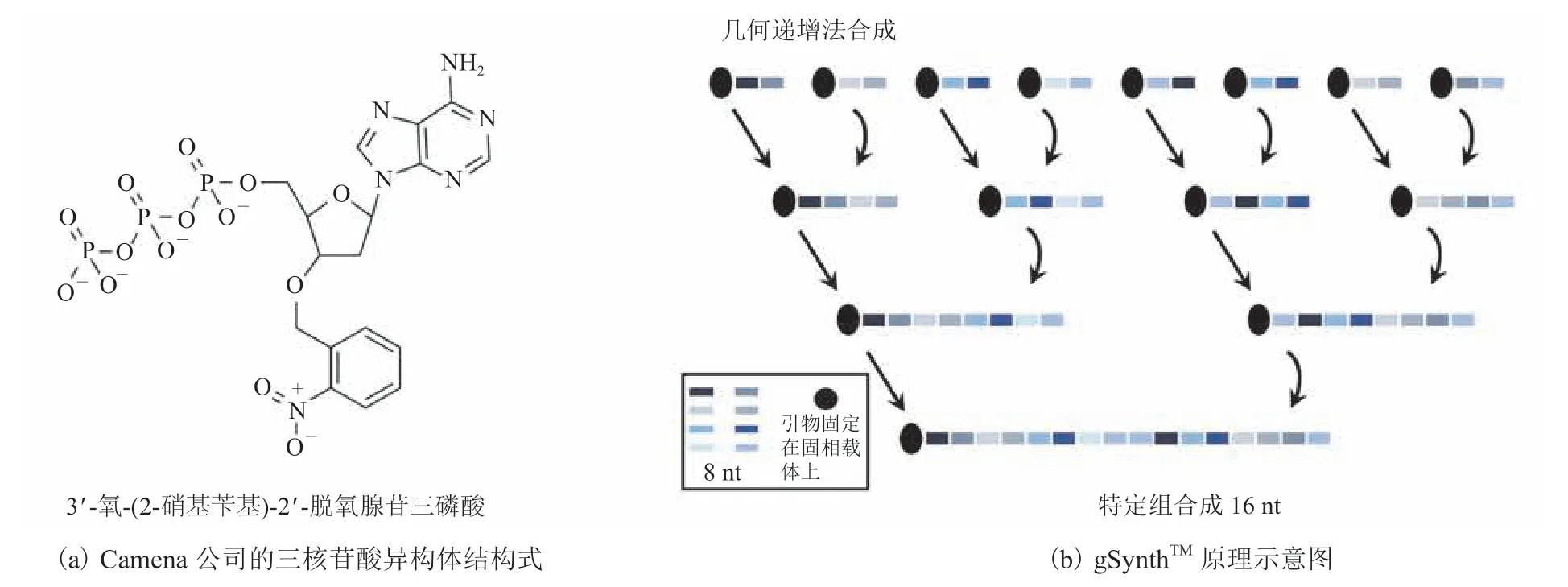
图11 混合酶介导的酶促反应[43-44]Fig.11 Multiplexed enzymatic DNA synthesisTM[43-44]
此外,Kern Systems 公司从 DNA 存储的应用需求出发,采用一种免修饰的策略合成DNA。该方法利用两种酶之间的竞争,首先 TdT酶将核苷酸整合到 DNA 链末端,此时体系内存在另一种酶——三磷酸腺苷双磷酸酶作为核酸降解酶,可以使体系中核苷酸浓度降低,最终导致无法进行新一轮的合成[45]。该方法因不能严格控制碱基的添加与终止,可能会导致合成错误率较高。但通过加入特定冗余及纠错机制等方式可以实现应用该技术进行 DNA 存储[46]。
迄今为止,以上提及的 6 家酶法合成公司先后已获得超过 1.5 亿美元的融资,但整体仍处于概念验证阶段,尚未达到大规模商业应用水平(表 1)。我国亦有如中国科学院天津工业生物技术研究所及湖南大学等科研院校的研发团队在生物法合成方向有所布局。

表1 主流生物酶法合成公司概览Table 1 Enzymatic DNA synthesis companies
3 DNA 仪器研发
3.1 仪器发展概述
DNA 合成仪是 DNA 合成的核心装备。自20 世纪 90 年代起,以美英为首的西方发达国家在经典化学合成法原理基础上开始了 DNA 合成仪的研发与商业化,经历了从第一代柱式合成仪到第二代高通量芯片合成仪两个关键时期。目前,第一代柱式合成仪有多款机型在市场上流通,其中接受度较高的代表是 Bioautomation-Mermade 和 Biolyitc-Dr.Oligo 系列合成仪。第二代高通量芯片合成仪于 2000 年面世,根据其技术原理的不同,大致分为 5 类,包括美国 LC Sciences 公司为代表的光脱保护 μParaflo 合成仪、美国 CustomArray 公司为代表的电化学合成技术合成仪(于 2017 年被金斯瑞生物收购)、美国 Agilent Technologies 及 Twist Bioscience 公司为代表的喷墨打印合成仪、英国 Evonetix 公司为代表的集成电路控制合成仪(仅发布技术,未见商业机器发布)及中国华大基因为代表的基于芯片分选原理的高通量合成仪等[9,47-50]。其中,国外以美国 Twist Bioscience 公司的高通量喷墨合成仪的综合性能较为突出。尽管基于生物酶法合成技术(如 TdT 酶合成法)陆续在欧美国家出现一系列产业布局,但总体仍处于原理验证阶段,而国内对该领域的布局较晚,尚未出现商业化设备(图 12)。

图12 DNA 合成仪汇总Fig.12 The summary of DNA synthesizers
3.2 基于化学合成法的合成仪
3.2.1 一代柱式合成仪
柱式合成仪的合成载体为管道合成柱,其内部填充的可控多孔玻璃为真正的反应介质。柱式合成仪通过电脑程序控制与可控多孔玻璃反应试剂的加入,最终合成单链 DNA。目前国际上具有柱式 DNA 合成仪自主研发和生产能力的研究机构及企业主要集中在发达国家和地区,包括美国的 GE、ABI、贝克曼库尔特、Biolytic、Bioautomation、Synthomics 等公司,德国的 K&A Laborgeraete、PolyGen 等公司,韩国的 Bioneer 公司,丹麦的 TAG Copenhagen A/S,日本的瑞翁医疗株式会社等①:美国 GE (https://www.gehealthcare.cn/),美国 ABI (https://www.thermofisher.cn/cn/zh/home/brands/applied-biosystems.html),贝克曼库尔特(https://www.beckmancoulter.cn/),Biolytic (https://www.biolytic.com/),Bioautomation (https://bioautomation.com/),Synthomics (https://tracxn.com/d/companies/synthomics.com),K &A Laborgeraete (https://www.dna-synthesizer.de/company/),PolyGen(http://www.polygen.de/index.html),TAG Copenhagen A/S (http://tagc.dk/),瑞翁医疗株式会社 (https://www.zeonmedical.co.jp/c/)。随着寡核苷酸合成需求的不断提升,国内也涌现出多家开发一代柱式合成仪的公司,如北京擎科生物科技有限公司、上海仪铂生物科技有限公司、江苏领坤生物科技有限公司、北京鼎国昌盛生物技术有限责任公司等。
当前,柱式合成仪单批次合成通量最高可达 1 536 条寡核苷酸,最大合成长度一般在150~200 nt,超过该长度以后,每步副反应和合成效率会显著影响寡核苷酸的序列准确性与产率。产量一般在 0.5~1 000 nmol 水平,合成错误率约为 1/1 000 nt,成本为 0.05~0.5 元/nt。尽管1 536 通量的一代柱式合成仪的较早期低通量型号设备在合成时间和效率已有较大提高,但仍无法从根本上大幅降低单碱基合成成本,继而无法满足捕获探针、大规模基因合成及 DNA 存储等通量较高的应用需求。因此,通过技术创新以提升通量、降低合成成本成为当下亟待解决的难题。
3.2.2 二代高通量芯片合成仪
芯片合成仪是以芯片为合成载体,其单张芯片可实现成千上万条长度不等的单链 DNA 合成。该类型设备可在提供高通量合成的同时,降低试剂的消耗,初步实现低成本高通量的寡核苷酸合成。其中,国外技术与市场布局发展较早,前期技术积累超过 10 年。相比一代技术,二代技术通量高、成本低,但目前市场上尚无商业化仪器,仅提供技术服务。根据合成原理,高通量合成仪主要包括 5 类(表 2)。

表2 二代高通量芯片合成仪代表性公司概览Table 2 The high throughput chip-based DNA synthesizers and corresponding companies
3.2.2.1 光化学原理
LC Sciences 公司基于光脱保护原理的高通量DNA 合成仪,采用数字化光源投影技术,将电脑可控的高分辨率多点平行光投影到反应位点,通过光照来控制各反应位点进行脱保护反应,以控制每个位点进行合成反应。相较于一代合成仪,该装置利用微流控技术,实现合成过程中所需单体等试剂的可控输送,使试剂消耗量少、单碱基合成成本低。但目前单循环得率约为 98.5%,不适合较长寡核苷酸的合成,且微流控芯片加工制作复杂,合成通量较难大幅提升,需要从脱保护效率及光控系统的精确度上进行优化改进[10-16]。
3.2.2.2 电化学原理
CustomArray 公司基于电化学原理的高通量DNA 合成仪是目前唯一被商业化的高通量芯片DNA 合成仪。通过电化学脱保护将合成反应缩小到微米级别的反应孔内,从而实现一张芯片上集成上万个反应点。该原理的优点是试剂(碱基单体等)消耗量少,单碱基合成成本极低;通量高(12 000~90 000),一次可合成高达上万种单链 DNA。缺点是单位点的产量低、合成效率不稳定及错误率高[17-21]。未来,可在芯片设计与加工工艺方面进行设计与优化,最大程度避免氢离子串扰的问题,以进一步提高合成质量。
3.2.2.3 喷墨打印原理
Agilent 公司最早实现利用喷墨打印原理进行 DNA 合成,随后,Twist 公司进一步改进合成芯片的设计,并开发了高通量 DNA 合成仪。该技术利用高速的微量喷墨打印作为单体等试剂的输送方式,在特殊处理的微米级硅基通孔上合成寡核苷酸,可实现上百万条寡核苷酸的高通量合成,再利用匹配的反应器与这些微孔对接,进行原位的 DNA 拼接和组装,从而直接得到大量长片段的 DNA 分子[51-52]。该合成仪集成了微流控技术、半导体加工技术和分子组装技术等一系列前沿技术。由于合成通量依赖芯片反应位点数量,如需进一步提高芯片反应位点密度,则要提供更为复杂的半导体精加工技术以及可实现针对高密度反应位点的超高打印精度喷头,因此较难进一步降低成本。此外,其微量生化反应体系中 DNA 合成产物的载量仅能达到 fmol 水平,需要通过扩增的方式提升载量,但难以达到pmol~nmol 的水平。
3.2.2.4 集成电路控制原理
Evonetix 公司基于集成电路控制原理的高通量 DNA 合成仪,通过在具有特殊设计的大规模可寻址的合成位点的封闭腔室内,加入低熔点的可反复加热的阻断材料,利用电路信号控制位点的通电与否对其进行加热。在加热情况下,特殊材料可吸附在相应位点上,并阻止后续通入的试剂在其上反应,如需在该位点进行后续合成,可用溶剂将该材料清洗掉,使该位点暴露出来以进行合成反应[53]。Evonetix 公司合成仪的核心技术是在接近十亿个位点的寡核苷酸合成和可实时监测的高保真 DNA 纠错组装技术(暂无相关公开信息),但该技术还处于研发阶段,实际应用效果还有待验证。
3.2.2.5 基于分选的高通量并行合成原理
华大基因自主研制的基于分选的高通量并行合成原理的 DNA 合成仪,按照预合成序列信息将带有特殊标记的芯片合成载体,快速移动并依次排列,集合到相应的反应腔室中进行碱基合成延伸,反应结束后回收芯片进入下一个合成循环,直至序列合成完毕。该技术原理的优势包括:(1)芯片加工工艺简单,无需复杂的微阵列芯片加工工艺,且可重复使用,对成本控制有利;(2)合成通量拓展灵活性大,合成通量取决于合成载体和反应腔室大小,通量提升不依赖于复杂加工工艺;(3)带有特殊标记的芯片合成载体可单独分离,从而实现合成产物回收的可控。目前,华大基因自主知识产权高通量合成仪技术与仪器设计均已申请多项自主核心专利,并完成了原型机及多款升级机型的搭建和测试。目前最高通量达 10 万级,在错误率(约 1‰~3‰)及合成载量(>pmol 级别)方面具有突出优势,有望快速实现合成成本的指数级下降。由于芯片在连续分选和物理转移过程中会导致表面磨损,进而影响芯片的可识别性,因此未来需要从芯片选材及结构加工上进一步提升其物理兼容性。
3.3 基于生物酶法合成的合成仪
DNA Script 公司基于生物酶技术,于 2020年推出了世界上首台桌面型 DNA 酶促打印机。据其官网(https://dnascript.com/products/)介绍,单孔产量可达 200 pmol,单步反应效率高达99.5%,合成过程中无需有机试剂,比现有化学法 DNA 合成仪器更环保,可大大提升 DNA合成的普及性。2021 年 2 月,DNA Script 获得Baseclick 公司授权售卖含该公司试剂的试剂盒,从而使用户可通过点击化学(Click Chemistry)进行修饰引物的合成,借此加快分子诊断研发进程。此外,Molecular Assembly、Ansa Biotechnologies 等公司也在积极研究新的酶法合成技术,期望打破现有化学法合成的技术壁垒,以生产出长序列、高质量、特定序列的DNA,但均暂未见配套仪器。
4 总结与展望
从 20 世纪 80 年代开始,DNA 合成经历了从第一代柱式合成到第二代高通量芯片合成两个关键时期。第一代柱式合成仪自 20 世纪 90 年代起开始商业化,而我国在合成仪器研发上起步相对较晚,当前国内各大 DNA 合成服务商的核心零部件或仪器大部分依赖于进口。随着 DNA 合成市场需求的迅速增长,自 2000 年起,欧美国家便开始部署高通量芯片合成仪研发。然而,高通量芯片合成技术发展至今,仍普遍存在以下局限性:(1)受生化效率影响,合成长度难以提升,且错误率较高;(2)合成产物处于混合状态,无法高效分离单种寡核苷酸,且质量均一性不稳定;(3)不适用于高通量基因组装(原位组装及自动化拼接);(4)合成产物的载量基本在 0.1~100 fmol水平,难以显著提升。这些问题极大地限制了基于高通量芯片技术的下游应用发展。为解决以上技术瓶颈,华大基因自主研制了基于芯片分选原理的高通量合成仪,综合了一代柱式的高质量合成和二代芯片的高通量合成优势,能更好地兼容下游各种需求,标志着我国在全自主知识产权DNA 合成技术领域实现重大突破。
随着生命科学、合成生物学以及生物与信息技术交叉融合新兴领域(如 DNA 存储)的快速发展,对 DNA 合成的需求量与性能提出了更高的要求,全球寡核苷酸合成市场预计将由 2021 年的 69 亿美元,增长到 2026 年的 141 亿美元,年复合增长率达 17.6%[27]。然而,现有的 DNA 合成技术和合成仪性能,仍难以从通量、质量、成本及载量等方面满足日益增长的 DNA 合成需求。此外,随着全球生态和环境问题的日益严重,基于化学法的 DNA 合成技术将面临较大的挑战,而生物酶法合成潜力巨大,有望成为未来 DNA 合成技术的重要发展方向。近年来,欧美国家陆续出现如 Molecular Assemblies、DNA Script 等代表性的初创公司,尽管大都处于概念验证阶段,尚未形成大规模的商业应用,但相较我国,已储备一定的先发优势。从科研产业需求以及战略布局的双重考量出发,我国都应加大投入,快速推进。
此外,合成生物学的迅猛发展也对国家安全监管体系带来严峻的挑战。2021 年 4 月 15 日,《中华人民共和国生物安全法》正式施行,该法梳理了包括生物技术发展在内的当前我国生物安全领域存在的主要风险及防控制度。只有真正掌握以 DNA 合成为基础的合成生物学创新技术体系,早日突破欧美国家“卡脖子”的技术封锁,引领全球该领域第一梯队,为我国生命科学的自主发展打下坚实基础,方能在未来可能发生的生物战争中最大程度地保障国家安全。
