Bkt 基因和 crtR-B 基因在集胞藻 PCC 6803 中的重组表达及功能分析
2021-10-13刘亚铭崔玉琳
刘亚铭 王 康 崔玉琳 陈 高 秦 松*
1(中国科学院烟台海岸带研究所 海岸带生物学与生物资源利用重点实验室 烟台 264003)
2(中国科学院大学 北京 101418)
3(中国科学院海洋大科学研究中心 青岛 266071)
4(山东省农业科学院农作物种质资源研究所 济南 250100)
5(山东省作物遗传改良与生态生理重点实验室 济南 250100)
1 引 言
类胡萝卜素(Carotenoids)是一类广泛存在于高等植物、真核微藻和蓝藻光合膜的烯萜类化合物[1],通常是由 8 个类异戊二烯单位组成的碳氢化合物及其氧化衍生物[2-3]。在光合生物中,其作为捕光色素成分参与光合作用,并可以通过清除自由基和抗氧化来实现自我保护[4-5]。研究表明,类胡萝卜素在人体健康方面也发挥着重要作用。其中,一些类胡萝卜素可作为人体内维生素 A 的重要来源;而大部分的类胡萝卜素有很强的抗氧化活性[6],能够增强人和动物的免疫力[2,7-8],具有多种重要的保健功能和较大的医用价值。例如,角黄质具有抗氧化、抗癌、提高免疫力,以及保护皮肤和骨骼健康等作用[4];金盏花黄质作为虾青素合成的中间产物,可以通过激活抗氧化防御对出血性脑损伤发挥保护作用,具有防止脑内出血的潜力[9]。
蓝藻,又称蓝细菌,是一类能够进行光合作用的原核生物[10]。集胞藻 PCC 6803 是研究代谢调控的模式蓝藻,也是利用合成生物学手段构建细胞工厂的优良底盘[11-12]。其既能自养,又能异养,并且遗传背景清晰,是最早完成全基因组测序的藻类,具有天然的遗传转化系统[13]。集胞藻 PCC 6803 中含有的内源性 β-胡萝卜素单酮醇酶能催化β-胡萝卜素转化为海胆酮,但不能将海胆酮进一步转化;而内源性 β-胡萝卜素羟化酶(β-Carotene Hydroxylase,CRTR-B)[14-15]也只能催化 β-胡萝卜素转化为玉米黄素。然而,在雨生红球藻中,β-胡萝卜素酮化酶(β-Carotene Ketolase,BKT)[14]不仅可以催化 β-胡萝卜素转化为海胆酮,并进一步转化为角黄质,还可以催化金盏花黄质转化为虾青素;β-胡萝卜素羟化酶则可以催化 β-胡萝卜素转化为玉米黄素,并催化角黄质转化为虾青素。
为进一步阐明bkt基因和crtR-B基因的功能及其作用机制,本文克隆了来自雨生红球藻的 β-胡萝卜素酮化酶基因(bkt)和 β-胡萝卜素羟化酶基因(crtR-B),并在集胞藻 PCC 6803 中表达,实现对集胞藻中类胡萝卜素代谢途径的修饰。本文研究结果为进一步阐明bkt基因和crtR-B基因的功能及其作用机制奠定了分子基础,也为研究其他微型藻类中的类胡萝卜素代谢途径提供参考。
2 材料与方法
2.1 集胞藻 PCC 6803 的培养
集胞藻 PCC 6803 购自中国科学院淡水藻种库,编号 FACHB-898。使用 BG11 培养基培养集胞藻 PCC 6803,培养温度为(30±2)℃,光照强度为 50 μmol photon/(m2·s-1),光/暗周期为 12 h/12 h。
2.2 同源重组载体的构建
首先,使用植物基因组 DNA 提取试剂盒(大连宝生物,中国)提取集胞藻 PCC 6803 的基因组DNA;然后,利用大肠杆菌 DH-5α(Invitrogen,中国)进行 DNA 克隆和质粒构建,并在 37 ℃、160 r/min 摇床中培养;最后,使用细菌质粒DNA 快速提取试剂盒(上海生工,中国)提取重组质粒。根据集胞藻 PCC 6803 密码子偏好性对来自雨生红球藻的bkt基因(GenBank:AY603347.1)和crtR-B基因(GenBank:AF162276.1)进行密码子优化,优化后的bkt基因和crtR-B基因由 GenScript 公司合成。p5S1285UD-bkt质粒和pSKT1T2-crtR-B质粒图谱见图 1。从美国国立生物技术信息中心网站(https://www.ncbi.nlm.nih.gov/)获取已知的基因序列,用 Primer 5.0 软件设计引物,本研究中所用引物见表 1(均由北京睿博兴科生物技术有限公司合成)。

表1 本研究所用引物序列Table 1 Primer sequences used in this study
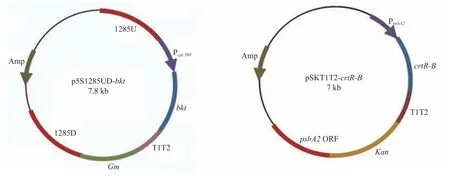
图1 p5S1285UD-bkt 和 pSKT1T2-crtR-B 质粒图谱Fig.1 Plasmid maps of p5S1285UD-bkt and pSKT1T2-crtR-B
2.3 集胞藻 PCC 6803 的转化和突变株的筛选
离心收集处于对数生长期的集胞藻 PCC 6803 藻株,其在 730 nm 处的光密度(Optical Density,OD)值约为 0.6,使用新鲜的 BG11 培养基调整细胞浓度至OD730=2.5,备用。将上述得到的质粒通过自然转化法[16]转化至处理好的藻细胞中。在含有 5 μg/mL 庆大霉素和 25 μg/mL卡那霉素的 BG11 固体培养基上,对转化后的集胞藻 PCC 6803 分别进行筛选。同时,将转化初始质粒 p5S1285UD[17]和 pSKT1T2[16]的突变株设为对照组。
2.4 突变株的验证
对于突变株的 DNA 水平验证,提取集胞藻PCC 6803 野生型和突变株基因组 DNA,通过聚合酶链式反应(Polymerase Chain Reaction,PCR)验证目的基因的转入情况,引物见表 1。
具体地,先使用植物 RNA 提取试剂盒(Omega,中国)提取集胞藻 PCC 6803 野生型和突变株的总 RNA;然后,通过 cDNA 合成试剂盒(大连宝生物,中国)将 mRNA 反转录为cDNA;最后,以 cDNA 作为模板,分别用引物bkt-RT-F/bkt-RT-R 和crtR-B2-F/crtR-B2-R 检验bkt基因和crtR-B基因 RNA 水平的表达。
2.5 生长曲线的测定
取处于对数生长期的集胞藻,调节初始接种浓度OD730值为 0.5,每 24 h 取样 1 次,用普析Tu-1810 紫外分光光度计测定OD730值,绘制生长曲线。其中,实验组和对照组各设置 3 个平行。
2.6 色素分析
本文使用的类胡萝卜素标准品购自 Sigma(中国)。参照 Baroli 等[18]的方法,用丙酮提取色素,并通过 Thermo Fisher UltiMate-3000 液相色谱仪(配置 UV-可见检测器)对色素进行分离和鉴定。其中,色谱柱使用 C18 反相柱,Acclaim 120A(5 μm×4.6 mm×250 mm)。流动相比例参数、流速以及梯度洗脱时间均参照文献[18]的方法设定。
2.7 统计分析
所有实验重复 3 次,数据表示为 3 次实验的平均值±标准偏差。使用 SPSS 软件进行信度检测。当P<0.05 时,认为在统计学上具有显著性差异。
3 结果与分析
3.1 突变株的构建和鉴定
本实验构建的表达载体 p5 S1285 UDbkt和 pSKT1T2-crtR-B如图 1 所示。其中,p5S1285UD-bkt质粒中含有 1 000 bp 上游同源臂(1285U,GenBank:NC_017277.1)和 1 000 bp下游同源臂(1285D),并使用从 pFastBacI 质粒(Invitrogen)克隆庆大霉素抗性基因作为选择标记基因。在 pSKT1T2-crtR-B质粒中,PpsbA2启动子和由引物 PpsbA2-F/PpsbA2-R 扩增的psbA2开放阅读框作为上下游同源臂。另外,在 pSKT1T2-crtR-B质粒中以卡那霉素抗性基因作为选择标记基因。经过转化和抗生素筛选后,采用 PCR验证目的基因的转入情况,分别检测野生型和突变株基因组 DNA 中外源序列是否进行同源重组。当使用引物 1285U-F/1285D-R 对整个同源交换片段进行检验时,在bkt-Gm突变株中扩增出预期的 4.9 kb 条带,而在对照组中仅扩增出2.0 kb 条带(图 2(a)),表明bkt-Gm突变株中包含Gm基因和bkt基因的外源基因表达盒已经整合到基因组 DNA 中。同样,如图 2(b),当用引物 PpsbA2-F/PpsbA2-R 对整个同源交换片段进行检验时,在crtR-B-Kan突变株中扩增出预期的 4.1 kb条带,而在对照组中仅扩增出 1.5 kb 条带,这表明crtR-B-Kan突变株的基因组 DNA 中已经整合了包含crtR-B基因和Kan基因的外源基因表达盒。同时,测序结果也表明,crtR-B基因和bkt基因已经整合到集胞藻 PCC 6803 基因组DNA 中。
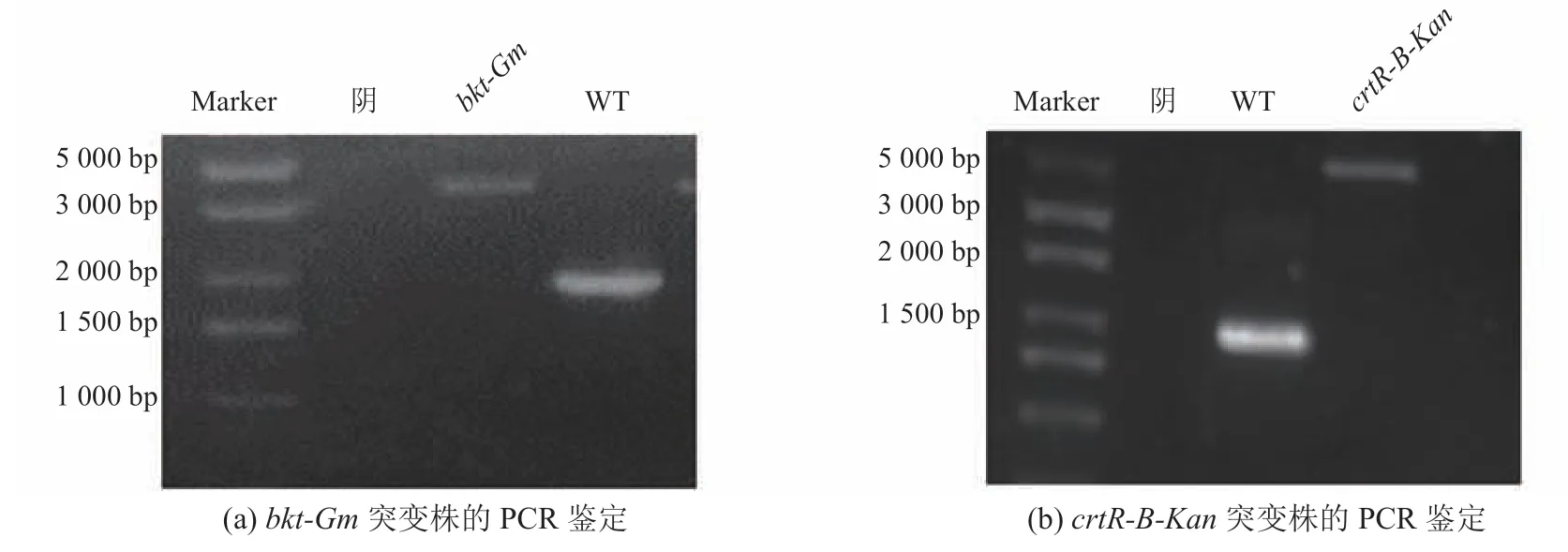
图2 DNA 水平鉴定Fig.2 The identification of mutant in DNA level
为了进一步验证bkt基因和crtR-B基因转录水平的表达,从野生型和突变株中提取总 RNA。如图 3 所示,在bkt-Gm突变株和crtR-B-Kan突变株中分别扩增出代表bkt基因和crtR-B基因的大约 410 bp 和 258 bp 的条带,而在对照组中没有观察到条带,说明整合到基因组中的bkt基因和crtR-B基因被转录。这表明,bkt基因和crtR-B基因完全转入集胞藻 PCC 6803,且具有表达活性,bkt-Gm突变株和crtR-B-Kan突变株已构建成功。
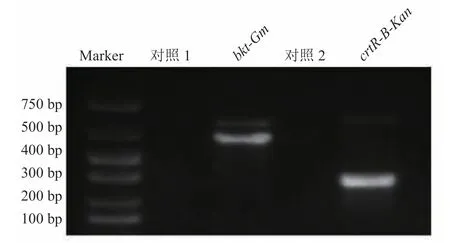
图3 RNA 水平鉴定Fig.3 The identification of mutant in RNA level
3.2 正常培养条件下藻株的生长情况
为了检测转入bkt基因和crtR-B基因是否对藻株的生长产生影响,本文检测了野生型与突变株在正常培养条件下的生长情况。图 4 结果显示,野生型和突变株的生长速率相似,表明转入bkt基因和crtR-B基因对集胞藻的生长基本没有影响。
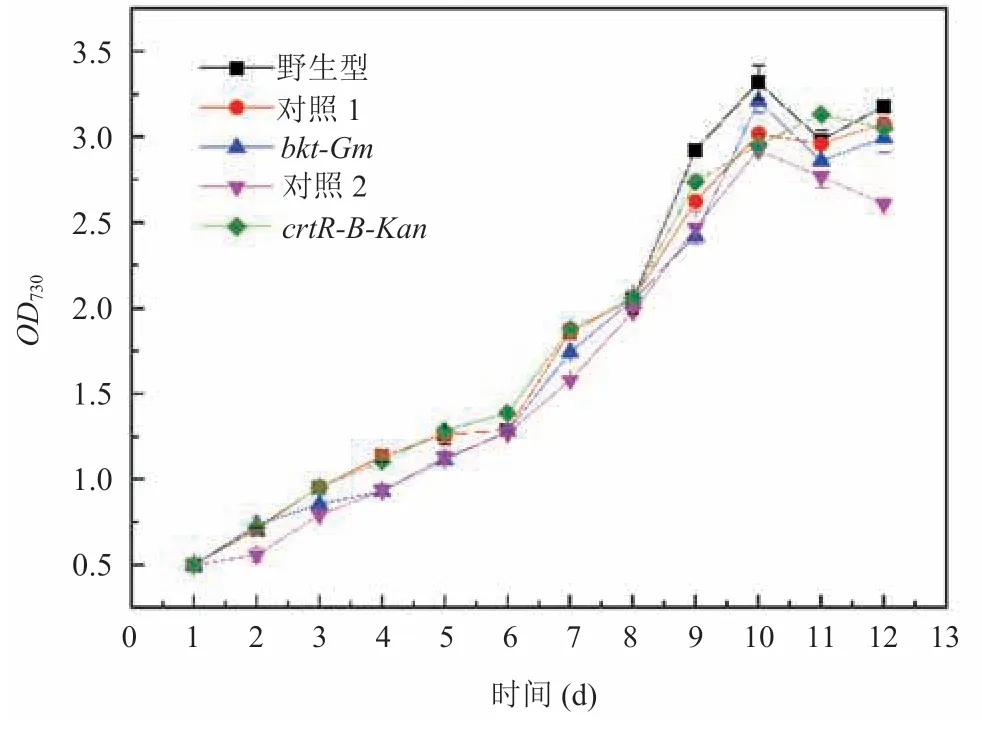
图4 正常培养条件下野生型、bkt-Gm 突变株和crtR-B-Kan 突变株的生长曲线Fig.4 The growth curve of wild strain,bkt-Gm mutants and crtR-B-Kan mutants under normal condition
3.3 野生型和突变株的色素差异
高效液相色谱(High Performance Liquid Chromatography,HPLC)检测结果(图 5)显示,bkt-Gm突变株产生了角黄质,其含量为(1.38±0.07)mg/g,且海胆酮含量下降为(7.72±0.29)mg/g、β-胡萝卜素含量下降为(13.12±0.49)mg/g(表 2);而crtR-B-Kan突变株中检测出金盏花黄质,其含量为(0.98±0.04)mg/g,且玉米黄素含量下降为(4.18±0.09)mg/g、β-胡萝卜素含量下降为(12.80±0.14)mg/g(表 2)。
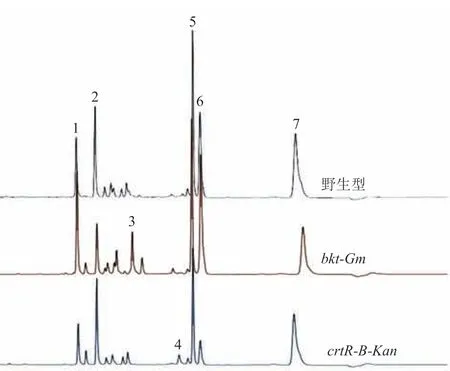
图5 HPLC 检测来自集胞藻 PCC 6803 野生型、bkt-Gm 突变株和 crtR-B-Kan 突变株的类胡萝卜素Fig.5 HPLC analysis of pigment production from the Synechocystis sp.PCC 6803 wild type,bkt-Gm mutants and crtR-B-Kan mutants
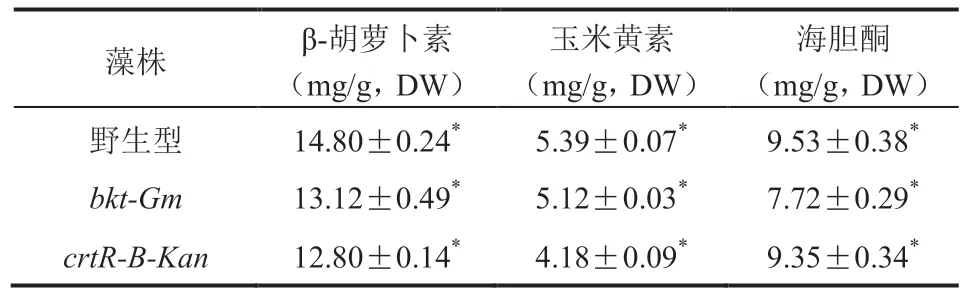
表2 色素含量Table 2 The content of pigment
4 讨论
集胞藻 PCC 6803 中含有一种 β-胡萝卜素单酮醇酶基因(GenBank:NC_000911),其编码的酶能从氧气(O2)中转移氧原子来氧化 C4 位的 β-胡萝卜素[19],β-胡萝卜素单酮醇酶通常能将 β-胡萝卜素转化为海胆酮[20]。β-胡萝卜素酮化酶(BKT)被认为是一种与 β-胡萝卜素单酮醇酶具有相同功能的酶,参与 β-胡萝卜素合成虾青素。虽然二者都是 β-胡萝卜素酮化酶,但在催化机理上不同[21]。其中,BKT 是在 β-胡萝卜素的 2 个 β-紫罗兰酮环中各插入 1 个酮基[22],而 β-胡萝卜素单酮醇酶是在 β-胡萝卜素的 2 个 β-紫罗兰酮环之一插入 1 个酮基以合成海胆酮[21,23]。本文研究结果表明,来自雨生红球藻的 BKT 可以在集胞藻中利用海胆酮进一步合成角黄质。
集胞藻 PCC 6803 中含有 β-胡萝卜素羟化酶基因(crtR,GenBank:NP_440788.1),负责将 1个羟基引入 β-胡萝卜素的 β-紫罗兰酮环[24]中。CRTR 能够催化 β-胡萝卜素形成玉米黄素,并在集胞藻 PCC 6803 中合成蓝藻叶黄素。β-胡萝卜素羟化酶(CRTR-B)是一种来自雨生红球藻的虾青素合成途径中的关键酶,可将 2 个羟基引入 β-胡萝卜素中[14]。在虾青素合成途径中,CRTR-B负责将 β-胡萝卜素转化为 β-隐黄质,并进一步转化为玉米黄素,最终将角黄素转化为虾青素。尽管 CRTR-B 和 CRTR 都被称为 β-胡萝卜素羟化酶,但来自陆生植物和绿藻的 β-胡萝卜素羟化酶由crtR-B基因编码[25-26],而蓝藻 β-胡萝卜素羟化酶由crtR基因编码,且系统发育上与crtR-B无关[27]。本文研究结果显示,来自雨生红球藻的CRTR-B 可以在集胞藻中利用玉米黄素进一步合成金盏花黄质。
类胡萝卜素已被广泛认为是安全的天然抗氧化剂和抗癌剂。而不同的微藻产生不同结构的类胡萝卜素是由具有特定催化功能的类胡萝卜素合成酶决定。深入了解微藻中类胡萝卜素的生物合成机制既有利于促进其在食品和制药行业的生产和应用,也为下一步在集胞藻中合成虾青素,构建性能优良的藻株奠定基础。
5 结论
通过在集胞藻 PCC 6803 中分别转入来自雨生红球藻的bkt基因和crtR-B基因,采用 HPLC检测色素组成发现,外源基因的表达对集胞藻PCC 6803 类胡萝卜素的合成产生了影响。转入bkt基因的细胞产生角黄质的同时海胆酮含量下降,表明是外源的 β-胡萝卜素酮化酶将海胆酮转化为角黄质;转入crtR-B基因的细胞产生金盏花黄质的同时玉米黄素含量下降,表明是外源的 β-胡萝卜素羟化酶将玉米黄素转化为金盏花黄质。本文结果表明,分别来自雨生红球藻和集胞藻 PCC 6803 的不同 β-胡萝卜素酮化酶和 β-胡萝卜素羟化酶具有不同的功能,仅依靠来自集胞藻PCC 6803 的 β-胡萝卜素酮化酶和 β-胡萝卜素羟化酶无法合成虾青素。本实验初步揭示了集胞藻PCC 6803 中类胡萝卜素代谢机制,为通过基因工程手段在集胞藻 PCC 6803 细胞内积累虾青素奠定了基础。
