基于血常规及CA125指标的卵巢肿瘤患者恶性风险预测模型构建
2021-10-13沈群弟
俞 霄 沈群弟
绍兴市第七人民医院检验科,312000 浙江 绍兴
卵巢癌是女性癌症死亡的主要原因之一。卵巢癌的早期诊断有一定局限,患者确诊时大多数已处于晚期,多数患者在2年内复发,而5年生存率低于50%[1]。 CA125是卵巢癌应用较为广泛的肿瘤标志物,但早期卵巢癌中CA125水平可能不会升高,某些良性卵巢肿瘤CA125水平可有升高,因此CA125作为判断卵巢肿瘤良恶性的指标存在一定局限[2]。近来有研究发现外周血中性粒细胞/淋巴细胞比率(neutro phil to lymphocyte ratio, NLR)及血小板/淋巴细胞比率(platelet to lymphocyte ratio, PLR)升高与癌症的预后等密切相关[3-4],并有研究表明NLR 及PLR 可作为卵巢肿瘤血清生物学指标,有效辨别卵巢肿瘤良恶性[5]。然而目前能直接简单结合上述指标对卵巢肿瘤恶性风险进行预测的研究尚不多。因此,本研究通过回顾性分析某医院妇产科卵巢肿瘤手术患者的相关临床资料,分析相关指标因素,构建预测卵巢肿瘤恶性风险的列线图预测模型,为卵巢肿瘤患者的病情诊断、治疗及预后提供依据。
1 资料与方法
1.1 资料来源
回顾性分析2015年1 月至2019年1月期间某院妇产科行卵巢肿瘤手术患者的临床资料。纳入标准:(1)年满18周岁;(2)术前1 周内血常规、CA125数据完整;(3)术后病理诊断明确良恶性。排除标准:(1)术前合并急性感染性疾病、自身免疫性疾病、血液系统疾病等;(2)1个月内有输血史;(3)术前使用抗生素;(4)临床资料不完整。
1.2 研究方法
收集患者入院时的一般临床资料,包括年龄、血常规、CA125等指标,以及术后病理结果等。血常规及CA125测定均为术前1周内抽取外周静脉血5 mL检查。NLR及PLR值通过计算血常规中性粒细胞与淋巴细胞比值、血小板与淋巴细胞比值获得。
1.3 统计学方法
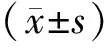
2 结果
2.1 一般资料
收集卵巢肿瘤手术患者的临床资料,共有92例符合纳入标准,平均年龄(50.76±18.01)岁。依据术后病理,分为卵巢癌组56例,良性卵巢肿瘤组36例。两组患者的年龄、白细胞计数(white blood cell,WBC)、血红蛋白(hemoglobin,Hb)、血小板计数(platelet,PLT)差异无统计学意义(P>0.05);卵巢癌组CA125、NLR及PLR高于良性卵巢肿瘤组(P<0.05)。见表1。
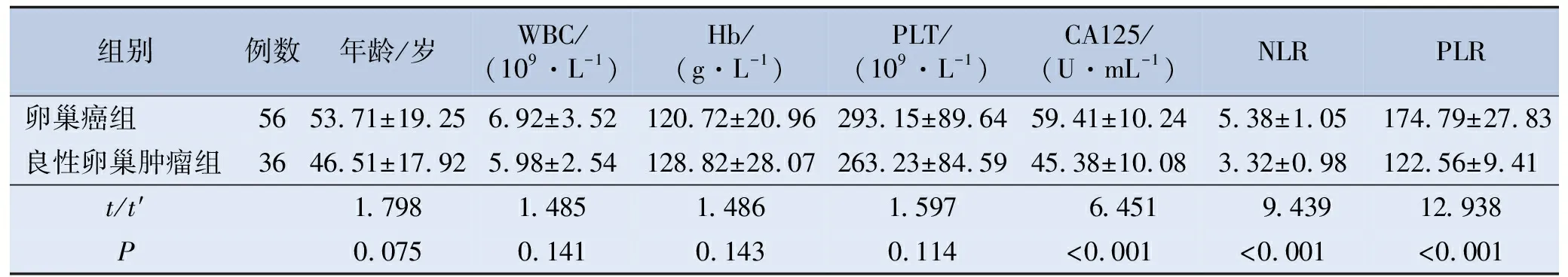
表1 两组患者的一般资料比较
2.2 卵巢肿瘤恶性风险的二元logistic回归分析
将2组比较有统计学差异的指标(CA125、NLR及PLR)纳入多因素分析。以是否为卵巢癌为因变量(卵巢癌= 1,良性卵巢肿瘤= 0),以上述所选出的指标为自变量,进行二元logistic回归分析。结果表明,NLR、PLR为卵巢癌的危险因素(OR>1,P<0.05)。见表2。
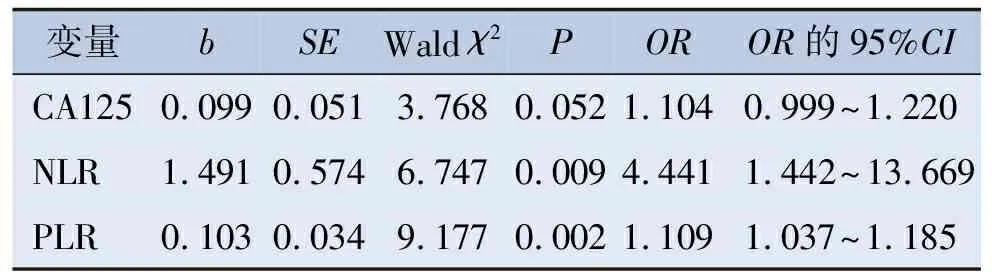
表2 卵巢肿瘤恶性风险的多因素logistic回归分析
2.3 卵巢肿瘤恶性风险列线图的建立
将CA125、NLR及PLR定为预测因素,是否卵巢癌为临床结局,建立卵巢肿瘤恶性风险列线图。见图1。每个变量对应上方评分标尺的得分(points),总分(total point)范围为0~180分,总分对应在卵巢癌风险轴上的数值即为卵巢肿瘤恶性风险,总分越高,卵巢肿瘤恶性的风险越高。

图1 卵巢肿瘤恶性风险列线图
2.4 卵巢肿瘤恶性风险的ROC曲线
根据卵巢肿瘤恶性风险分别与CA125、NLR、PLR及联合预测的比较,绘制ROC 曲线,计算曲线下面积(area under curve,AUC),AUC的取值范围在0.5和1之间,AUC越接近1.0,表明诊断准确性越高。CA125、NLR、PLR及联合预测卵巢肿瘤恶性风险对应的AUC分别为0.813、0.924、0.954及0.983(P<0.05),联合预测模型 AUC为0.983,故认为该模型准确性尚可。见图2。CA125最佳截断值为53.6,灵敏度为0.661,特异度为0.861。NLR最佳截断值为4.34,灵敏度为0.857,特异度为0.889。PLR最佳截断值为139,灵敏度为0.875,特异度为0.972。联合预测最有诊断价值,联合预测因子的计算公式为CA125+(1.491/0.099)×NLR+(0.103/0.099)×PLR,联合预测最佳截断值为260.5,灵敏度为0.964,特异度为1。

图2 CA125、NLR、PLR以及联合预测卵巢肿瘤恶性风险的ROC曲线
2.5 卵巢肿瘤恶性风险列线图的评价
对卵巢肿瘤恶性风险列线图进行一致性评价,calibration曲线中x轴代表卵巢肿瘤恶性风险(predicted probability),y轴代表实际发生的卵巢癌(actual diagnosed),对角虚线表示理想预测模型(ideal),实线表示实际的预测能力(bias-corrected),越接近对角线表示与理想模型越一致,预测能力越好。列线图预测模型实际的预测能力曲线在对角虚线下方,对卵巢肿瘤恶性风险有一定的高估偏差。 calibration曲线显示如果模型的预测值越大,卵巢肿瘤恶性风险发生概率越大,并且高估的偏差越小。见图3。
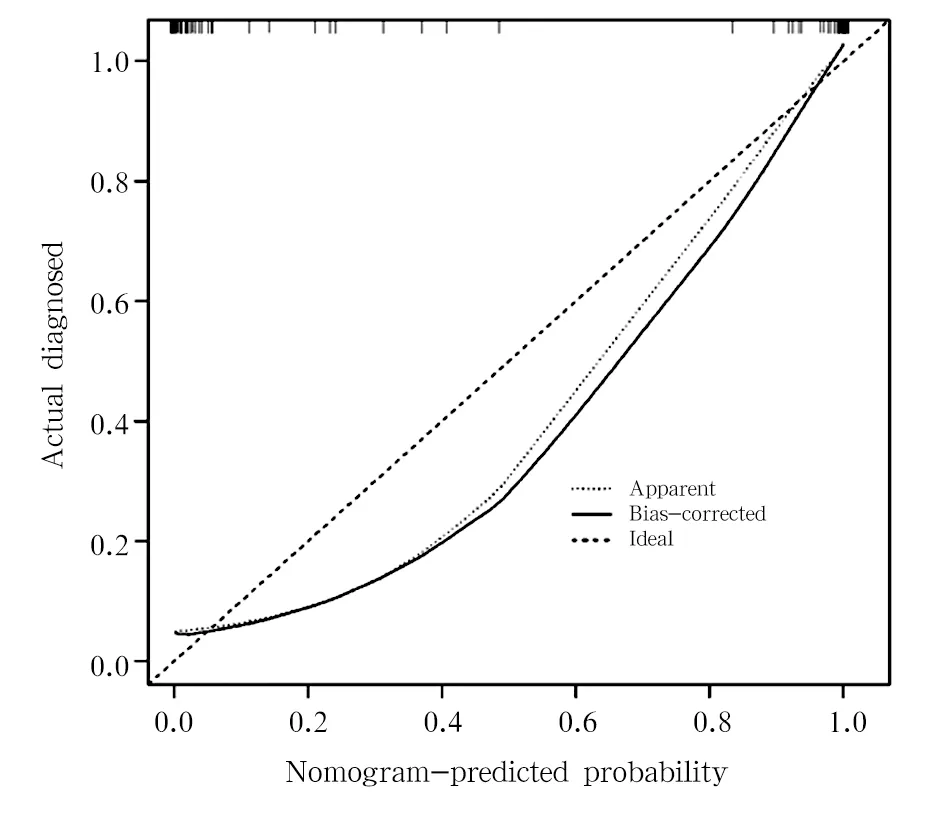
图3 卵巢肿瘤恶性风险列线图的一致性评价
3 讨论
目前卵巢癌的主要辅助检查方法包括血清CA125以及影像学检查。目前有关卵巢癌相关血清标志物的研究发展迅速,但这些新型卵巢癌血清标志物的研究并不成熟,难以作为常规临床检验项目进行临床应用[6-8]。因此,简单、快速、有效地寻找预测卵巢肿瘤患者卵巢癌风险的影响因素,给予早期风险评估是临床的关注重点。
本研究对比卵巢癌组与良性卵巢肿瘤组,卵巢癌组CA125、NLR及PLR高于良性卵巢肿瘤组。将相关指标纳入多因素分析,logistic回归分析表明,NLR及PLR为卵巢癌的独立危险因素。炎症反应在卵巢癌的发生发展中作用明显,C-反应蛋白与卵巢癌预后不良有关,NLR是可以作为卵巢癌患者预后指标,同时NLR 作为预测肿瘤良恶性的指标也越来越受到关注[9-10]。本研究中,卵巢癌组NLR高于良性卵巢肿瘤组,与既往研究相符。有研究显示血小板可以促进卵巢癌细胞的生长,外周血中血小板计数升高与晚期卵巢癌密切相关,PLR与卵巢癌预后相关,可以作为卵巢癌诊断的筛选工具[11-12]。本研究亦发现,与良性卵巢肿瘤组相比,卵巢癌组PLR高于良性卵巢肿瘤组。
列线图预测模型依据筛选出的相关指标,各指标占有不同分值,最后得出所有指标的总分,获得风险预测值,直观地评估指标诊断的准确度,目前得到广泛应用[13-16]。本研究回顾性分析利用基层医院数据建立了卵巢肿瘤患者卵巢癌风险列线图预测模型,CA125、NLR、PLR预测卵巢肿瘤恶性风险对应的AUC分别为0.832、0.924、0.954,模型联合预测风险AUC为0.983,利用模型结合3项指标,预测准确更高。calibration曲线对列线图一致性进行评价,列线图预测模型实际的预测能力曲线在对角虚线下方,对卵巢肿瘤恶性风险有一定的高估偏差;但calibration曲线显示如果模型的预测值越大,卵巢肿瘤恶性风险发生概率越大,并且高估的偏差越小。这表明了模型一致性尚可,特别是对高风险的卵巢肿瘤患者意义尤为明显,高估的偏差可能与样本量偏少、纳入的影响因素不多有关。本模型主要指标仅涉及简单的血常规及CA125指标,基层医院已经基本普及推广,对卵巢肿瘤患者卵巢癌风险快速有效评判、诊断有一定的价值。
综上所述,NLR升高及PLR升高是卵巢肿瘤患者恶性风险的独立危险因素,基于CA125、NLR及PLR指标建立的卵巢肿瘤患者恶性风险列线图预测模型准确性尚可,对医务人员快速简单地进行卵巢癌风险判定具有一定的价值。但由于本研究为单中心病例、样本量偏少、纳入的影响因素有限,可进一步通过多中心、大样本的数据进行验证。
