核桃叶多糖对脂质和DNA氧化损伤的作用研究
2021-10-13于书燕杨淑青解志轲贺明于少轩刘青肖海芳
于书燕,杨淑青,解志轲,贺明,于少轩,刘青,肖海芳
(山东理工大学农业工程与食品科学学院,山东 淄博 255000)
生物体内自由基的生成与清除处于动态平衡状态,一旦机体受到有害因素的刺激,体内自由基便会过度累积并造成生物大分子氧化损伤,包括蛋白质氧化、脂质过氧化、DNA氧化损伤等,进而导致衰老及多种退行性疾病的发生,如癌症、糖尿病、动脉粥样硬化等[1-3]。因此,抗氧化物质对于清除过多的自由基及抑制氧化损伤进而维持人体健康方面发挥着重要作用。
研究发现合成抗氧化剂可以有效治疗多种疾病,但一些合成抗氧化剂如丁基羟基茴香醚(butyl hydroxyanisole,BHA)和二丁基羟基甲苯(butyl hydroxytoluence,BHT)等则会损害人体肝脏功能并诱发癌症。因此,植物提取物作为良好的抗氧化剂来源已被广泛应用[4-5]。大量研究表明,摄入天然抗氧化物质可以减少机体的氧化损伤程度,并降低多种疾病的患病风险[6-9]。多糖在自然界中分布广泛,是人体所需基本物质之一。近年来,植物多糖的抗氧化活性受到了各科学领域的关注。
前期试验结果表明,核桃叶多糖具有清除自由基的能力且对蛋白质氧化损伤具有显著的保护作用[10-11]。本研究进一步探讨了核桃叶多糖对Cu2+/H2O2、2,2′-偶氮二(2-甲基丙基咪)二盐酸盐[2,2′-azobis(2-methylpropionamidine)dihydrochloride,AAPH]和亚铁离子(ferrous ion,Fe2+)诱导的脂质、DNA氧化损伤的影响,旨在从生物大分子角度系统阐明核桃叶多糖的抗氧化活性。为进一步揭示核桃叶多糖的抗氧化活性提供了数据支持,同时为核桃叶多糖应用于食品、化妆品和药品行业提供理论依据。
1 材料与方法
1.1 材料与试剂
核桃叶多糖:山东理工大学考林微生物脂质实验室自制;健康SD大鼠:山东大学实验动物中心。
AAPH、2-硫代巴比妥酸(2-Thiobarbituricacid,TBA):上海麦克林生化科技有限公司;大豆卵磷脂、亚油酸(linoleic acid,LA)、三氯乙酸(trichloroacetic acid,TCA):国药集团化学试剂有限公司;pBR322DNA:北京索莱宝生物科技有限公司。
1.2 仪器与设备
HWS28恒温水浴锅:上海一恒科技有限公司;UV-2600紫外分光光度计:日本岛津公司;LE303E千分之一天平:美国METTLER-TOLEDO公司;AD500SH匀浆机:上海昂尼仪器仪表有限公司;5810R高速离心机:德国Eppendorf公司;GelDoc XRS凝胶成像系统:美国Bio-Rad公司;DYCP-32C核酸电泳槽:北京六一生物科技有限公司;Milli-Q生化分析型超纯水机:美国Millipore公司。
1.3 试验方法
1.3.1 大鼠组织匀浆的制备
在试验过程中对SD大鼠的处理符合动物管理方法的相关章程。取出处死后SD大鼠体内的脑组织和肝脏组织,用预冷过的生理盐水将血渍洗净,吸去残留水分后取1.0 g脑或肝脏组织并剪碎,然后加入9 mL预冷过的生理盐水,在冰水浴中匀浆10 min。在4℃,4 000 r/min的条件下离心10 min,取上清液,即得10%的组织匀浆[12]。
1.3.2 核桃叶多糖对脂质氧化损伤的保护作用
1.3.2.1 核桃叶多糖对烷氧自由基诱导脂质氧化损伤的影响
取一定体积的组织匀浆(肝脏组织或脑组织)和终浓度为10、20、30、40 mg/mL核桃叶多糖溶液置于多支2 mL离心管中,混匀,37℃水浴30 min。然后加入终浓度为50 mmol/L在37℃预热过的AAPH溶液,空白组以相同体积的磷酸盐缓冲液(pH7.4)代替AAPH,诱导组以相同体积的磷酸盐缓冲液(pH7.4)代替核桃叶多糖溶液。混匀后放在37℃水浴中继续处理4 h测定肝匀浆和脑匀浆中脂质氧化损伤程度。
1.3.2.2 核桃叶多糖对羟基自由基诱导脂质氧化损伤的影响
组织匀浆与核桃叶多糖的处理方式同1.3.2.1中所述。向试验组加入终浓度为25 mmol/L和0.1 mmol/L的H2O2和CuSO4溶液,空白组以相同体积的磷酸盐缓冲液(pH7.4)代替H2O2和CuSO4,诱导组以相同体积的磷酸盐缓冲液(pH7.4)代替核桃叶多糖溶液。混合均匀后37℃继续水浴90 min,测定肝匀浆和脑匀浆中脂质氧化损伤程度。
1.3.2.3 核桃叶多糖对Fe2+诱导卵磷脂氧化损伤的影响
参照黄晓昆等[13]的方法并略加修改。将卵磷脂溶于0.05 mol/L pH7.4磷酸缓冲盐溶液(phosphate buffer saline,PBS)中制备脂质体,分别加入不同质量浓度的核桃叶多糖(样品溶液终浓度分别为10、20、30、40、50 mg/mL),混匀后于37℃孵育10 min,然后加入终浓度为0.8 mmol/L的FeSO4溶液,37℃继续水浴40 min后检测卵磷脂氧化损伤程度。
1.3.2.4 核桃叶多糖对Fe2+诱导亚油酸氧化损伤的影响
以Fe2+/VC为诱导体系诱导LA氧化损伤。在LA中加入不同浓度的核桃叶多糖(样品溶液终浓度分别为 10、20、30、40、50 mg/mL),混匀后加入终浓度为50 μmol/L和 1 mmol/L的 FeSO4和 VC溶液,37℃避光水浴24 h后检测亚油酸氧化损伤程度。
1.3.2.5 脂质过氧化程度测定
采用TBA反应法检测脂质体氧化损伤的程度[14]。取上述处理后的脂质反应体系200 μL,分别加入20%TCA 800 μL 和 0.8%TBA 800 μL,混匀,置于沸水浴中加热30 min。冷却后离心10 min(6 000 r/min),取上清液在532 nm波长条件下测定吸光度。脂质过氧化程度计算公式如下。

式中:A为试验组的吸光度;A0为诱导组的吸光度。
1.3.3 核桃叶多糖对DNA氧化损伤的保护作用
1.3.3.1 核桃叶多糖对烷氧自由基诱导DNA氧化损伤的影响
试验以pBR322DNA为模型考察核桃叶多糖对自由基诱导的氧化损伤的抑制效果。将1 μL pBR322DNA加入微量离心管中,试验组中加入不同浓度的核桃叶多糖,混匀,37℃水浴30 min。然后试验组加37℃水浴2 min后的AAPH,对照组以相同体积的磷酸盐缓冲液(pH 7.4)代替AAPH。混匀后放在37℃水浴中继续处理,4 h后测定DNA氧化损伤程度。
1.3.3.2 核桃叶多糖对羟基自由基诱导DNA氧化损伤的影响
核桃叶多糖与pBR322DNA的孵育处理方式同1.3.3.1中所述。向试验组加入终浓度为25 mmol/L和0.1 mmol/L的H2O2和CuSO4溶液,对照组以相同体积的磷酸盐缓冲液(pH 7.4)代替H2O2和CuSO4。混合均匀后37℃继续水浴90 min,测定DNA氧化损伤程度。
1.3.3.3 DNA琼脂糖凝胶电泳
利用琼脂糖凝胶电泳考察pBR322DNA氧化损伤程度[15]。取0.2 g琼脂糖溶于20 mL TAE缓冲液,放在微波炉中加热处理1 min,冷却后加入2 μL溴化乙锭,混匀,倒胶,待其凝固后拔掉梳子。处理后的DNA反应体系中加入上样缓冲液,混匀后每孔加入等量的反应液,调整电泳电压为120 V,时间为30 min。凝胶电泳结束后在GelDoc XRS凝胶成像系统下成像,并采用Image J软件分析所成图像的条带灰度。
1.4 数据统计分析
采用Microsoft Excel 2016处理实验数据并进行One-Way ANOVA分析,P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 核桃叶多糖对脂质氧化损伤的保护作用
2.1.1 核桃叶多糖对SD大鼠脑匀浆中脂质(rat brain lipid,RBL)氧化损伤的保护作用
肝脏是机体重要的代谢器官,极易受到自由基的攻击产生脂质过氧化,所以肝匀浆常被作为脂质模型来考察植物活性物质的抗氧化能力[16-17]。图1、图2分别为核桃叶多糖对烷氧自由基与羟自由基诱导的RBL氧化损伤的抑制效果。

图1 核桃叶多糖对烷氧自由基诱导RBL氧化损伤的保护作用Fig.1 Protective effect of walnut leaf polysaccharide on alcoxyl radical-induced lipid oxidative damage in RBL

图2 核桃叶多糖对羟自由基诱导RBL氧化损伤的保护作用Fig.2 Protective effect of walnut leaf polysaccharide on hydroxyl radical-induced lipid oxidative damage in RBL
从图1、图2中可以看出,与空白对照组相比,Cu2+/H2O2与AAPH诱导组脂质过氧化水平明显升高;经10 mg/mL~40 mg/mL核桃叶多糖处理之后,相对于诱导组,RBL氧化损伤程度极显著降低(P<0.01),且呈浓度依赖关系。上述结果说明,核桃叶多糖抑制了烷氧自由基与羟基自由基诱导RBL氧化损伤。
2.1.2 核桃叶多糖对SD大鼠肝匀浆中脂质(rat liver lipid,RLL)氧化损伤的保护作用
核桃叶多糖对AAPH与Cu2+/H2O2诱导体系中RLL过氧化水平的影响见图3、图4。

图3 核桃叶多糖对烷氧自由基诱导RLL氧化损伤的保护作用Fig.3 Protective effect of walnut leaf polysaccharide on alcoxyl radical-induced lipid oxidative damage in RLL
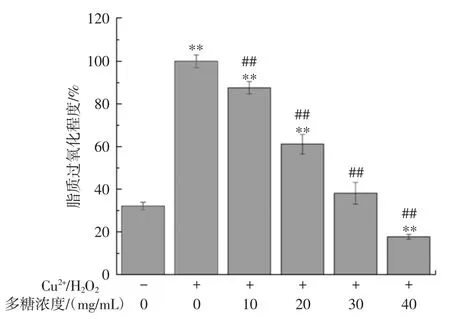
图4 核桃叶多糖对羟自由基诱导RLL氧化损伤的保护作用Fig.4 Protective effect of walnut leaf polysaccharide on hydroxyl radical-induced lipid oxidative damage in RLL
从图3、图4中可以看出,与空白组相比,Cu2+/H2O2与AAPH诱导组脂质过氧化水平明显升高;经10mg/mL~40 mg/mL的核桃叶多糖预先孵育处理后,羟自由基与烷氧自由基诱导的脂质过氧化水平明显下降,且多糖浓度越高保护效果越好(P<0.01)。上述结果说明,核桃叶多糖对烷氧自由基与羟基自由基引发的RLL氧化损伤具有明显的保护作用。
2.1.3 核桃叶多糖对Fe2+诱导卵磷脂氧化损伤的保护作用
卵磷脂中的多不饱和脂肪酸在金属离子催化下发生脂质过氧化,导致组织损伤[18]。核桃叶多糖对羟基自由基诱导的大豆卵磷脂氧化损伤的抑制如图5所示。

图5 核桃叶多糖对Fe2+诱导卵磷脂脂质过氧化的保护作用Fig.5 Protective effect of walnut leaf polysaccharide on Fe2+-induced lecithin liposomes peroxidation
由图5可知,与Fe2+诱导组相比,空白组脂质体过氧化水平较低。核桃叶多糖在10 mg/mL~50 mg/mL的浓度范围内均对脂质过氧化表现出较强的浓度依赖性的抑制作用(P<0.01)。当浓度达到50 mg/mL时,由Fe2+引起的卵磷脂过氧化程度降低到30.85%。由此可知,核桃叶多糖可明显阻止因羟基自由基引发的卵磷脂过氧化程度。
2.1.4 核桃叶多糖对Fe2+诱导亚油酸氧化损伤的保护作用
机体产生的氧自由基能攻击生物膜中的多不饱和脂肪酸,引起脂质过氧化[19]。核桃叶多糖对Fe2+诱导的亚油酸脂氧化损伤的抑制如图6所示。

图6 核桃叶多糖对Fe2+诱导亚油酸脂质过氧化的保护作用Fig.6 Protective effect of walnut leaf polysaccharide on Fe2+-induced linoleic acid liposomes peroxidation
由图6可知,10 mg/mL的核桃叶多糖对羟基自由基诱导的亚油酸氧化损伤无明显抑制效果,而经20mg/mL~50 mg/mL的核桃叶多糖处理后,氧化降解程度明显降低(P<0.01)。上述结果说明,核桃叶多糖在一定浓度范围内抑制了Fe2+诱导的亚油酸过氧化水平。
2.2 核桃叶多糖对DNA氧化损伤的保护作用
过多的自由基也会导致包括DNA链断裂、DNA碱基修饰、DNA位点突变、DNA双链畸变等形式的DNA氧化损伤[20]。图7为核桃叶多糖对烷氧自由基诱导pBR322DNA氧化损伤的影响。
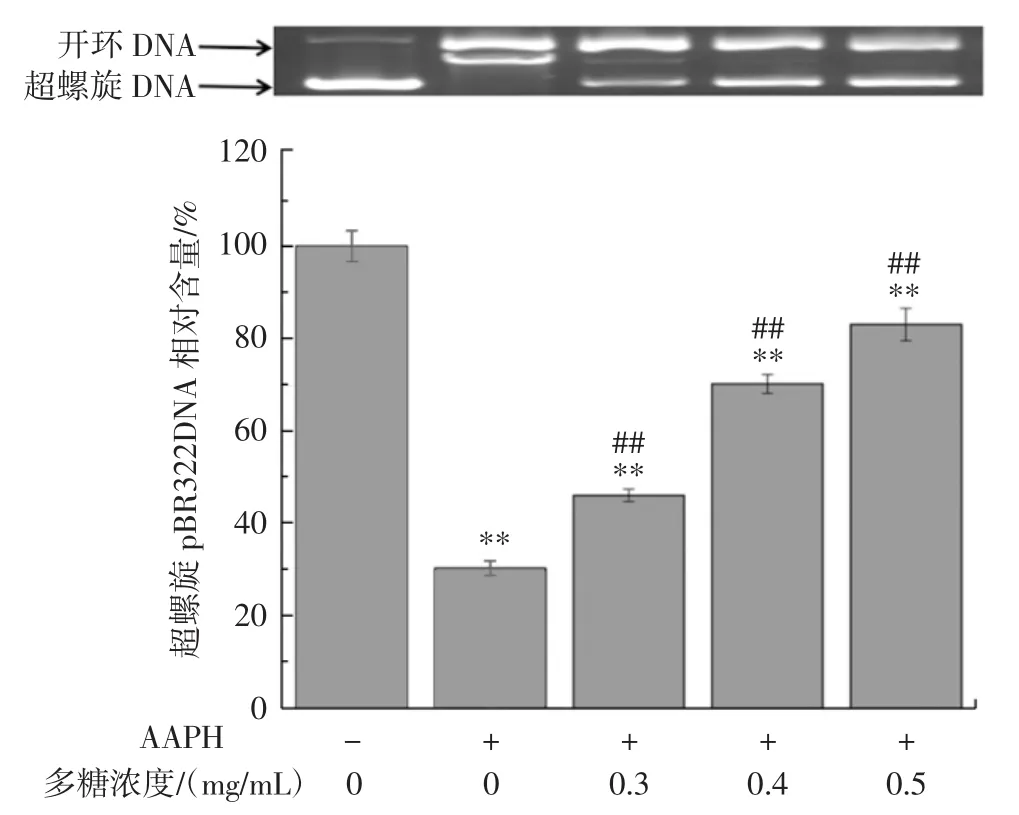
图7 核桃叶多糖对烷氧自由基诱导DNA氧化损伤的保护作用Fig.7 Protective effect of walnut leaf polysaccharide on alcoxyl radical-induced DNA oxidative damage
从图7中可以看出,空白组pBR322DNA的存在形式为超螺旋结构,AAPH诱导组DNA几乎全部转变成了开环结构,说明烷氧自由基诱使pBR322DNA发生了氧化损伤,破坏了其超螺旋结构。0.3mg/mL~0.5mg/mL的核桃叶多糖均可抑制这种转变,且随着浓度增加,超螺旋结构的pBR322DNA明显增多。上述结果表明,核桃叶多糖对烷氧自由基诱导的DNA氧化损伤具有显著的保护作用。
核桃叶多糖对羟基自由基诱导pBR322DNA氧化损伤的影响如图8所示。
由图8可知,羟基自由基可明显破坏pBR322DNA的超螺旋结构(P<0.01)。经0.10 mg/mL~0.20 mg/mL的核桃叶多糖孵育处理之后,超螺旋结构的pBR322DNA比例显著增加(P<0.01),开环结构减少。由此可知,核桃叶多糖能够保护pBR322DNA不被羟基自由基氧化降解。

图8 核桃叶多糖对羟自由基诱导DNA氧化损伤的保护作用Fig.8 Protective effect of walnut leaf polysaccharide on hydroxyl radical-induced DNA oxidative damage
3 结论
本研究利用Cu2+/H2O2和AAPH两种不同的自由基诱导体系,探讨核桃叶多糖对大鼠肝匀浆和脑匀浆、卵磷脂、亚油酸及DNA氧化损伤的影响。结果表明,核桃叶多糖在一定浓度范围内对羟基自由基以及烷氧自由基诱导的脂质和DNA氧化损伤具有显著的抑制作用,且呈浓度依赖性。该研究从生物大分子角度评价了核桃叶多糖的抗氧化活性,并为农业废弃核桃叶的综合利用提供了思路。
