预热超声对菠萝蜜种子分离蛋白起泡性及结构的影响
2021-10-13周若楠张彦军钟俊桢刘成梅
周若楠,张彦军,钟俊桢*,周 磊,刘 伟,刘成梅
(1.南昌大学食品科学与技术国家重点实验室,江西 南昌 330047; 2.中国热带农业科学院香料饮料研究所,海南 万宁 571533)
菠萝蜜(Artocarpus heterophyllus Lam)属桑科,又称“木菠萝、树菠萝”,其果实清甜可口,香味浓郁,营养价值高,被誉为“热带水果皇后”,广泛种植于墨西哥、马来西亚等热带国家[1]。在我国主要种植于海南、云南等热带和亚热带等地区。菠萝蜜种子占果实总重量的8%~15%,是淀粉(67%)和蛋白质(20%)的良好来源[2]。菠萝蜜含有许多植物化学物质,如木质素、异黄酮、多酚等,它们具有优异的生物活性,如抗衰老、抗高血压、抗癌和抗氧化等[3]。研究发现菠萝蜜种子分离蛋白(Jackfruit Seed Isolate Protein,JSPI)中的必需氨基酸占总氨基酸的48.39%,高于大豆蛋白(37.79%),其中苏氨酸、缬氨酸、苯丙氨酸含量均高于大豆蛋白,其它必需氨基酸含量与大豆蛋白无异。作为世界上最重的水果,其种子产量高,但只有少量被用来食用,大部分被丢弃,既造成了资源的浪费,又降低了菠萝蜜的经济效益[4]。
由于植物蛋白在人类健康和营养中的重要作用,使其作为食品加工中的一种功能成分的需求越来越大。起泡性是蛋白质重要的功能性质之一,对蛋糕、冰激凌、饮料等起泡性要求较高的食品十分重要,已逐渐成为研究热点[5]。动物蛋白,如蛋清蛋白和乳清蛋白,具有良好的起泡性被广泛用做发泡剂。但动物蛋白价格昂贵,应用成本高,可以考虑用优质的植物蛋白作为替代品[6]。菠萝蜜具有优异的功能和营养特性,可以成为一种新的蛋白来源。但与动物蛋白相比,JSPI的起泡性较差,在食品工业中的应用不如动物蛋白。所以改善JSPI的起泡性,扩大在食品工业中的应用,具有重要的科研意义和经济意义。
改善起泡性的方法包括化学、物理或酶法改性等。化学改性可能会产生或引入有毒或影响食品风味的物质;酶法改性会使蛋白质在酶解过程中产生苦味肽,影响产品的风味和口感;物理改性作用时间短、安全性好,对蛋白质营养价值损失小[7]。超声是一种绿色、安全、高效的新型非热物理技术,超声引起的空化效应会导致高温、高压、高剪切能波和湍流,从而改变蛋白质的功能和结构性质[8]。Feng等[9]发现在pH 2.0~10.0条件下,超声(400,600 W)可以显著提高李子分离蛋白的起泡能力和泡沫稳定性。Xiong等[10]发现超声后的豌豆蛋白,起泡能力从145.6%提高到200.0%,泡沫稳定性从58.0%增加到73.3%。Flores-Jiménez等[11]也得出类似的结论。超声可以作为改善蛋白质起泡性的技术手段,在蛋白质的开发与利用上具有广阔的应用前景和潜力[12]。
本研究针对JSPI的起泡性,通过预热超声技术改善JSPI的起泡性,并探究结构对起泡性的影响,期望拓宽JSPI在食品领域中的应用,也为超声改性蛋白方面提供一些新的理论参考。
1 材料与方法
1.1 材料与试剂
菠萝蜜种子 海南万宁(热带香料饮料作物研究所);其它化学试剂均为分析纯。
1.2 主要仪器与设备
GA92-IIDB超声波细胞粉碎机 无锡市上佳生物有限公司;F-7000荧光分光光度计 日本日立公司; MOS-450光谱仪 法国Biologico;T 25 digital高速分散机 德国IKA公司; NanoZsp电位仪 英国Malven公司;Ms3000LvAeros激光衍射粒度分析仪 英国Malvern公司;Synergy H1酶标仪 美国Bio Tek 公司。
1.3 试验方法
1.3.1 菠萝蜜种子分离蛋白(JSPI)制备
参考Zhang等[13]的方法制备JSPI。用研磨机将菠萝蜜种子研磨成粉,在室温下风干过筛(40目)。用石油醚对种子粉(1:5,V/w)脱脂并得到脱脂粉。将脱脂粉(1:10,w/V)分散在蒸馏水中,用1 mol NaOH调节至pH 10.0,搅拌1 h,在4 800 r·min-1条件下离心15 min。取上清液,用1 mol HCl调节至pH 4.3,在4 ℃条件下保持1 h。在4 800 r·min-1条件下离心15 min收集沉淀物,再用1 mol NaOH 调节至pH 7.0使沉淀物溶解。用透析袋(7 kDa)透析24 h,将样品冷冻干燥。
1.3.2 起泡性条件优化
(1) 预热温度
将JSPI(5%,w/v)溶于蒸馏水中,室温下搅拌1 h。在50 ℃~80 ℃条件下,用磁力搅拌水浴锅加热30 min,用冰水浴快速冷却至室温,将样品冷冻干燥。
(2) 超声功率及超声时间
将JSPI(5%,w/v)溶于蒸馏水中,室温下搅拌1 h。分别在超声功率200,400,600 W,超声时间10,20,30 min(脉冲时间为2 s,关闭时间为2 s)条件下处理JSPI,超声探头在液体表面1.5 cm以下,冰水浴中进行并每10 min更换1次冰水,处理后的样品冷冻干燥[14]。
1.3.3 起泡性及泡沫稳定性
参考Somruedee等[15]的方法测定起泡性。蛋白样品(20 mg·mL-1)溶于0.01 mol磷酸缓冲液(pH 9.0)中,取15 mL蛋白溶液倒入50 mL量筒中。用高速分散机搅打1 min,转速为20000 r·min-1。起泡能力以2 min后泡沫的体积与初始体积的百分比表示。泡沫稳定性以30 min后泡沫的体积与2 min时泡沫体积的百分比表示。
起泡性(%)=[(V0-15)/15]×100;
泡沫稳定性(%)=[(V1-15)/(V0-15)]×100;
其中V0是2 min时泡沫体积,V1是30 min时泡沫体积。
1.3.5 SDS-PAGE凝胶电泳
参考Ma等[16]的方法测定在还原和非还原条件下的SDS-PAGE。制备12%的分离凝胶和4%的浓缩凝胶。取30 μL蛋白溶液(2 mg·mL-1),加入10 μL 4×含β-巯基乙醇或4×不含β-巯基乙醇的上样缓冲液,沸水浴加热7 min,离心2 min。在凝胶泳道加入10 μL样品或5 μL Mark。电压调整为80 V,15 min后再调至120 V,运行40 min。用考马斯亮蓝(R-250)染色50 min,再用脱色液脱色至条带清晰可见。
1.3.6 圆二色谱
参考Zheng等[17]的方法测定蛋白质二级结构。用0.01 mol磷酸盐(pH 9.0)缓冲液配制0.1 mg·mL-1的蛋白溶液,路径长度为1 mm,扫描波长范围为190~240 nm。在25 ℃条件下进行测定,以0.01 mol磷酸盐(pH 9.0)作为空白对照。采用Dichro Web网站的CONTIN程序对蛋白质二级结构进行拟合分析并计算出二级结构含量。
1.3.7 荧光光谱
参考He等[18]的方法测定蛋白质的三级结构。用0.01 mol磷酸盐(pH 9.0)缓冲液将蛋白样品配制成0.1 mg·mL-1的蛋白溶液,激发波长280 nm,激发和发射的狭缝宽度均为2.5 nm,扫描速度1 200 nm·min-1,在25 ℃条件下记录290~450 nm波长范围内的发射光谱。
1.3.8 表面疏水性测定(H0)
参照Haskard等[19]的ANS探针法测定蛋白质的表面疏水性。蛋白样品用0.01 mol磷酸盐(pH 9.0)缓冲液配制成0.04~0.12 mg·mL-1的蛋白溶液。取50 μL 8.0 mmol·L-1的ANS加到4 mL的蛋白溶液中,激发波长390 nm,发射波长470 nm。以荧光强度对蛋白浓度作图,斜率即为蛋白质分子的表面疏水性指数(H0)。
1.3.9 电位、粒径测定
蛋白样品用0.01 mol磷酸盐(pH 9.0)配制成0.1 mg·mL-1蛋白溶液,在25 ℃条件下测定溶液电位。蛋白样品(0.1 g·mL-1)溶于蒸馏水中,遮光率为8%~12%,泵速为2000 r·min-1,分散相折射率和吸收参数分别为1.330和0.001[9],测定样品粒径。
1.4 数据分析
所有实验重复3次,实验数据表示为平均值±标准差。所有统计数据使用SPSS Statistics 21.0统计软件进行分析,Tukey法计算平均值之间的显着性差异(P<0.05)。用Origin 8.5软件用于数据绘制。
2 结果与分析
2.1 起泡性条件优化
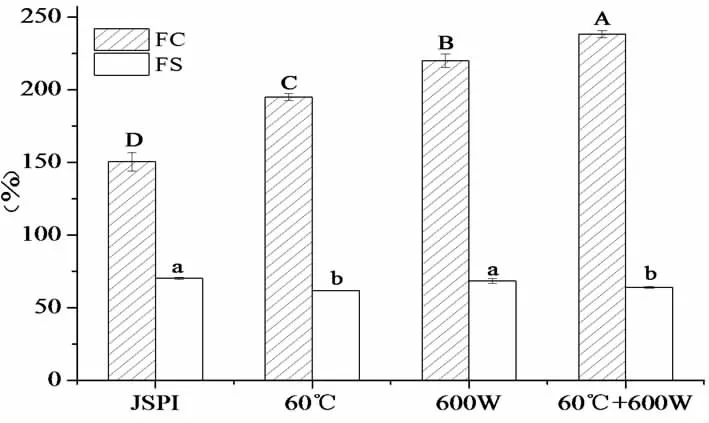
从图1(A)中,随着预热温度的升高,JSPI的起泡能力先增强后下降,60 ℃时的起泡能力最好,为200%。50 ℃(55.95%),60 ℃(57.71%),70 ℃(47.71%)时的泡沫稳定性没有显著差异(P>0.05),80 ℃时的泡沫稳定性最差,为42.34%。图1(B)中,起泡性随超声功率的增加而增加,600 W时的起泡能力为216.45%,泡沫稳定性(66.79%)与400 W(63.39%)的没有显著性差异(P>0.05)。200 W处理的起泡能力(158%)和泡沫稳定性(59.55%)最差。图1(C)中,超声20与30 min的起泡性无明显差异(P>0.05),均高于10 min时的起泡性。不同处理时间对泡沫稳定性没有显著性差异。由以上分析得到最佳条件:预热温度60 ℃,超声功率为600 W,超声时间20 min。在此基础上,还研究了60 ℃与600 W共同处理JSPI,探究JSPI起泡性与其结构之间的关系。

其中(A),(B),(C)分别为不同预热温度、超声功率及超声时间对JSPI起泡性的影响。不同大写字母FC有显著性差异,不同小写字母表示FS有显著差异(P<0.05)。
2.2 起泡性及泡沫稳定性
起泡性是指蛋白在快速搅打后吸附到水-空气界面,分子部分展开,大量空气进入,在气-液界面形成一层薄而坚韧的膜,并形成气泡[6]。泡沫稳定性可以通过在一定时间内,泡沫体积变化量来表示,根据起泡能力和泡沫稳定性测定泡沫的质量[20]。影响起泡性的因素很多,如蛋白种类、pH、表面疏水性、净电荷等。图2中,与未处理的JSPI相比,600 W超声处理后的起泡能力增加了45.25%,泡沫稳定性没有显著性差异(P>0.05)。超声的空化效应使蛋白质发生变性,并通过增加泡沫的粘结性和柔韧性改善起泡能力和泡沫性能[21]。Alejandro等[22]发现高强度超声处理的蚕豆蛋白,起泡能力从145.8%增加至258.3%。Mei等[23]发现超声处理的乳清蛋白,起泡能力提高了18%,泡沫稳定性提高了35%。60 ℃处理JSPI的起泡能力增加了29.64%,泡沫稳定性下降至61.81%。Chao等[24]发现豌豆蛋白在80 ℃~100 ℃处理后,在任何pH条件下其起泡能力都较低。在pH 5.0条件下,50 ℃和70 ℃处理都有较高的起泡能力。60 ℃+600 W超声处理的JSPI起泡能力增加了58.44%,表明热处理和超声对JSPI起泡能力表现为协同作用,泡沫稳定性下降至64.00%。Morales等[25]研究发现,超声(750 W)与70 ℃,80 ℃,85 ℃共同处理大豆分离蛋白的起泡能力均高于单独超声或单独温度处理。适当的升高温度可以改善超声对蛋白质修饰的作用,从而进一步提高起泡性[25]。
FC:起泡能力;FS:泡沫稳定性。
2.3 SDS-PAGE凝胶电泳
图3中,在非还原条件下,JSPI的分子量主要在17~26 kDa之间(Line 1)。由于JSPI中存在二硫键,在β-巯基乙醇作用下出现了新的条带,主要集中在10~17 kDa之间(Line 5)。与未处理的JSPI相比,600 W处理的JSPI的电泳图谱没有发生明显变化(Line 1与Line 3,Line 5与Line 7),这表明600 W超声不能改变使JSPI的分子量。Hu等[14]研究发现超声处理的大豆分离蛋白的电泳图谱没有明显变化。Flores-Jiménez等[11]也得出相似的结论。然而,Jambrak等[26]报道,蛋白分子量发生改变是由于超声的空化效应引起较高的剪切应力和湍流效应,导致蛋白分子结构分裂所致。Resendiz-Vazquez等[27]研究得出超声(200,400,600 W)可以使JSPI分子量发生变化。该结论与本研究结果不同,可能与蛋白的种类、来源和超声条件有关。经过60 ℃处理的JSPI(Line 2,4,6,8)均出现了一条新的分子量条带(a,d,b,e),可能是加热使可溶性蛋白分子聚集,形成大分子量蛋白。60 ℃+600 W处理的JSPI(Line 4, 8)在热处理和超声处理的共同调控下有条带消失(c, f),可能是热处理后的可溶性蛋白在超声的空化作用下空间结构被破坏,导致条带消失。安然[28]研究发现,与未处理的相比,热处理(60 ℃,80 ℃,100 ℃)的可溶性大豆分离蛋白进行超声处理(600 W)后,在电泳图谱上可以看出11S蛋白的B亚基含量显著降低。从图谱中可以看出,热处理和超声都没有破坏JSPI的二硫键。
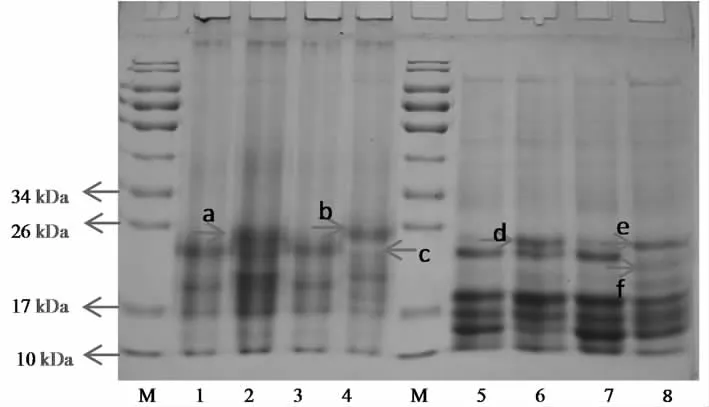
非还原性条件:Line 1-4:JSPI;60 ℃;600 W;60 ℃+600 W;还原性条件:Line 5-8:JSPI;60 ℃;600 W;60 ℃+600 W。
2.4 圆二色谱
从表1中看出,JSPI的二级结构主要为β-折叠和不规则卷曲。经过处理的JSPI均表现出α-螺旋和β-转角含量下降,β-折叠和无规则卷曲含量上升。蛋白质的二级结构既取决于氨基酸的局部序列,也取决于分子不同部分之间的相互作用,超声处理可以破坏这些相互作用,导致二级结构变化[9]。热处理对蛋白二级结构的损失具有时间依赖性,较长的加热时间,二级结构的损失更大。α-螺旋含量减少表明蛋白分子在加热时发生变性,而β-折叠含量增加表明变性分子重新排列并结合成更稳定的产物[29]。Fan等[30]研究发现,随着热处理时间增加,β-乳球蛋白的α-螺旋和β-转角含量减少,β-折叠含量增加。较高的β-折叠和无规则卷曲含量会使蛋白分子柔性增加,结构变松散,蛋白分子内部的疏水位点暴露在环境中,疏水性增强,可以在一定程度上提高蛋白的起泡性[31]。计等[6]研究得出,大豆蛋白的起泡性与α-螺旋和β-转角含量成负相关,与β-折叠和无规则卷曲含量呈正相关。此外,β-折叠含量与蛋白三级结构有关,β-折叠含量增加可以诱导色氨酸残基从亲水环境转移到疏水环境中,从而表现出更高的荧光强度[30]。
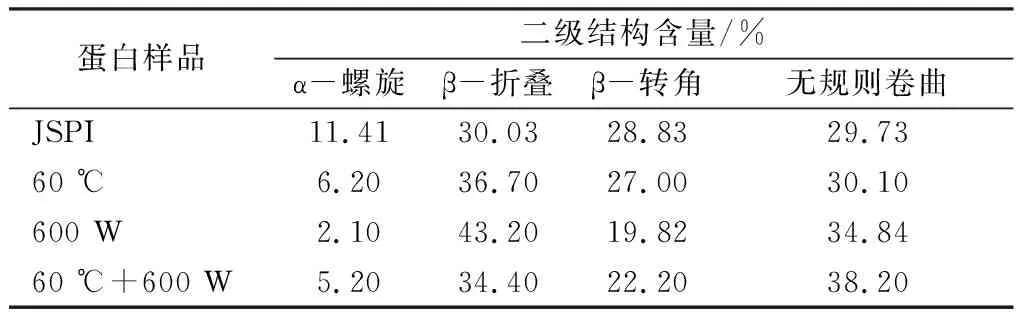
表1 4种蛋白样品的二级结构含量
2.5 荧光光谱
蛋白质的荧光主要来自芳香族氨基酸,通过测量酪氨酸和色氨酸所处微环境中的变化,可以表征蛋白质的三级结构变化[32]。从图5中可以看出,600 W处理的JSPI的荧光强度增强,表明超声可以促进JSPI分子展开,暴露了更多的色氨酸残基,这导致微环境的非极性增加,荧光强度增强[33]。60 ℃处理出现了最高的荧光强度和最大红移量(△λ=3 nm),表明热处理对JSPI的结构变化作用更为明显,处于内部疏水环境的色氨酸和酪氨酸残基暴露出来。60 ℃+600 W处理的荧光强度有所下降,可能是60 ℃和600 W超声共同作用,使JSPI发生较大的变性,导致部分色氨酸和酪氨酸暴露在亲水环境中。荧光强度增强与圆二色谱结果中β-折叠含量的增加相对应,进一步可以证明,JSPI结构变松散,内部的疏水基团暴露在分子表面[34],疏水基团的暴露导致疏水性增加,进而可以改善JSPI的起泡性质。

图4 4种蛋白样品的荧光光谱图
2.6 表面疏水性(H0)
表面疏水性反映了疏水基团的暴露,表面疏水性指数(H0)可以看作是蛋白分子表面疏水基团数量的一个指标,影响着蛋白质的结构和功能性质,较松散的蛋白结构和多肽链的展开可以暴露出更多的疏水腔和基团,较高的疏水性可以改善蛋白质的起泡性和乳化性[35]。图5中,600 W处理的JSPI的H0增加了46.58%,表明超声可以诱导JSPI分子展开,减少分子间缔合,使更多的疏水区域暴露在溶剂环境中[14]。60 ℃处理JSPI的H0增加了60.35%,热变性可以将蛋白质解离成亚单位,分子结构展开,暴露出更多的疏水基团[36]。F.Peyrano等[36]曾报道,在70°C,pH 10.0时,豇豆分离蛋白H0的最大增量为149%,90°C处理的H0增量为74%~81%。经过60 ℃+600 W处理的JSPI的H0则有最大增量,为96.34%,表明热处理和超声对JSPI的H0也表现为协同作用。表面疏水性增加可以改善JSPI的起泡性。
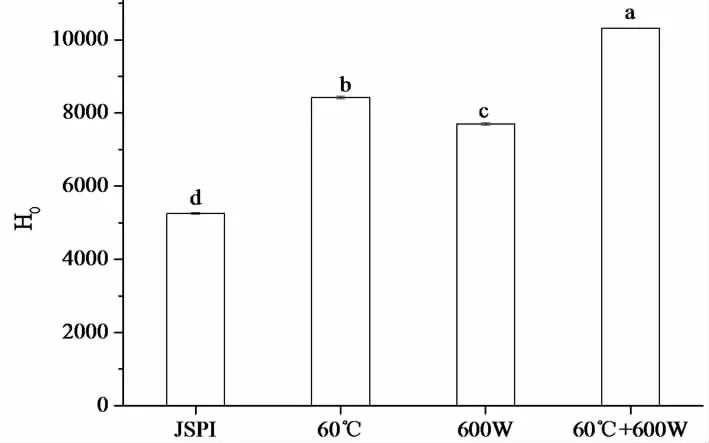
图5 4种蛋白样品的表面疏水性(H0)
2.7 电位
蛋白质溶液表面的基团具有电离作用,在酸性溶液中带正电荷,在碱性溶液中带负电荷[37]。当电位绝对值低时,表明溶液体系中的蛋白质分子表面带有负电氨基酸的含量低,表面电荷少,分子间容易聚集形成沉淀,导致溶液体系不稳定;表面电荷越多,说明蛋白质分子间的静电斥力越强,通过破坏和抑制蛋白质分散体的进一步聚集,可以维持溶液体系的稳定[38,39],也有助于维持蛋白泡沫的稳定性。从图7中可以看出,600 W处理后JSPI的电位从-22.03 mV增强至-24.53 mV,这是因为较高强度的超声作用会破坏蛋白质分子聚集体,使带有负电的氨基酸更多的暴露在蛋白分子表面,表面负电荷增加。Bahman等[40]曾报道,超声后的小米蛋白浓缩物的电位从-32.9增强至-42.2 mV。60 ℃处理后JSPI的负电位值增加,说明热处理会出暴露更多的疏水氨基酸,蛋白质分子表面电荷减少。60 ℃+600 W处理的负电位值最高,可能是两种条件作用下,使更多的疏水氨基酸暴露在外部环境中,电荷量下降。负电位值增加,会导致溶液体系不稳定,泡沫稳定性下降。

图6 4种蛋白样品的电位图
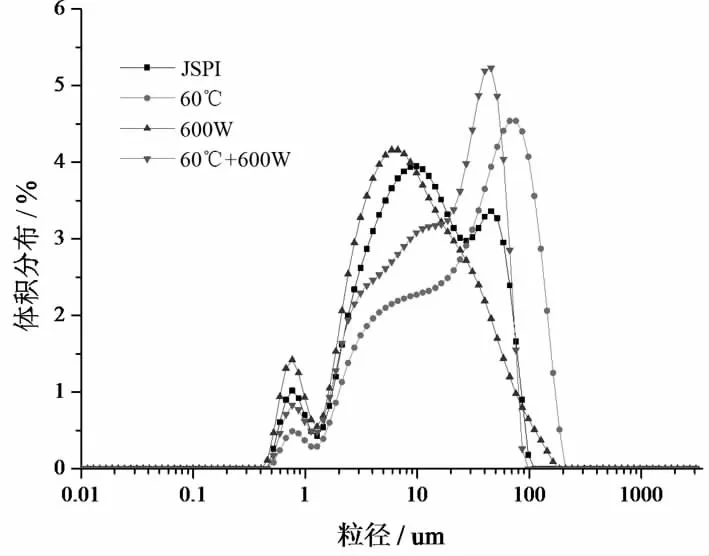
图7 4种蛋白样品的粒径图
2.8 粒径
从图8中看出,JSPI的粒子分布主要在1~100 nm之间,在0.5~1 nm之间有较少的分布。600 W处理后JSPI在0.5~1,1~100 nm粒径峰升高,且1~100 nm的粒径峰向粒径小的方向偏移,说明超声作用可以将JSPI分解成更小的蛋白颗粒。Jambrak等[26]曾报道,在超声频率20 kHz条件下,乳清蛋白颗粒尺寸减小,比表面积增加,40 kHz处理的颗粒尺寸则显著减小。60 ℃处理的JSPI在0.5-1 nm和1~10 nm处的粒径峰下降,大于100 nm的粒径体积增多,且在100 nm处出现了最高峰,表明热处理使JSPI分子聚集形成了大分子蛋白颗粒。Xiong等[41]研究发现,热处理后的牛奶血清蛋白的粒径峰从68变化到92 nm,乳铁蛋白和牛奶血清混合物的粒径峰从79变化到125 nm。60 ℃+600 W处理JSPI的粒径分布基本介于600 W处理和60 ℃处理之间,说明超声处理分散了部分60 ℃处理形成的大分子蛋白聚集体。Morales等[25]探究了大豆分离蛋白粒径与起泡性的关系,超声处理的大豆分离蛋白粒径减小,同时起泡性也显著增加。80 ℃,超声和80 ℃处理后的粒径增加,但起泡性也显著增加。该研究指出,在较低的比例下,粒径较高的蛋白群体也可以提高起泡性。本研究也得到相似的结论,粒径减小或较低比例存在的大分子蛋白均可以增加JSPI的起泡性。粒径的部分变化与SDS-PAGE图谱中蛋白分子量的变化一致。
3 结论
本研究在最佳起泡性性条件下探究了结构变化对JSPI起泡性的影响。起泡性结果发现,60 ℃+600 W处理的JSPI起泡性增加了58.44%,高于600 W超声(45.25%)和60 ℃ (29.64%),表明两者对JSPI起泡性表现为协同作用,但泡沫稳定性没有提高。结构变化对起泡性有显著的影响。SDS-PAGE结果表明,600 W超声没有改变JSPI分子量,60°C处理使部分可溶性蛋白分子聚集,形成了较大分子量蛋白。圆二结果表明,起泡性的增强与β-折叠和无规则卷曲含量增加有关,较高的β-折叠和无规则卷曲含量会使蛋白分子柔性增加,结构变松散,疏水性增强,在一定程度上提高起泡性。荧光强度增强和表面疏水性(H0)增加进一步说明,起泡性增加与蛋白结构变松散,内部的疏水基团的暴露有关。电位值会影响泡沫的稳定性,电位绝对值越大表明蛋白质分子间的静电斥力越强,可以有效阻止蛋白质分散体的聚集,维持体系的稳定。粒径大小也在一定程度上影响起泡性,粒径减小或在较低比例下,粒径较大的蛋白分子均可以提高JSPI的起泡性。本研究采用预热超声技术JSPI起泡性进行改性处理,期望拓宽JSPI的应用范围,促进菠萝蜜产业的发展,也为超声改性蛋白方面提供一些新的理论参考。
