水热法一锅合成Ni/ZrO2加氢催化剂
2021-10-13梁秋鸿袁铭伟彭艳杨静陈超
梁秋鸿,袁铭伟,彭艳,杨静,陈超*
(1.南昌大学1a.化学学院,1b.江西省环境与能源催化重点实验室,江西 南昌 330031;2.江西晨光新材料股份有限公司,江西 九江 332500
环己烷是一种用途极为广泛的有机化工原料,不仅是制备环己酮、环己醇和尼龙的重要中间体,还可作为有机溶剂溶解树脂、沥青、纤维素醚、蜡和橡胶等高分子材料[1-3]。通常环己烷由苯加氢催化制得,其催化剂种类大致可分为贵金属催化剂和Ni系催化剂两大类[4]。其中,贵金属催化剂不仅具有较高的催化活性和选择性,并且具有较高的耐腐蚀性能和耐热性,但高昂的成本限制了其在大规模工业生产中的应用。Ni系催化剂中以雷尼镍(Raney Ni)为代表,这类催化剂在催化加氢反应中转化率和选择性高、回收方便且价格便宜,在较严苛的生产条件和低压环境下都能具有良好的催化活性。然而Raney Ni也存在着很明显的缺陷,其制备过程中需要大量的氢氧化钠溶液,从而造成碱洗废液污染,同时溶解掉的铝导致铝资源的浪费[5-6],另外Raney Ni催化剂在空气中易燃,在工业生产中存在较高的危险系数,因此Raney Ni催化剂仍不是一种工业上完美的加氢催化剂,需要找到更好的Ni系加氢催化剂。
纳米ZrO2热稳定性高,无毒无害,同时具有大量的表面酸性和碱性位,还具有氧化还原性,可与活性组分产生相互作用,是一种优良的催化剂载体[7-8]。Lorenzut B等[9]用不同的方法将Ru负载在ZrO2上制备Ru@ZrO2催化剂,并用于氨解制氢气的反应。结果表明,不同方法制备的ZrO2会影响Ru@ZrO2催化剂结构和性质,从而影响对反应的催化性能。Moreno J M等[10]用碱金属碳酸盐对Pd/ZrO2催化剂进行改性,并用于甲醇溶液中三氯吡啶和氯苯的加氢脱氯反应。刘其海[11]等考察了纳米ZrO2负载Ni对一氧化碳选择性甲烷化反应的影响,并得到不错的选择性及转化率。
本文采用水热法一锅合成了一系列Ni/ZrO2催化剂,与浸渍法合成的Ni/ZrO2催化剂相比,该合成方法简单、快捷,并且合成的催化剂具有更大的比表面积和催化活性,具有一定的潜在应用价值。
1 实验部分
1.1 化学试剂
实验中所用氧氯化锆(ZrOCl2)为化学纯,丙三醇(CH2(OH)CH(OH)CH2(OH))、六水硝酸镍(Ni(NO3)2·6H2O)、苯(C6H6)、环己烷(C6H12)为分析纯,以上试剂均购自国药集团化学试剂有限公司,氢氧化钠(NaOH)为分析纯,购自西陇科技有限公司,四氯化锆(ZrCl4)为分析纯,购自百灵威科技有限公司。
1.2 实验方法
(1)水热法一锅制备Ni/ZrO2催化剂X%NG-S(X表示Ni的不同载量,N表示Ni,G表示ZrO2,S表示水热法)
配制ZrOCl2的0.4 mol·L-1的水溶液,在室温下加入丙三醇,匀速搅拌15 min,混合均匀后加入1.0 mol·L-1的NaOH溶液,搅拌15 min后加入X mL(X为制备目标催化剂的Ni负载量)0.5 g·L-1的Ni(NO3)2·6H2O水溶液,继续搅拌15 min后将混合液移入100 mL聚四氟乙烯密闭水热反应釜中,在180 ℃恒温下反应18 h。反应生成的产物经过抽滤,用水和乙醇在7 000 r·min-1下离心洗涤各3次,真空干燥箱内60 ℃干燥24 h,经研磨后得到X%NG-S。本文采用此法分别制得5%NG-S、10%NG-S、15%NG-S、20%NG-S。此方法得到的催化剂中ZrO2均为四方晶相结构。
(2)浸渍法合成Ni/ZrO2催化剂X%NG-J(X表示不同Ni载量,N表示Ni,G表示ZrO2,J表示浸渍法)
首先用水热法合成四方晶相ZrO2[12],具体方法为:配制ZrOCl2的0.4 mol·L-1的水溶液,在室温下加入丙三醇,匀速搅拌15 min,混合均匀后加入1.0 mol·L-1的NaOH溶液,搅拌15 min后将混合液移入100 mL聚四氟乙烯密闭水热反应釜中,在180℃恒温下反应18 h。反应生成的产物经过抽滤,用水和乙醇在7 000 r·min-1下离心洗涤各3次,真空干燥箱内60 ℃干燥24 h,经研磨后得到ZrO2粉体,此粉体为单一的四方晶相氧化锆。将ZrO2粉体后用浸渍法制备X%NG-J催化剂,方法为:称取0.1g制备的四方晶相ZrO2,加入X mL(X为制备目标催化剂的Ni负载量)0.5 g·L-1的Ni(NO3)2·6H2O水溶液,室温下搅拌12 h,用水和乙醇在7 000 r·min-1下离心洗涤各3次,真空干燥箱内60 ℃干燥24 h,经研磨后得到X%NG-S。分别制得了5%NG-J、10%NG-J、15%NG-J、20%NG-J。此方法得到的催化剂中ZrO2均为四方晶相结构。
(3)水热法合成15%Ni/ZrO2催化剂后并450 ℃焙烧(15%NG-S-450 ℃)
用水热法合成15%Ni/ZrO2-S,然后在马弗炉中450 ℃焙烧6 h,得到15% NG-S-450 ℃。
(4)浸渍法合成四方晶相15%Ni/ZrO2催化剂并450 ℃焙烧(15%NG-J-450 ℃)
首先用水热法合成四方晶相ZrO2,得到ZrO2后用浸渍法制备15%NG-J催化剂,并在马弗炉中450 ℃焙烧6 h,研磨后得到15%NG-J-450 ℃。
(5)浸渍法合成单斜晶相Ni/ZrO2催化剂(15%NG-C-450 ℃)
首先用沉淀法合成单斜晶相ZrO2-C,方法为:常温下在四氯化锆溶液中加入氢氧化钠溶液,生成白色沉淀,将白色沉淀过滤洗涤干燥研磨后得到单斜晶相ZrO2-C。得到的ZrO2-C用浸渍法负载Ni,并在马弗炉中450 ℃焙烧6 h,研磨后得到15%NG-C-450 ℃。
所有的催化剂在进行催化反应前均要通过还原预处理,预处理条件为:在400 ℃、流量为30 mL·min-1的高纯氢气氛围下处理2 h。
1.3 材料表征
利用X-射线粉末衍射(XRD,XD-3北京普析仪器有限责任公司)分析样品的物相组成和结构;对催化剂和载体的比表面性质进行物理吸附(BET,ASAP 2020美国Micromeritics公司)测试,了解材料的孔道结构;通过程序升温还原(H2-TPR,AutoChem 2920美国Micromeritics公司)、程序升温脱附(H2-TPD,AutoChem 2920美国Micromeritics公司)对催化剂苯加氢还原机理进行探究;通过透射电镜(TEMJEOL JSM-2010日本电子株式会社)对催化剂的微观形貌和结构进行分析;利用元素分析(Vario EL-3德国Elementar公司)了解不同合成方法合成的Ni/ZrO2的组成元素。
1.4 苯环催化加氢测试
探针反应为苯加氢生成环己烷。在反应前要对催化剂进行还原,催化剂的还原条件:所有催化剂在测试之前需在400 ℃、流量为30 mL·min-1的高纯氢气氛围下处理2 h。苯加氢制环己烷气相反应装置为固定床微型反应器,进样方式为脉冲式打针进样,产物通过天美GC-7900气相色谱进行分析,以高纯氢气为载气及反应气,流量值为30 mL·min-1。催化剂用量为100 mg,温度区间为70 ℃~200 ℃,环己烷进样量为1 μL,桥流:80 mA,汽化室温度为105 ℃,检测器温度为120 ℃,柱温:80 ℃。
2 结果与讨论
2.1 结构分析
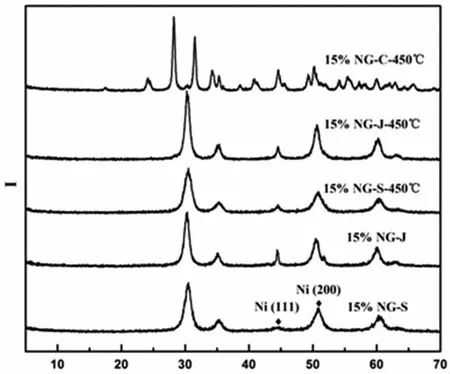
采用X射线衍射(XRD)对催化剂的物相结构进行分析,图1为5种制备方法所制催化剂在400 ℃、流量为30 mL·min-1的高纯氢气氛围下还原处理2 h后的X射线衍射图谱。如图所示,除使用浸渍法合成的单斜晶相Ni/ZrO2催化剂(15%NG-C-450℃)之外,其余4种方法所制催化剂的晶体结构和成份基本一致。经过高纯氢气还原后,所有催化剂中的Ni均以单质形式存在,出现Ni金属的Ni(200)晶面及(111)晶面的峰,而载体氧化锆的晶型基本保持不变。其中催化剂15%NG-S几乎没有Ni(200)峰的出现,而在5种催化剂中,相同测试条件下,催化剂15%NG-S的Ni(111)的半峰宽最宽,根据谢乐公式计算,其晶粒尺寸最小。由此可知,15%NG-S催化剂中Ni颗粒尺寸最小,这对提高加氢催化活性是非常有利的。
2θ/(°)
通过N2物理吸附测试来分析催化剂的孔道结构。如表1所示,5种催化剂中,15%NG-S具有最大的比表面积和孔体积,而孔径却最小,说明孔径均一。用浸渍法制备的15%NG-J催化剂比表面积和孔容急剧减小,可能是由于当Ni组分浸渍到载体中时,堵塞了载体的孔道所造成的。15%NG-S经过焙烧后得到的15%NG-S-450 ℃比表面积相对于前者急剧减小,孔径增大,可能是由于水热法合成的15%NG-S催化剂Ni与载体之间产生相互作用形成了新的结构,而经过焙烧后孔道结构被破坏。15%NG-J-450 ℃催化剂表面积最小而孔径最大,说明它的孔数目少。

表1 5种催化剂BET对比
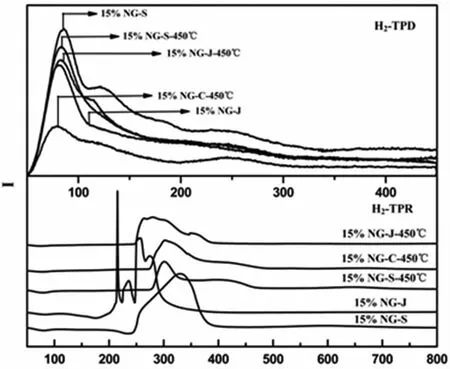
通过程序升温还原(H2-TPR)测试来考察5种催化剂在氢气下的还原状态,探究其反应机理。如图2所示,催化剂15%NG-S的还原谱图在340 ℃左右出现很强的还原峰,可以归属于Ni(OH)2的还原峰。而其余催化剂的还原峰相对较杂乱。在15%NG-J中,180 ℃~370 ℃出现许多杂乱的还原峰,可以解释为催化剂中Ni物种是以Ni(NO3)2的形式存在,在还原的过程中Ni(NO3)2发生分解造成。其余3个经过焙烧的催化剂在300 ℃左右都出现NiO的还原峰,15%NG-S-450 ℃和15%NG-J-450 ℃在400 ℃左右有拖尾峰可能是因为氧化镍与四方相氧化锆的相互作用造成的。而15%NG-C-450 ℃在380 ℃的峰可能是NiO与单斜相ZrO2之间的相互作用所致。
通过程序升温脱附(H2-TPD)测试来探究5种催化剂活性中心的作用机理。如图2所示,15%NG-S的TPD谱图表明该催化剂对氢气有3种吸附类型,即Ni在该复合催化剂中存在3种活性中心类型,分别为95 ℃左右的弱吸附、120 ℃左右中等吸附和250 ℃左右的强吸附,与其他几种催化剂的TPD谱图对比,他们在120 ℃左右基本没有脱附峰。
T/℃
通过电子显微技术,可以从微观的角度观察分析催化剂的结构和组成。如图3所示,15%NG-S催化剂颗粒尺寸相对小,催化剂分散均匀无团聚且颗粒轮廓清晰;采用浸渍法制备的15%NG-J的催化剂有明显的团聚现象,颗粒较大;而15%NG-C-450 ℃颗粒尺寸明显大得多,且高倍放大下观察,晶粒的晶格条纹几乎看不到。测量经氢气还原后的15%NG-S催化剂,晶格间距对应XRD标准谱图分析后发现,图中红色虚线圈出来的颗粒为ZrO2(011),而绿色标记的为Ni(111),这与15%NG-S的XRD谱图相符合。经测量,15%NG-S中颗粒尺寸大约为5 nm。

图3 (a1-a2)、(b1-b2)以及(c1-c2)分别对应15%NG-S、15%NG-J以及15%NG-C-450 ℃的TEM图
如表2所示,15%NG-S中几乎不含N元素,结合它的XRD谱图,推测其活性成分中,金属Ni不是以Ni(NO3)2的形式存在,而是以Ni(OH)2的形式存在。在15%NG-J催化剂中N元素含量较高,结合它的XRD谱图,可以得出Ni是以Ni(NO3)2的形式存在,这两种催化剂中检测到C、H元素的存在,可以解释为在合成载体四方相ZrO2时加入了丙三醇。而其余3种焙烧过的催化剂,均几乎不含这3种元素,那是因为Ni在焙烧过程中被氧化成了NiO,N、C、H元素经高温焙烧后已被烧失。

表2 C、H、N元素分析
2.2 催化性能测试
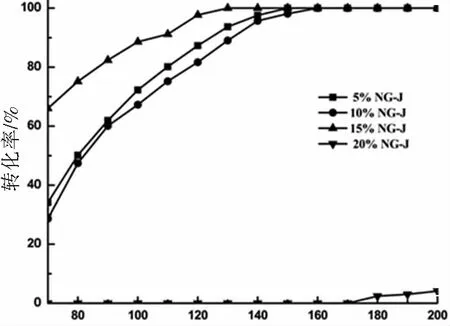
为探究Ni的负载量对催化剂催化加氢性能的影响,对4种负载量的NG-S分别进行苯加氢催化实验。如图4所示,结果表明,15%负载量的NG-S的催化性能最佳,苯在110 ℃左右已经完全转化为环己烷,且在80 ℃以下也有较高的转化率。而5%负载量的NG-S催化性能最差,在200 ℃还不能达到完全转化。因此说明Ni是该复合型催化剂的主要活性中心,在一定条件下,随着Ni含量的升高,催化剂的催化性能越好,但当负载量达到20%以上时,催化剂的活性出现下降的趋势,可能是因为Ni在高含量时出现团聚,分散性降低,导致催化性能开始下降。

T/℃
接着我们对使用浸渍法制备的NG-J催化剂进行不同Ni负载量的催化性能测试。如图5所示,在5%NG-J、10%NG-J、15%NG-J、20%NG-J中4种负载量中,15%NG-J对苯催化加氢的活性依然是最佳,而负载量达到20%Ni时,催化剂几乎无活性,可能是由于浸渍法制备的催化剂在载量大时活性组分发生团聚更加严重,导致催化剂的活性中心无法与反应物充分接触,导致催化性能急剧下降。因此,我们认为当Ni载量为15%时,对苯催化加氢反应的催化性能最佳。
T/℃
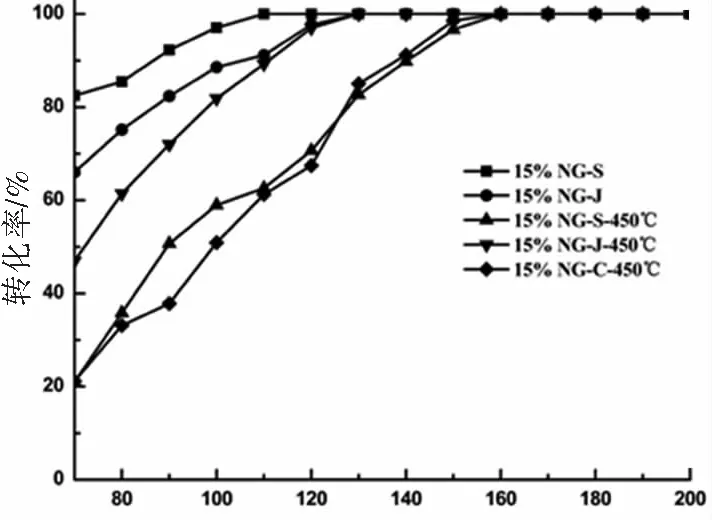
根据上述实验得出的结论,我们选取Ni负载量都是15%的5种催化剂进行苯加氢的催化对比实验。如图6所示,在Ni负载量相同时,用水热法合成的15%NG-S活性最佳,而用水热法合成后经过450 ℃焙烧的15%NG-S-450 ℃和单斜晶相的15%NG-C-450 ℃的催化剂催化活性最差,而四方相ZrO2作为催化剂载体在该反应中普遍表现出较好的催化性能。由此可以看出,在使用ZrO2作为催化剂的载体时,不同的晶相结构对复合催化剂的催化性能有着一定的影响。经过焙烧之后,所有催化剂的催化活性都有不同程度的下降,根据对催化剂焙烧前后的XRD和元素分析等表征分析,可能是因为该类复合型催化剂在焙烧后催化剂的内部结构被破坏,导致催化剂活性中心被部分破坏,催化活性出现下降的趋势。
T/℃
3 结论
通过不同合成方法成功合成了5种Ni/ZrO2复合型催化剂,催化剂尺寸在5 nm左右,并利用苯催化加氢实验验证其催化性能。其中水热法一过合成的Ni/ZrO2催化剂展示出最好的催化性能,15%负载量Ni/ZrO2催化剂在120 ℃左右即可完全将苯催化加氢得到环己烷。进一步研究显示ZrO2在作为载体时,四方晶相ZrO2由于分散性好,活性中心与反应物接触更加充分,催化性能明显高于单斜晶相ZrO2的催化剂。经过焙烧后,对该类Ni/ZrO2负载型催化剂的催化活性并无改善,反而由于高温下催化剂结构的破坏和团聚,导致催化性能急剧下降。Ni负载量在超过20%时,该催化剂对苯加氢反应的催化活性也出现下降的趋势。
