髓样锌指蛋白1 在卵巢癌中的表达及其与预后的关系
2021-10-13陈瑞芳岳荟然李文质
陈瑞芳 岳荟然 李文质 鹿 欣 李 俊
(复旦大学附属妇产科医院妇科 上海 200011)
卵巢癌是妇科致死性最高的恶性肿瘤,多数患者就诊时已处于发生侵袭转移的晚期阶段。经过初始的瘤体减灭术联合铂类为基础的化疗,大多数得到临床缓解的患者仍面临着较高的复发和死亡风险,其5 年生存率始终徘徊在20%~30%。尽管化疗方案在不断更新和改进,但是患者生存预后的改善却十分有限[1]。因此,寻找新的卵巢癌预后标记物,从分子水平阐明影响卵巢癌患者预后的机制,进而开发新的靶向治疗药物以提高卵巢癌患者的预后显得尤为重要。
髓样锌指蛋白 1(myeloid zinc finger 1,MZF1)属于扫描锌指蛋白(scan-zinc finger,SCAN-ZF)家族。MZF1 最初被发现是参与造血发育过程的转录因子[2],可以调节造血细胞的分化和增殖[3],上调MZF1 的表达可诱发白血病。近年来,越来越多的研究证实MZF1 参与了肿瘤恶性进展的多个过程,包括侵袭转移、化疗耐药、炎症反应等,其异常表达与多种实体恶性肿瘤的发生密切相关,如神经母细胞瘤[4]、胶质瘤[5]、胃癌[6]、乳腺癌[7]和前列腺癌[8]等。但是,MZF1 在卵巢癌中的表达及其与卵巢癌患者预后的关系尚不清楚。
本研究利用基因表达数据库(gene expression ominus,GEO)和癌症基因组数据库(The Cancer Genome Altas,TCGA),分析MZF1 在正常输卵管上皮、低度恶性潜能的卵巢肿瘤(卵巢交界性肿瘤)和卵巢癌中的表达差异,并探讨其表达高低与卵巢癌预后的关系。同时,采用基因富集分析(gene set enrichment analysis,GSEA),探究 MZF1 高表达和 MZF1 低表达的卵巢癌患者相关信号通路的差异。旨在探索MZF1是否可以作为预测卵巢癌预后的标记物。
资料和方法
差异表达分析GSE10971 数据集用于分析输卵管上皮和卵巢癌组织中MZF1 的表达差异;GSE12172 数据集用于分析低度恶性潜能卵巢肿瘤(卵巢交界性肿瘤)和卵巢癌组织中MZF1 的表达差异 ;GSE10971 和 GSE12172 数 据 均 可 在 Pubmed 的GEO 数据库公开免费获取。
生存分析Kaplan Meier Plotter(http://kmplot.com/analysis/)包含了1 656例卵巢癌患者的生存数据。我们利用Kaplan Meier Plotter 数据库分析了MZF1 表达高低与卵巢癌无进展生存期(progression free survival,PFS)和总生存期(overall survival,OS)的关系。Kaplan-Meier Plotter 数据库可免费公开获取。
MZF1 相关信号通路分析我们选取了GSE26712 数据集中达到满意瘤体减灭术的卵巢癌患者的芯片数据,并根据MZF1 的表达值,分别选取了MZF1 表达最低的10 例样本和MZF1 表达最高的10 例样本,采用GSEA 分析了MZF1 相关的潜在信号通路。
统计学分析差异表达分析采用两独立样本t检验,生存分析采用 Kaplan-Meier 分析,P<0.05 为差异有统计学意义。GSEA 分析中FDR-q<0.05 为差异有统计学意义。
结 果
MZF1 在输卵管上皮和卵巢癌中的表达差异既往文献已经证实,卵巢癌起源于恶变的输卵管上皮。所以,我们首先对比了MZF1 在输卵管上皮和卵巢癌中的表达差异。GSE10971 数据集包含了24例输卵管上皮和13 例卵巢癌的基因表达数据。我们提取MZF1 的表达值分析发现,MZF1 在卵巢癌中的表达明显低于输卵管上皮(图1)。
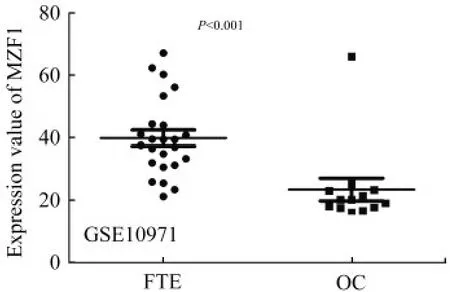
图1 MZF1 在输卵管上皮和卵巢癌中的表达差异Fig 1 The differential expression of MZF1 between fallopian tubes epithelium and ovarian cancer tissues
MZF1 在低度恶性潜能的卵巢交界性肿瘤和卵巢癌中的表达差异我们对比了MZF1 在低度恶性潜能的卵巢交界性肿瘤和卵巢癌中的表达差异。GSE12172 数据集包含了30 例低度恶性潜能的卵巢交界性肿瘤和60 例卵巢癌的基因表达数据。我们提取了MZF1 的表达值分析发现,MZF1 在卵巢癌中的表达明显低于卵巢交界性肿瘤中的表达(图2)。

图2 MZF1 在低度恶性潜能的卵巢交界性肿瘤和卵巢癌中的表达差异Fig 2 The differential expression of MZF1 between borderline ovarian tumors(BOT)and ovarian cancer tissues
MZF1 表达与卵巢癌预后的关系我们分析了MZF1 表达与卵巢癌无进展生存期及总生存期的关系。Kaplan-Meier Plotter 数据库收集了GEO 数据库和TCGA 数据中1 000 多例卵巢癌组织的芯片表达数据和临床预后数据。由于卵巢癌患者术后残留病灶大小与卵巢癌的预后密切相关,所以我们将上述数据库的病例分成了两组:达到满意瘤体减灭术组(残留病灶小于等于1 cm)和未达到满意瘤体减灭术组(残留病灶大于1 cm)。我们发现:在达到满意瘤体减灭术的卵巢癌患者中,MZF1 高表达患者其 PFS(图 3A,HR=0.80;95%CI:0.66-0.97;P=0.020;n=696)和 OS(图3B,HR=0.71;95%CI:0.57-0.88;P<0.01;n=801)均明显高于 MZF1 低表达患者;在未达到满意瘤体减灭术的卵巢癌患者中,MZF1 表达高低与卵巢癌患者的PFS(图3C,HR=1.16;95%CI:0.93-1.47;P=0.190;n=459)和 OS(图3D,HR=0.81;95%CI:0.65-1.01;P=0.064;n=536)无明显相关性。

图3 MZF1 表达高低与卵巢癌患者PFS 和OS 的关系Fig 3 The association of MZF1 expression with the survival of patients with ovarian cancer
MZF1 相关信号通路分析由于在达到满意瘤体减灭术的卵巢癌患者中,MZF1 高表达的卵巢癌患者其OS 明显高于MZF1 低表达的卵巢癌患者。因此,我们进一步用GSEA 分析了在达到满意瘤体减灭术的卵巢癌患者中,MZF1 低表达和MZF1 高表达卵巢癌组织中基因富集的差异,以便找到MZF1 相关的信号通路。我们提取了GSE26712 数据库中达到满意瘤体减灭术的卵巢癌患者的芯片数据,并根据MZF1 的表达值,分别选取了MZF1 表达最低的10 例样本和MZF1 表达最高的10 例样本进行GSEA 富集分析。结果提示,MZF1 低表达组和MZF1 高表达组基因富集呈显著差异。在MZF1低表达的患者中,炎症反应相关基因(图4A,FDR-q<0.01) 、上 皮 间 充 质 转 化 (epithelial-tomesenchymal transition,EMT)相关基因(图 4B,FDR-q<0.01)、血管生成相关基因(图4C,FDR-q<0.05)和脂肪形成相关基因(图4D,FDR-q<0.05)均显著富集。
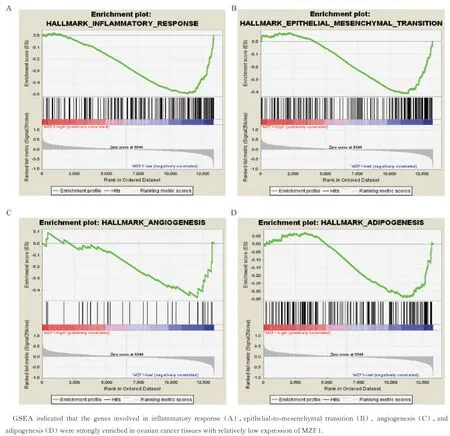
图4 GSEA 分析MZF1 低表达和MZF1 高表达的卵巢癌组织间基因富集差异Fig 4 GSEA between tumors with high MZF1 expression and tumors with low MZF1 expression
讨 论
本研究利用GEO 数据库和TCGA 数据库,并结合 GSEA 分析发现:(1)MZF1 在卵巢癌中的表达明显低于正常输卵管上皮和卵巢交界性肿瘤中的表达;(2)在达到满意瘤体减灭术的卵巢癌患者中,MZF1 高表 达的卵 巢癌患 者 PFS 和 OS 长;(3)在MZF1 低表达的患者中,炎症反应相关基因、EMT相关基因、血管生成相关基因和脂肪形成相关基因均显著富集。
既往研究证实,MZF1 参与了肿瘤的侵袭转移、增殖、耐药等多个过程,其异常表达与多种肿瘤的发生发展及其预后密切相关[9]。但是,MZF1 在不同肿瘤中的作用并不一致,MZF1 既可以作为抑癌基因,也可以作为促癌基因。在T 细胞淋巴瘤中,MZF1 在肿瘤细胞株和原发肿瘤组织中的表达明显低于正常对照T 淋巴细胞中的表达[10]。过表达MZF1 能显著抑制T 细胞淋巴瘤的增殖、迁移和克隆形成能力。在前列腺癌中的研究结果与上述结果一致,抑制MZF1 的表达能显著促进肿瘤细胞的增殖[11]。而在结直肠癌中,MZF1 则发挥相反的作用。过表达MZF1 能明显增强结肠癌细胞的浸润和迁移能力[12]。在乳腺癌中,MZF1 则可以通过调节肿瘤微环境,促进乳腺癌的增殖和侵袭转移[13]。即使在同一肿瘤中,MZF1 既可以发挥抑癌基因的作用,也可以发挥促癌基因的作用。如在宫颈癌SiHa细胞中,过表达MZF1 能显著抑制其浸润和迁移能力[14]。而在宫颈癌HeLa 细胞中,其作用则完全相反[12]。在胃癌中,观察到了与宫颈癌类似的结果,即MZF1 既可以作为促癌基因,也可以作为抑癌基因发挥作用[15-16]。引起上述结果差异的原因可能与不同肿瘤间的异质性以及同一肿瘤内的异质性有关。我们的研究证实MZF1 在卵巢癌组织中呈低表达,高表达MZF1 的卵巢癌患者预后好,提示其可能在卵巢癌中发挥抑癌基因的作用,并可能成为预测卵巢癌患者预后的潜在分子标记物。
在上述研究基础上,我们还探索了与MZF1 表达相关的潜在信号通路。发现MZF1 低表达的卵巢癌患者中,炎症反应相关基因、EMT 相关基因、血管生成相关基因和脂肪形成相关基因均显著富集。而既往文献已经证实,卵巢癌的发生发展与炎症[17]、EMT[18]、血管生成[19]及脂肪代谢[20]均密切相关。Zhang 等[17]发现 UCHL3 通过稳定 TRAF2,激活NF-kB 信号通路及炎症反应,进而促进卵巢癌的恶性进展。Taki 等[18]发现 Snail 通过促进 CXCR2 表达,促进卵巢癌细胞发生EMT,进而促进卵巢癌的恶性进展。Chen 等[19]研究证实,miR-204-5p 通过调节THBS1 的表达,促进卵巢癌的血管生成;动物实验进一步表明抑制miR-204-5p 的表达,能显著抑制卵巢癌的生长。Mukherjee 等[20]发现脂代谢相关蛋白FABP4 通过影响DNA 中5-羟甲基胞嘧啶的水平,上调侵袭转移和细胞生长相关基因,促进卵巢癌的侵袭转移和对铂类药物的耐药,进而影响卵巢癌的预后。既往研究也表明,MZF1 参与了炎症反应[6]、EMT[21]和血管生成[15]的调控过程。在胃癌中,MZF1 与 MT2A 相互形成复合体,调控NFKBIA 的表达,进而影响NF-kB 信号通路,提示MZF1 可能参与炎症反应[6]。Ko 等[21]发现,MZF1可以上调EMT 相关基因N-cadherin 的表达,促进肿瘤细胞发生EMT,进而影响患者预后。研究发现[15]在胃癌中发现,miR-337-3p 下调 MZF1 的表达,抑制血管生成,进而抑制胃癌的恶性进展。MZF1是否也可以通过影响上述通路调控卵巢癌的恶性进展,有待分子生物学实验进一步证实。
本研究证实MZF1 是预测卵巢癌预后的一个潜在分子标记物。未来可在细胞水平和动物实验中进一步探索MZF1 的卵巢癌发生发展中的功能和潜在分子机制。
作者贡献声明陈瑞芳,李俊 数据采集和分析,论文构思、撰写和修订。岳荟然,李文质 数据采集和分析。鹿欣 统计分析。
利益冲突声明所有作者均声明不存在利益冲突。
