钛系锂离子筛的制备及其吸附性能研究
2021-10-12潘巧珍杨伟伟朱贤荣陈琳琳朱文帅
陈 旺,蒋 磊,潘巧珍,杨伟伟,朱贤荣,陈琳琳,朱文帅
(1.江苏特丰新材料科技有限公司,江苏镇江212013;2.江苏大学化学化工学院)
近年来,由于化石燃料的消耗和自然环境的污染,新能源引起了世界各国的关注。锂是一种新型能源金属,广泛应用于锂电池、陶瓷、核能、航空航天等领域[1]。随着锂离子电池行业的快速发展,各行业对锂的需求不断增加。锂资源主要有两种自然形态:锂矿石和盐湖卤水。目前,全球约60%的锂资源储存在盐湖卤水中[2]。由于锂矿石开采成本高,能耗高且资源短缺,因而盐湖卤水的开发已成为研究热点。中国也有丰富的液态锂资源,主要集中在青海和西藏地区,但是中国盐湖卤水中锂的含量普遍较低,且盐湖卤水中镁锂比[n(Mg)/n(Li)]较高。由于Li和Mg位于元素周期表的对角线上,它们有许多相似的物理性质和化学性质,因此,从高镁锂比盐湖卤水中提取锂是一个重大挑战。目前,从盐湖卤水中提锂的方法有吸附法[3-5]、萃取法[6-7]、煅烧法[8]、沉淀法[9]等。其中,吸附法被认为是从高镁锂比盐湖卤水中回收锂的最强有力的技术之一。与其他方法相比,吸附法具有工艺简单、能耗低、效率高、选择性好等优点,具有广阔的应用前景。吸附法回收锂的关键核心是吸附剂。离子交换树脂作为一种常见的有机吸附剂,价格便宜且吸附过程稳定,但其对锂的吸附选择性差,工业上的应用前景比较暗淡[10]。近年来,无机吸附剂由于其成本低、稳定性好及特殊的离子交换特性,受到了广泛的关注。铝基吸附剂成本低、选择性和循环性能较好,但其吸附容量较低[11]。锰系锂离子筛吸附容量高,但溶损严重且稳定性较差[12]。钛系锂离子筛因吸附性能好、成本低、选择性好等优点[12-13]而受到青睐。本文以无定型水合二氧化钛和氢氧化锂分别作为钛源和锂源,通过高温固相法合成钛系锂离子筛用于高镁锂比盐湖卤水中锂的吸附。对材料进行SEM、XRD、接触角测试等表征,并对HTO的吸附性能、选择性和循环性能进行了探讨。
1 实验部分
1.1 实验试剂和仪器
试剂:偏钛酸(TiO2质量分数为43.5%)、浓硫酸、十二烷基磺酸钠、氨水、氢氧化锂、盐酸均为分析纯。
仪器:VISTA-MPX型电感耦合等离子体发射光谱仪(ICP)、TD-3500型X射线衍射仪、Thermofisher Apreo型扫描电子显微镜、KSW CM200光学接触角仪、JW-BK200C型比表面及孔径分析仪等。
1.2 无定型水合二氧化钛的制备
将200 g偏钛酸加入到450 mL浓硫酸中(H2SO4质量分数为95%~98%),搅拌升温至120℃,直至偏钛酸完全溶解。冷却至室温,加入300 mL蒸馏水得到硫酸氧钛溶液。随后加入0.44 g十二烷基磺酸钠并搅拌升温至50℃,缓慢滴加氨水控制pH=3~4,熟化1 h后过滤水洗,得到无定型水合二氧化钛。
1.3 HTO的制备
无定型水合二氧化钛与氢氧化锂溶液(LiOH质量分数为10%)按n(Ti4+)∶n(Li+)=1∶2混合,喷雾干燥后在马弗炉中升温至750℃,保温2 h后冷却至常温得到前驱体Li2TiO3(LTO)。将浓度为6 mol/L的盐酸缓慢滴入装有LTO和水的锥形瓶中,持续震荡,维持溶液稳定在pH=1.5,过滤、水洗得到离子筛H2TiO3(HTO)。并用ICP测量溶液中钛的浓度,计算钛的溶损率。
钛溶损率R(%)计算公式如下:
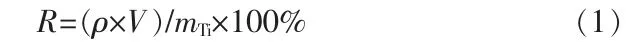
式中:ρ为酸洗后溶液中钛离子的质量浓度,mg/L;V为溶液的体积,L;mTi为吸附剂中钛元素的质量,g。
1.4 吸附实验
将2 g HTO加入装有500 mL且pH=5.8的青海某盐湖卤水的锥形瓶中,其中盐湖卤水中各离子的质量浓度分别为:ρ(Li+)=0.3 g/L、ρ(Na+)=3.3 g/L、ρ(K+)=2.0 g/L、ρ(Ca2+)=0.03 g/L、ρ(Mg2+)=112.2 g/L。放入恒温水浴振荡器中持续振荡,在不同的时间点取样,用ICP测量溶液中各种金属离子的浓度。
吸附容量qt(mg/g)计算公式如下:

式中:ρ0为溶液中金属离子的初始质量浓度,mg/L;ρt为不同时间溶液中金属离子的质量浓度,mg/L;m为吸附剂的质量,g。
1.5 分配系数和分离系数
HTO对盐湖卤水中各种金属离子的选择性由分配系数Kd和分离系数表示,计算公式如下:

式中,ρe为溶液平衡后Li+的质量浓度,mg/L。
1.6 循环实验
将2 g HTO加入含有500 mL卤水的锥形瓶中,放于恒温水域振荡器中持续震荡26 h,用ICP测其锂离子的浓度。过滤得到吸附后的锂离子筛(L)TO。将浓度为6 mol/L的盐酸缓慢滴入装有LTO和水的锥形瓶中,持续震荡,维持溶液稳定在pH=1.5,过滤、水洗,得到HTO。重复以上的操作进行循环实验。
2 结果与讨论
2.1 晶体结构分析
图1 为LTO、HTO和(L)TO的XRD衍射谱图。由图1可见,LTO衍射谱图在18.7、20.4、36.2、43.8、47.9、57.8、63.7、67.0°处 的 特 征 峰 分 别 属 于(002)、(110)、(-131)、(-133)、(-204)、(006)、(-206)、(062)衍射晶面,这与标准卡片(JCPDS 33-0831)基本一致,属于单斜晶相[14]。此外,样品峰高且半峰宽较窄,表明样品结晶度高。盐酸酸洗后,HTO的晶体结构基本保持不变,然而(-131)和(-204)的衍射峰变宽,(-131)的衍射峰向大角度偏移,说明Ti-O层间Li和H的成键方式不同[3]。晶胞发生一定程度的收缩,可能是半径较大的Li+和半径较小的H+交换导致[3,15]。此外,酸洗后(-133)、(006)、(062)衍射峰消失,表明从LTO中洗脱出Li+[4]。LTO和HTO峰形极为相近,没有明显的变化,表明吸附前后锂离子筛的结构比较稳定。
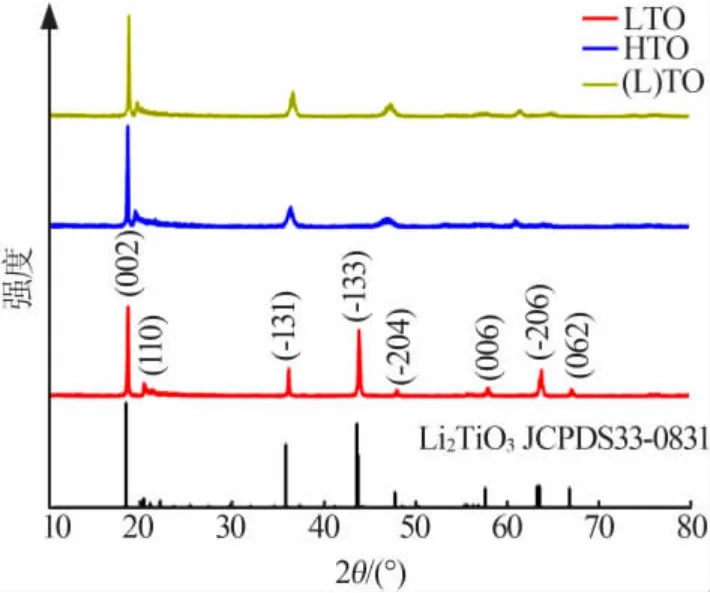
图1 LTO、HTO和(L)TO的XRD图Fig.1 XRD patterns of LTO、HTO and(L)TO
2.2 BET比表面积测试
对LTO和HTO进行BET比表面积测试。LTO和HTO的比表面积分别为3.40 m2/g和14.25 m2/g。结果表明,HTO具有更大的比表面积,这可能是因为在N2吸附过程中对酸性吸附位点有选择性[16]。
2.3 接触角测试
对HTO的润湿性进行探究,结果如图2所示。由图2可知,当去离子水滴在HTO表面时,HTO的接触角为61°,表明HTO具有良好的亲水性。锂通常以水合离子的形式存在于水溶液中,由于HTO的亲水性,HTO能与卤水中的Li+充分接触,从而实现Li+与H+的高效交换[3]。

图2 水滴在HTO表面的接触角Fig.2 Contact angle of water droplets on HTO surface
2.4 形貌表征
LTO、HTO和(L)TO的SEM图见图3。如图3所示,LTO、HTO和(L)TO的形貌均为多面体结构。酸洗和吸附后,微观结构基本不变。随着钛的溶损,只有颗粒表面粗糙和结构疏松等微小的变化。此外,HTO的粒径相比于LTO有所减小,这可能是因为Li+和H+的交换所导致[17]。结果表明盐酸作为洗脱剂对晶体骨架结构的影响较小,有利于HTO循环使用。

图3 LTO(a)、HTO(b)和(L)TO(c)的SEM照片Fig.3 SEM images of LTO(a)、HTO(b)and(L)TO(c)
2.5 HTO的吸附性能
研究了HTO在卤水中吸附锂的能力与吸附时间的关系,结果如图4所示。由图4可知,HTO的吸附容量在前8 h急剧增加,达到21.5 mg/g,继续延长吸附时间,吸附速率降低,吸附容量缓慢增加,到26 h后吸附容量达到24.8 mg/g,趋于平衡。
此外,“拟一级动力学模型”和“拟二级动力学模型”是两种典型的吸附动力学模型,主要用于研究吸附剂的吸附机理和吸附速率[4]。其中,拟一级动力学模型:
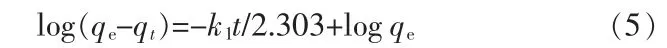
拟二级动力学模型:

在这两种动力学模型公式中,qe(mg/g)是HTO吸附平衡时的吸附容量,k1(h-1)和k2[g/(mg·h)]分别是两种模型的吸附速率常数。用上述两种模型方程对图4数据进行线性拟合,结果如图5和表1所示。结果表明,拟二阶动力学模型的R2(0.991 4)高于拟一阶动力学模型的R2(0.953 8),因此拟二阶动力学模型更能用来表达HTO的锂吸附过程。根据拟二阶动力学方程计算得到的平衡吸附容量为28.6 mg/g,与图4中的实验结果更接近,进一步证明了吸附过程以化学吸附为主。
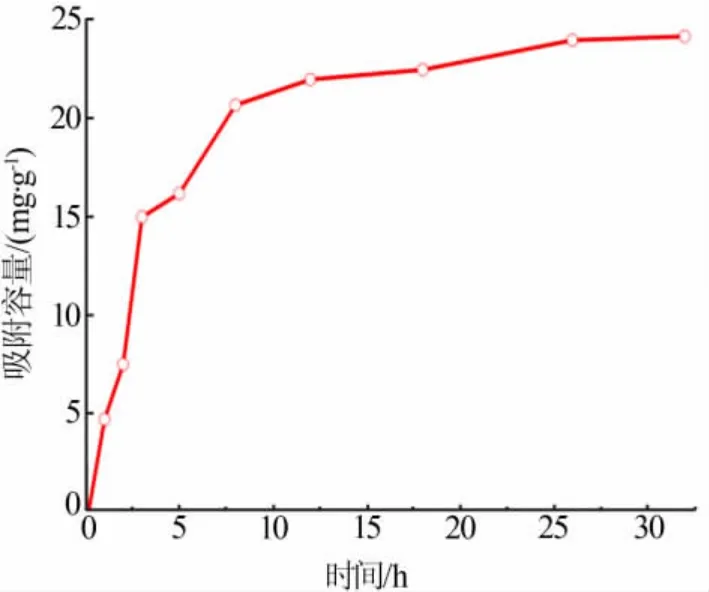
图4 时间对HTO吸附容量的影响Fig.4 Effect of time on HTO adsorption capacity
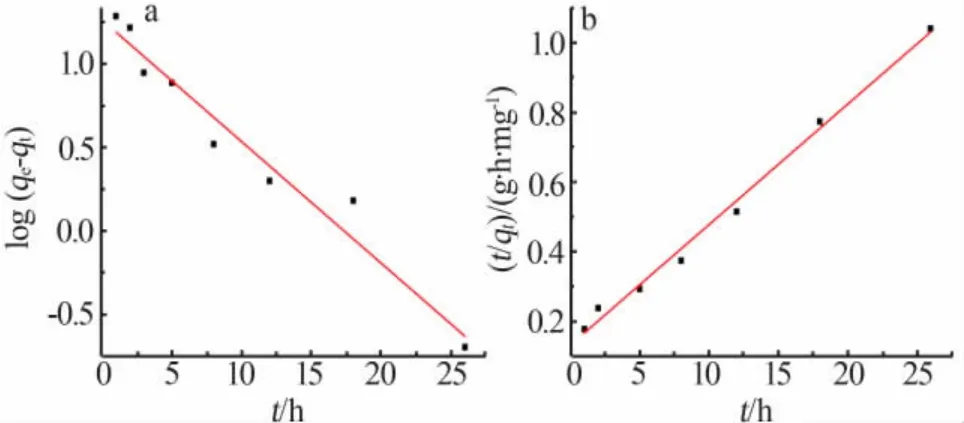
图5 拟一级动力学曲线(a)和拟二级动力学曲线(b)Fig.5 Quasi-first-order kinetic curve(a)and Quasisecond-order kinetic curve(b)

表1 动力学参数Table 1 Dynamic parameters
2.6 HTO选择性和循环性能
通过钛的溶损率来评价LTO的耐酸程度。如图6所示,随着用于洗脱的盐酸浓度增加,钛溶损率也在不断提高,当盐酸浓度达到0.5 mol/L时,钛的溶损率仅为1.64%。结果表明,LTO有着优异的耐酸度。
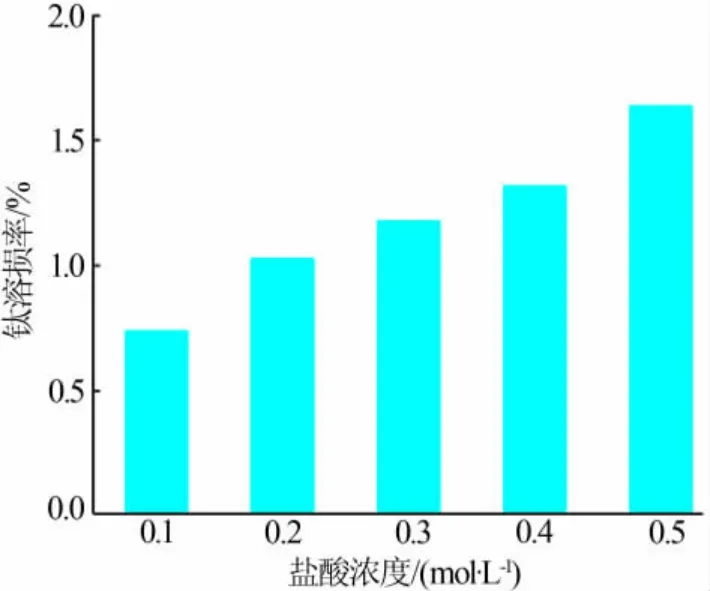
图6 LTO的耐酸程度Fig.6 Acid resistance of LTO
HTO从卤水中提取锂的过程中,共存金属离子可能对锂的吸附性能有所影响(见图7a),因此研究HTO的选择性是十分必要的。从图7a可以看出,HTO对Li+的吸附容量达到24.8 mg/g,远远高于对Na+、K+、Mg2+和Ca2+的吸附容量。卤水中Na+、K+、Mg2+和Ca2+的分离系数如表2所示,结果进一步表明了HTO的优异的选择性。由于钛系锂离子筛的记忆效应[3,18],结构中的空腔只能容纳半径匹配的离子。因此,与Li+(76 pm,离子半径,下同)相近的Mg2+(72 pm)占据了少量Li+空位,而Ca2+(100 pm)、Na+(102 pm)和K+(138 pm)的离子半径较大,这使得Mg2+的吸附容量高于Ca2+、Na+和K+。以上研究表明,虽然Na+、K+和Ca2+也会少量吸附在HTO表面,但HTO对Li+仍然具有良好的吸附选择性。
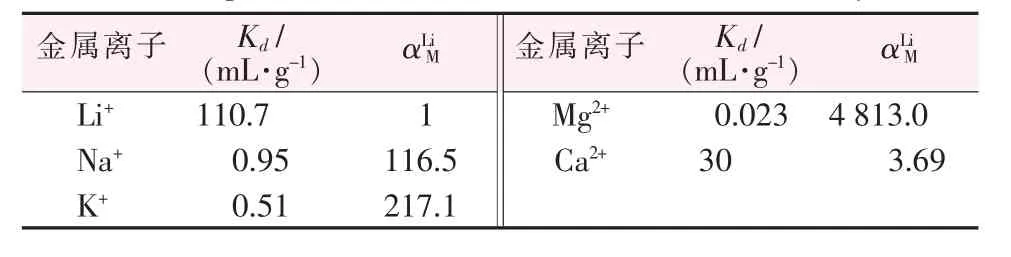
表2 HTO对各种金属离子的分离系数Table 2 Separation coefficients of various metal ions by HTO
对(L)TO进行酸洗脱再生循环吸附研究(见图7b)。从图7b可以看出,经过20次吸附-脱附循环实验,HTO对锂的吸附容量从24.8 mg/g下降到23.6 mg/g,仅降低了4.8%,而且每次循环洗脱时,钛的溶损率都在0.08%以下,这表明HTO具有优异的循环性能和稳定性。HTO也能适用于不同pH的卤水,结果见图8。随着pH的增加,吸附容量先快速提高然后缓慢增加。当卤水pH在5.2~7.4时,锂的吸附容量超过20 mg/g。此外,不同吸附剂的吸附性能比较见表3,HTO的吸附容量大于铝基吸附剂(5 mg/g,吸附容量,下同)和D751树脂(22.1 mg/g),小于锰系吸附剂SMO(43.1 mg/g)。SMO虽然有着更高的吸附容量,但是锰的溶损率接近5%,远远超过HTO的钛溶损率,不利于吸附剂的循环使用。结果表明,HTO作为吸附剂有着较高的吸附容量和稳定性,有着极大的工业化潜力和商业前景。
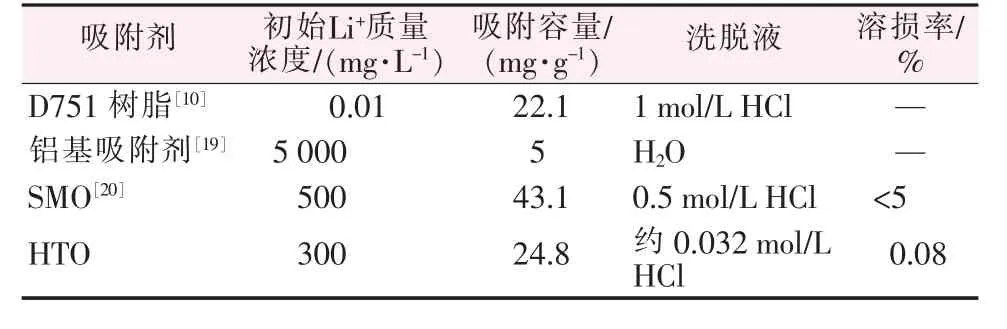
表3 不同吸附剂的吸附性能比较Table 3 Comparison of adsorption properties of different adsorbents
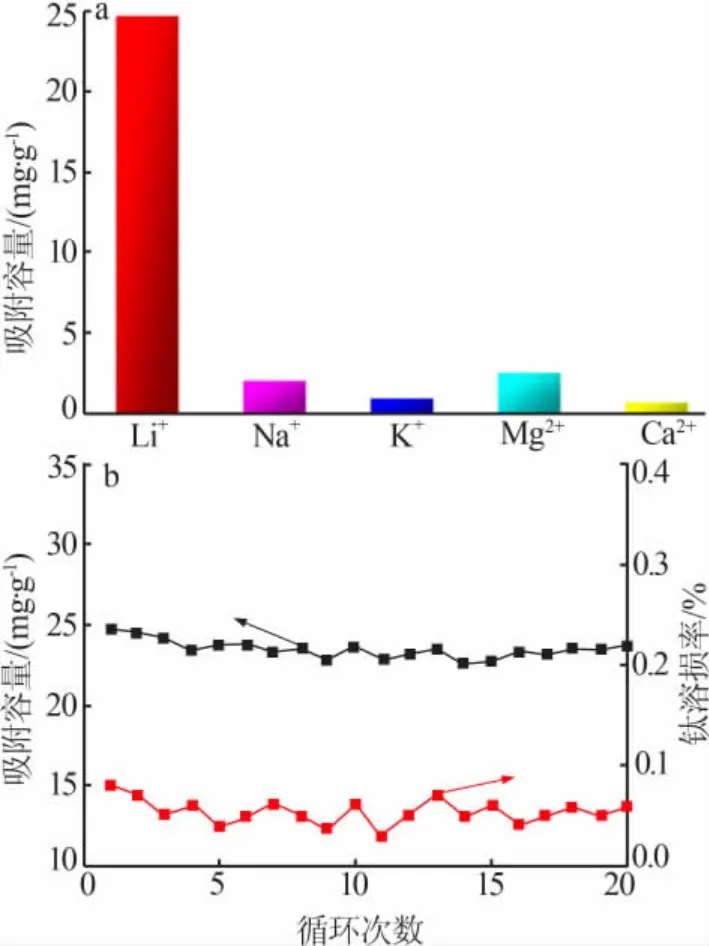
图7 HTO的吸附选择性(a)和循环性能(b)Fig.7 Adsorption selectivity(a)and cycle performance of HTO(b)
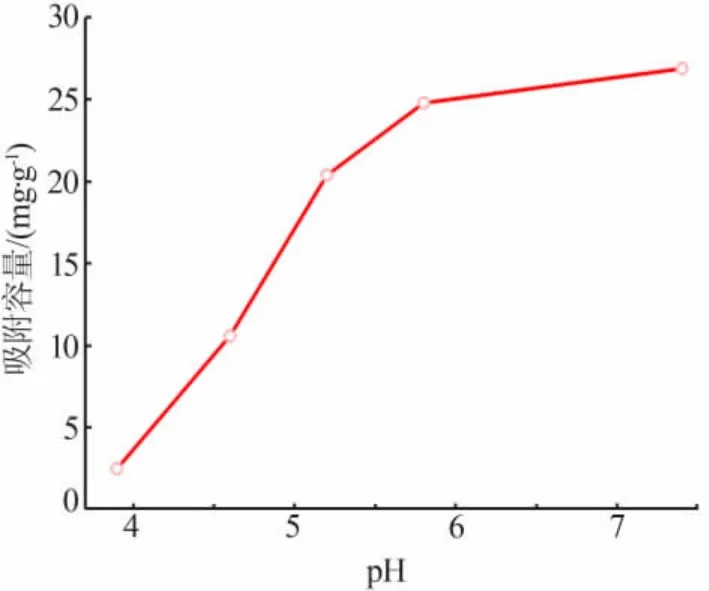
图8 pH对HTO吸附容量的影响Fig.8 Effect of pH on adsorption capacity of HTO
3 总结
通过高温固相法合成钛系锂离子筛,并对材料进行SEM、XRD和接触角测试等一系列表征。采用锂离子筛吸附工艺,对高镁锂比盐湖卤水中锂和各种杂质金属离子进行分离。研究表明,HTO对高镁锂比盐湖卤水具有高的吸附容量(24.8 mg/g)和优异的选择性能(αLiMg=4 813.0),这可能是因为钛系锂离子筛具有记忆效应,结构中的空腔只能容纳离子半径与其匹配的离子。经过20次循环实验,吸附容量仅降低4.8%,仍然能够达到23.6 mg/g,此外,钛的溶损率每次都在0.08%以下,表明HTO具有极好的循环性能和稳定性。
