高效液相色谱法同时测定饮料中的苯甲酸、山梨酸、脱氢乙酸和糖精钠
2021-10-12冯俊富朱飞如余开科骆海春
◎ 冯俊富,朱飞如,余开科,骆海春
(北海市食品药品检验所,广西 北海 536000)
根据我国食品卫生法(1995年)的规定,食品添加剂是为改善食品色、香、味等品质,以及为防腐和加工工艺的需要而添加到食品中的人工合成或天然物质。目前我国食品添加剂有23个类别,2 000多个品种,包括酸度调节剂、抗氧化剂、漂白剂、膨松剂、着色剂、护色剂、增味剂、营养强化剂、防腐剂、甜味剂和增稠剂等[1]。其中防腐剂和甜味剂在目前食品加工过程中应用广泛[2]。
随着时代的发展,饮料行业是我国发展最快的行业之一,饮料数量和品种不断增加,食品添加剂对推动饮料市场发展起着重要作用[3]。为抑制微生物的生长、延长饮料的货架期,苯甲酸、山梨酸、脱氢乙酸常作为防腐剂添加在饮料中[4]。糖精钠是食品工业中常用的合成甜味剂,糖精钠的甜度比蔗糖甜300~500倍,且提供的热量较低,亦受到人们的青睐[5]。甜味剂和防腐剂多以苯、甲苯、萘等化工产品为原料,经有机反应化合而成,其本身不能向人体提供营养物质,大多具有一定的毒性,甚至在人体内可能转换成致癌物质。在其生产过程中还有可能混入砷、铅等重金属[6]。《食品安全国家标准 食品添加剂使用标准》(GB 2760—2014)对食品添加剂使用含量以及范围均有严格限制[7]。近年来,随着食品工业快速发展,食品质量问题越来越突出,尤其是在食品加工中,超量或违规使用添加剂现象屡禁不止[8]。随着饮料品种和添加剂种类的日益增多,存在食品添加剂滥用的趋势,对人体健康造成一定的风险。为保障食品安全,需要对饮料中食品添加剂的含量进行检测。目前参照的标准包括《食品安全国家标准 食品中苯甲酸、山梨酸和糖精钠的测定》(GB/T 5009.28—2016)[9]、《食品安全国家标准 食品中脱氢乙酸的测定》(GB 5009.121—2016)[10]。近年来,有关食品添加剂的检测方法研究报道层出不穷,在检测灵敏度和准确度方面有所提高。敬小丽等[11]建立饮料中苯甲酸、山梨酸钾2种防腐剂同时检测的高效液相色谱法,牟霄等[12]采用超高效液相色谱法同时测定饮料中14种食品添加剂,张剑峰等[13]采用超高效液相色谱法同时测定饮料中的山梨酸、苯甲酸、脱氢乙酸、糖精钠和安赛蜜。
目前国家标准中对食品中苯甲酸、山梨酸、脱氢乙酸和糖精钠的检测方法较多,本研究对高效液相色谱法测定苯甲酸、山梨酸、脱氢乙酸和糖精钠的检测波长、流动相种类及pH等检测条件进行摸索研究,以便为4种添加剂的同时检测提供更简便易行的方法。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器
Agilent 1260高效液相色谱仪,配有二极管阵列检测器(美国安捷伦科技有限公司);XA205DU电子天平[MAX 81 g/220 g,d=0.01 mg/0.1 mg,梅特勒-托利多仪器(上海)有限公司]。
1.1.2 试剂与样品
甲醇(色谱纯,美国Merck公司);乙酸铵(优级纯,天津市光复科技发展有限公司);水中苯甲酸、山梨酸、糖精钠标准溶液(A2007199,1 000 μg·mL-1,北京坛墨质检科技有限公司);脱氢乙酸(C0008887,99.9%,BePure)。
20批不同厂家饮料。
1.2 实验方法
1.2.1 色谱条件
色 谱 柱:ACE Excel 5 C18(4.6 mm×250 mm,5 μm);流速:1.0 mL·min-1;柱温:30 ℃;进样量:10 μL;检测波长:230 nm;流动相A:0.02 mol·L-1乙酸铵(用氨水调pH=7.5),流动相B:甲醇,A∶B=95∶5(V∶V)。
1.2.2 标准溶液的配制
脱氢乙酸标准储备液。精密称取脱氢乙酸标准品0.050 48 g于50 mL容量瓶中,加5 mL氢氧化钠溶液(20 g·L-1)溶解后,加水稀释至刻度,摇匀,作为脱氢乙酸标准储备液。
混合标准工作液。分别准确吸取水中苯甲酸、山梨酸、糖精钠标准溶液(1 000 μg·mL-1)和脱氢乙酸标准储备液1.0 mL于10 mL容量瓶中,用水稀释并定容至刻度,摇匀作为混合标准工作液。随后以混合标准工作液为基体逐级稀释得混合系列标准溶液,其中苯甲酸、山梨酸、糖精钠浓度为0 μg·mL-1、1 μg·mL-1、2 μg·mL-1、5 μg·mL-1、10 μg·mL-1、20 μg·mL-1、50 μg·mL-1、100 μg·mL-1;脱氢乙酸浓度为0 μg·mL-1、1.009 μg·mL-1、2.017 μg·mL-1、5.043 μg·mL-1、10.086 μg·mL-1、20.172 μg·mL-1、50.430 μg·mL-1、100.859 μg·mL-1的混合系列标准溶液。
1.2.3 供试品溶液的制备
样品充分混匀,精密称取样品2.00 g,加水约20 mL,超声提取20 min,冷却至室温,用水定容至25 mL,摇匀,过滤。
1.2.4 空白溶液的制备
除未加样品外,其他照1.2.3操作制备,作为空白溶液。
2 结果与分析
2.1 方法优化
2.1.1 流动相的选择
有文献报道苯甲酸、山梨酸、脱氢乙酸和糖精钠检测所用的流动相有甲醇-0.02 mol·L-1乙酸铵(5∶95)[14],甲醇和磷酸二氢铵(100 mmol·L-1)梯度洗脱[12];乙腈-20 mmol·L-1磷酸二氢钾[15],甲醇和乙酸铵溶液(0.02 mol·L-1)梯度洗脱[16-18];甲醇-0.02 mol·L-1乙酸铵(7∶93)[19],乙腈和乙酸铵溶液(0.02 mol·L-1)梯度洗脱[20];甲醇与乙酸铵-无水硫酸钠-三氟乙酸混合液(28∶72)[21],甲醇-0.02 mol·L-1乙酸铵(10∶90)梯度洗脱[22-23]。
从以上文献可知,对流动相选择较多的是甲醇-0.02 mol·L-1乙 酸 铵 系 统,GB 5009.28—2016和GB 5009.121—2016中 也 采 用 了 甲 醇-0.02 mol·L-1乙酸铵系统,基于实验的稳定性以及对色谱柱、检测器和实验人员的保护考虑,本研究流动相选用甲醇-0.02 mol·L-1乙酸铵系统。
2.1.2 流动相pH的选择
通过考察0.02 mol·L-1乙酸铵的pH值,将0.02 mol·L-1的乙酸铵调节pH值为6.0、6.5、7.5、8.0和未调节pH值,以0.02 mol·L-1的乙酸铵∶甲醇(95∶5)分别进样,结果发现pH值为7.5时,分离度较好,故选择pH值为7.5的乙酸铵。
2.1.3 检测波长的确定
用二极管阵列检测器在190~400 nm下对各标准溶液进行扫描,发现苯甲酸在224 nm处有最大吸收,如图1所示;山梨酸在254 nm处有最大吸收,如图2所示;脱氢乙酸在230 nm处有最大吸收,如图3所示;糖精钠在204 nm处有最大吸收,如图4所示;根据各目标物紫外光谱图,综合考虑选择230 nm作为检测波长。

图1 苯甲酸紫外光谱图

图2 山梨酸紫外光谱图
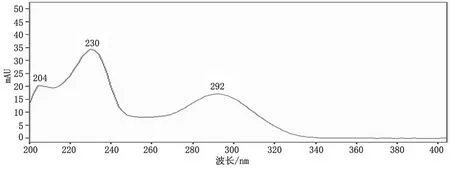
图3 脱氢乙酸紫外光谱图
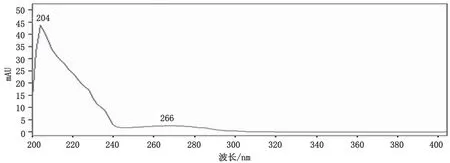
图4 糖精钠紫外光谱图
2.2 专属性实验
混合标准工作液、供试品溶液、空白溶液色谱图分别见图5、图6、图7,结果表明,空白溶剂在目标物出峰处无杂质干扰,目标物之间分离度良好。

图5 混合标准工作液色谱图

图6 供试品溶液色谱图

图7 空白溶液色谱图
2.3 线性范围和灵敏度
在1.2.1项的色谱条件下,对苯甲酸、山梨酸、脱氢乙酸和糖精钠混合系列标准溶液进行测定,在0~100 μg·mL-1范围内,线性关系良好,以3倍信噪比计算检出限,以10倍信噪比计算定量限,回归方程、相关系数、检出限及定量限见表1。结果表明,本方法检出限和定量限均小于GB 5009.28—2016和GB 5009.121—2016中的限量,灵敏度较高。
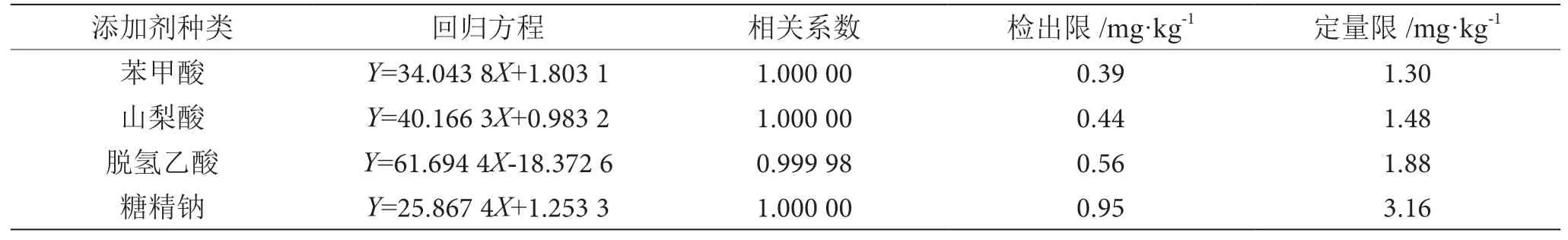
表1 4种添加剂的回归方程、相关系数、检出限及定量限表
2.4 重复性实验
添加10 μg·mL-1的混合标准溶液的空白饮料样品按1.2.1项下色谱条件进行检测,分别连续进样6次,6次测定的相对标准偏差结果见表2,结果表明,本法的重复性良好。

表2 4种添加剂的重复性实验结果表(n=6)
2.5 加标回收实验
准确称取空白饮料样品,分别精密加入水中苯甲酸、山梨酸、糖精钠标准溶液(1 000 μg·mL-1)和脱氢乙酸标准储备液0.05 mL、0.25 mL、0.50 mL依法提取,3个浓度水平的溶液各3份,按1.2.1节色谱条件进行检测,其回收率见表3,结果表明回收率良好。

表3 4种添加剂加标回收率实验结果表(n=3)
2.6 实际样品检测
选择20批饮料按1.2方法进行检测,其中有10批未检出,10批检出苯甲酸或山梨酸,结果见表4。
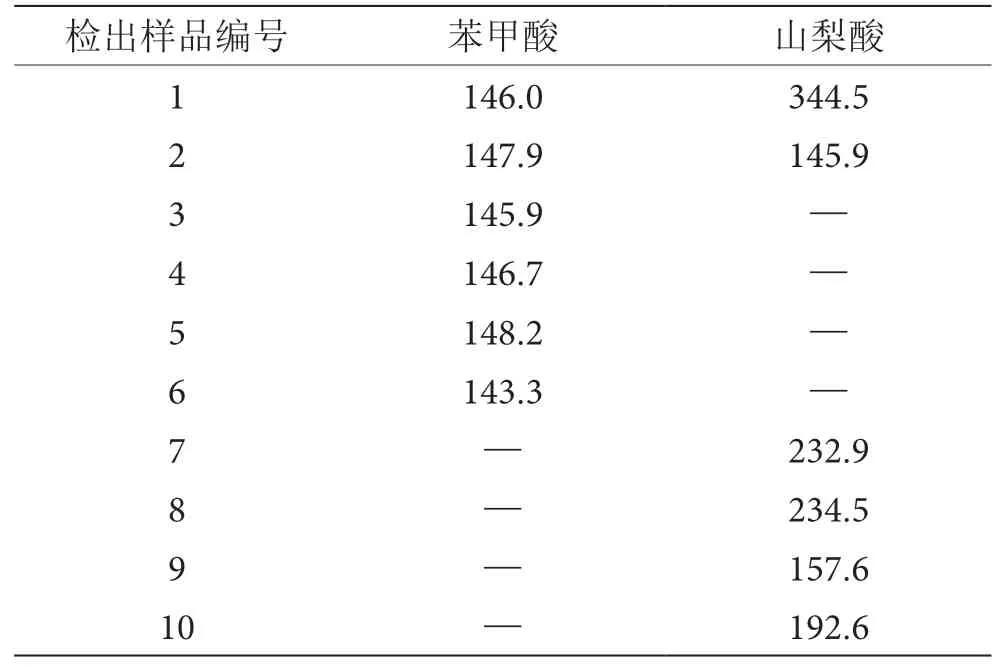
表4 实际样品检测含量表(单位:mg·kg-1)
3 结论
本实验方法建立了高效液相色谱法同时测定饮料中的苯甲酸、山梨酸、脱氢乙酸和糖精钠,此方法操作简单,结果准确,重复性好,灵敏度高,可为同时检测饮料中的4种食品添加剂提供参考。
