室管膜瘤临床病理特征及H3K27me3表达的意义
2021-10-12詹玛琍吴海波
詹玛琍,李 恒,吴海波
室管膜瘤(ependymomas, EPN)属于神经上皮性肿瘤,约占中枢神经系统肿瘤的3.1%,占颅内胶质肿瘤的3%~9%[1]。近年研究表明EPN的预后不仅依赖于组织学分型,还与分子基因的改变相关。如伴RELA基因融合的幕上EPN提示预后不良,而伴YAP1融合基因的EPN预后相对较好[2-3]。H3K27me3是组蛋白H3的第27个氨基酸上发生三甲基化,在弥漫性中线胶质瘤、高级别胶质瘤、弥漫大B细胞淋巴瘤、罕见的去分化软骨肉瘤、恶性神经鞘膜瘤等疾病中均出现表达异常[4-5]。近年研究发现部分EPN中H3K27me3表达缺失[6],而H3K27me3蛋白表达与EPN预后关系的报道较少。本文着重探讨H3K27me3蛋白在不同亚型EPN中的表达,分析其表达与临床病理特征及预后的关系,为EPN的预后提供新的评估指标,以及为患者的个体化、精准化治疗提供新的治疗靶点。
1 材料与方法
1.1 材料收集2015年1月~2019年12月中国科技大学附属第一医院(安徽省立医院)切除并诊断为EPN的标本48例,其中WHO Ⅰ级4例,WHO Ⅱ级33例,WHO Ⅲ级11例,收集患者的临床资料进行回顾性分析,并对患者进行随访。病理切片由两名高年资医师复诊。
1.2 方法标本均经10%中性福尔马林固定,脱水,石蜡包埋,4 μm厚切片,HE染色,光镜下观察。免疫组化染色采用EnVision两步法。抗体GFAP(UMAB129)、Olig-2(EP112)和H3K27me3(RM175)均购自北京中杉金桥公司;EMA(E29)购自福州迈新公司;L1CAM (EPR23241-224)购自英国Abcam公司;C11orf95-RELA融合基因试剂盒购自Invitrogen公司。
1.3 免疫组化结果判断GFAP、L1CAM阳性定位于细胞质,EMA阳性定位于细胞核旁或胞质,H3K27me3、Olig-2阳性定位于细胞核。根据阳性细胞百分比和阳性细胞着色强弱进行判断。(1)按阳性细胞百分比计分:阳性细胞数≤1%为0分,2%~10%为1分,11%~25%为2分,26%~50%为3分,>50%为4分。(2)按阳性着色强弱计分:无阳性着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。将两项评分相乘作为总积分:<1分为阴性,≥1分为阳性[7]。H3K27me3缺失的标准:超过90%肿瘤细胞核染色丢失,切片内的血管内皮细胞可以作为阳性对照[8]。
1.4 统计学分析采用SPSS 20.0软件进行统计学处理,采用t检验和χ2检验或Fisher精确检验软件,预后分析采用Kaplan-Meier分析法。以P<0.05为差异有统计学意义。
2 结果
2.1 临床病理学特征本组48例EPN中,男性19例,女性29例,男女比为1 ∶1.5,发病年龄3~75岁,平均39岁。30例位于脊髓、5例位于幕上、13例位于后颅窝(表1)。WHO Ⅰ级的黏液乳头型EPN 4例,肿瘤细胞呈放射状围绕在血管周围形成乳头状结构,瘤细胞间可见黏液样背景;WHO Ⅱ级的脊髓EPN 24例、幕上EPN 1例、后颅窝EPN 8例,组织学特征为肿瘤细胞围绕在血管周围形成假菊形团(图1、2)和室管膜真菊形团,少数呈乳头状生长;WHO Ⅲ级的脊髓间变型EPN 2例、幕上间变型EPN 4例、后颅窝间变型EPN 5例,组织学特征为肿瘤细胞围绕血管形成放射状假菊形团,细胞密度较高,易见核分裂象(图3、4)。48例患者术后均接受随访,其中7例复发,2例死亡,该9例中4例发生于后颅窝,2例发生于幕上,3例发生于脊髓,余39例均未出现复发及死亡。48例EPN中45例行GFAP免疫组化检测均为阳性(阳性率100%);44例行Olig-2免疫组化检测,5例阳性(少数核阳性,阳性率11%);44例行EMA免疫组化检测,35例核旁点状阳性(阳性率79%);7例EPN行L1CAM检测,4例阳性均为幕上EPN(3例为间变型EPN,1例为WHO Ⅱ级),其中3例L1CAM阳性病例行FISH检测显示均存在C11orf95-RELA融合基因阳性。随访显示4例L1CAM阳性病例中有1例患者出现肿瘤复发。
WHO分级、H3K27me3表达在后颅窝、脊髓、幕上EPN中差异有统计学意义(P<0.05,表1)。后颅窝及幕上EPN的发病年龄均较脊髓EPN年轻,前两者与脊髓对比差异均有统计学意义(P<0.05,表1)。
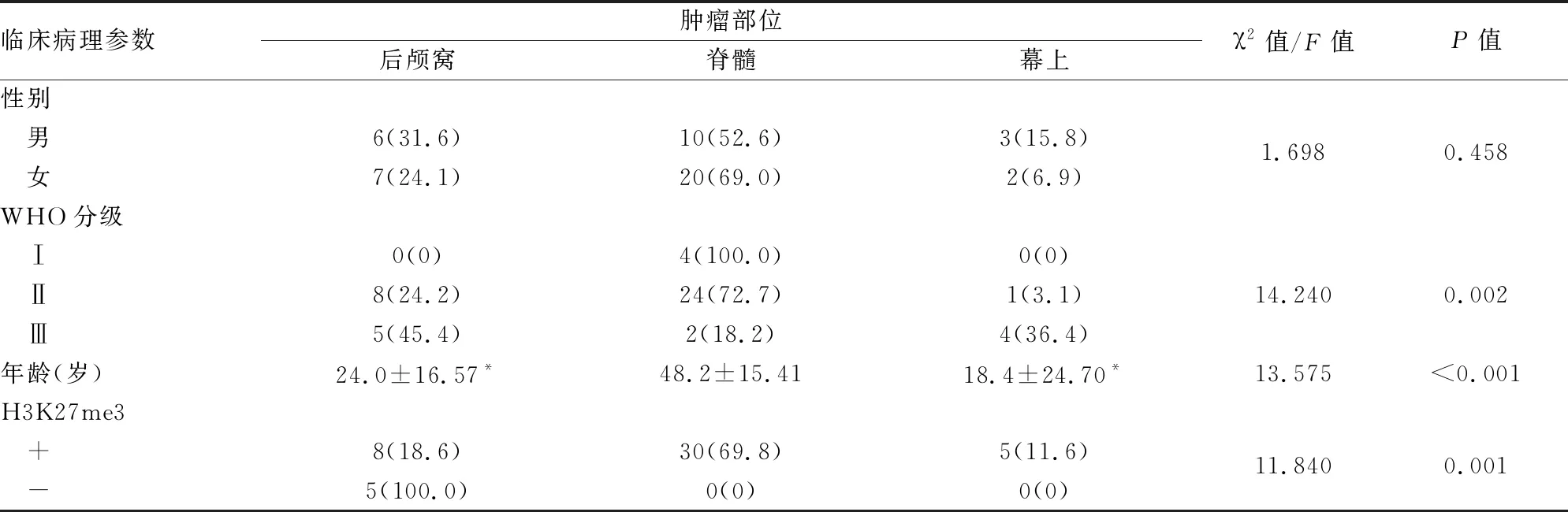
表1 不同部位EPN的临床病理特征[n(%)]
2.2 EPN中H3K27me3表达及与预后的关系在48例EPN中,H3K27me3仅在5例后颅窝EPN中表达缺失(图5、6),其中3例为WHO Ⅲ级,2例为WHO Ⅱ级。5例H3K27me3表达缺失病例中有4例随访显示复发或死亡。生存分析显示,H3K27me3表达缺失患者与未缺失患者的无进展生存期差异有统计学意义(P<0.05,图7),而总生存期之间差异无统计学意义(P>0.05,图8)。

图7 H3K27me3表达与患者无进展生存期的关系
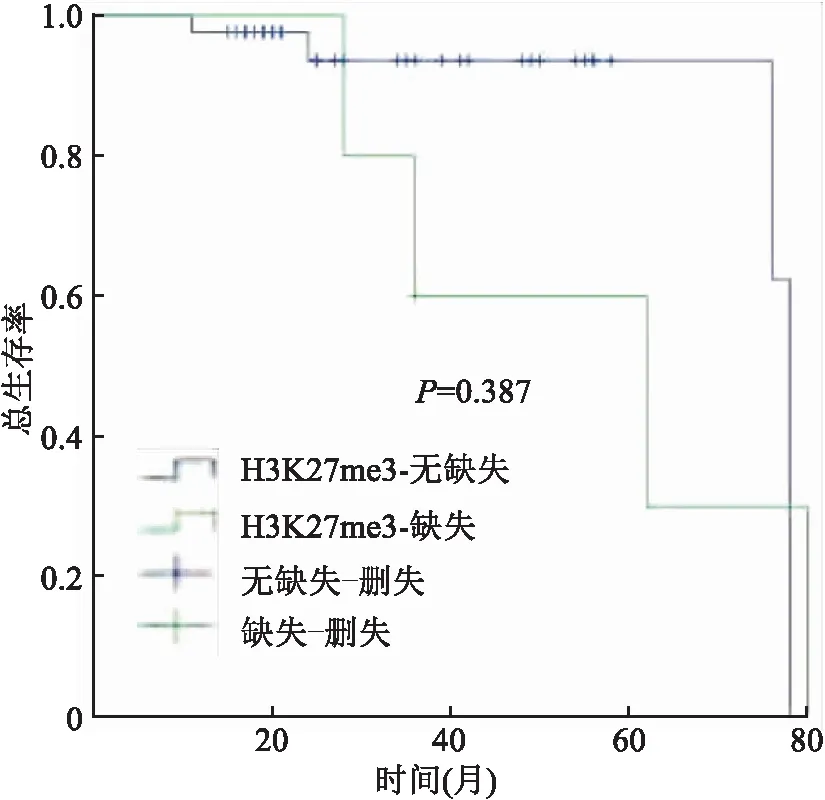
图8 H3K27me3表达与患者总生存期的关系
3 讨论
3.1 EPN临床病理特征及分子遗传学特征研究表明组蛋白修饰在肿瘤发生发展中起关键作用。组蛋白可以通过共价修饰(如乙酰化、甲基化、磷酸化)控制染色质的活性或失活程度,参与多种肿瘤的发生。H3K27me3是组蛋白H3的甲基化产物,是一种抑制基因转录的蛋白标记,在调控细胞增生及分化中起重要作用。Ngollo等[9]研究表明H3K27me3是肿瘤恶性转化的新生物学标志物。H3K27me3表达缺失是由于突变型组蛋白H3通过与EZH2亚基(PRC2重要组成酶)结合,使PRC2(多梳抑制复合物2)沉默转录驱动基因,驱动基因无法被激活。H3K27me3表达缺失见于多种肿瘤,如恶性周围神经鞘膜瘤、Merkel细胞癌[10]、脑膜瘤、去分化软骨肉瘤等,其与肿瘤更高的组织学分级、增殖活性和更短的生存期相关[11],如H3K27me3表达缺失与Ⅰ/Ⅱ型脑膜瘤和弥漫性中线胶质瘤预后不良密切相关[12]。2016年Gessi等[13]首次报道在EPN中H3K27me3蛋白表达缺失。目前少量报道显示H3K27me3表达缺失的EPN预后不佳。本实验全面观察H3K27me3在脊髓、幕上和后颅窝EPN中的表达情况,发现H3K27me3表达缺失均发生于后颅窝EPN,幕上和脊髓EPN均未出现表达缺失(P<0.05)。13例后颅窝EPN中有5例H3K27me3表达缺失,且5例表达缺失后颅窝EPN中有4例患者预后不佳(1例死亡、3例复发),与Bayliss等[6]报道相似。本实验进一步证实H3K27me3可以作为判断后颅窝EPN预后的生物标志物。
临床发现部分EPN分级与患者预后之间的相关性较差,随着近年来对肿瘤表观遗传学研究的深入,中枢神经系统肿瘤分类分子信息及实践方法联盟(cIMPACT)工作委员会提出了一种依据EPN分子特征、解剖部位以及表观遗传学特征等不同改变的综合分型方法,将EPN分为9个不同的分子亚型,分别位于脊柱、后颅窝、幕上[14]。成人EPN好发于脊柱,而约90%的儿童EPN发生于颅内。本组结果显示,脊髓EPN患者平均发病年龄48岁,幕上和后颅窝EPN患者平均年龄分别为18、24岁,脊髓EPN平均发病年龄明显高于幕上和后颅窝EPN(P<0.05),与文献报道的年龄趋势相符[14]。目前认为,部分脊髓EPN的发病机制与NF2突变有关,该部分EPN的总生存率较好。黏液乳头型EPN好发于成人,目前黏液乳头型EPN与成人EPN的临床预后相似,肿瘤细胞可通过脑脊液播散到其他中枢神经系统部位或经血液转移到中枢神经系统外部位,甚至在疾病的早期就可发生复发或转移[15]。因此,cIMPACT提出黏液乳头型EPN应归为WHO Ⅱ级。本组4例脊髓黏液乳头型EPN患者均未发生复发或死亡。近年有学者提出伴MYCN基因扩增的脊髓EPN,其特征为具有侵袭性、早期播散、间变形态和MYCN基因扩增,预后较差[16]。幕上EPN主要有C11orf95-RELA和YAP1-MAMLD1融合基因,前者好发于儿童及年轻人[17],一般预后较差。本组3例RELA融合基因阳性患者,发病年龄3~14岁,其中1例患者复发。幕上EPN也可存在其他融合基因,如C11orf95与MAML2、YAP1,YAP1与FAM118B。后颅窝EPN根据基因表达图谱和CpG岛(CpGi)甲基化状态分为后颅窝室管膜瘤A型(posterior fossa ependymomas group-A, EPN-PFA)和后颅窝室管膜瘤B型(posterior fossa ependymomas group-B, EPN-PFB)。EPN-PFA型主要发生于儿童,基因表达谱明显,表现为CpGi高甲基化,侵袭性较强,大多数研究结果显示预后较差。EPN-PFB型发生在老人和年轻人,表现为广泛染色体畸变,侵袭性较小,预后较好[12-13]。Bayliss等[6]等发现,基因组H3K27me3表达与CpGi甲基化呈反向关系,提示CpGi高甲基化导致后颅窝EPN中H3K27me3水平较低。另有研究提出通过H3K27me3免疫染色将后颅窝EPN分为H3K27me3阴性组和H3K27me3阳性组,分别对应于EPN-PFA型和EPN-PFB型。本组13例后颅EPN中5例H3K27me3表达缺失。5例表达缺失组中有1例死亡、3例复发,而8例未缺失组均未出现复发和转移。上述结果表明,H3K27me3缺失EPN的临床特征与EPN-PFA型相似,提示H3K27me3表达缺失EPN可对应分子分型EPN-PFA型,进一步说明H3K27me3可作为后颅窝EPN分型及判断预后的重要指标。文献报道,H3K27me3表达缺失患者与H3K27me3表达未缺失患者的总生存期及无进展生存期差异均有统计学意义[18]。本组生存分析发现,H3K27me3表达缺失患者的无进展生存期及总生存期低于H3K27me3未缺失患者,且H3K27me3可作为预后因素预测后颅窝EPN的无进展生存期,而两者的总生存期差异无统计学意义。本组结果与已知报道存在部分差异,可能与本组统计样本量较少有关,待后续收集更多病例进一步分析。
3.2 治疗目前,对EPN的治疗是基于病理分型分级,所有级别和类型的治疗都包括最大程度的手术切除,经影像学证实完整切除的WHO Ⅱ级EPN患者术后可以密切随访,但WHO Ⅲ级和Ⅱ级次全切除的EPN需行辅助放疗[19]。对于复发或不能选择再次切除及再次放疗的患者,可采取化疗。现有的化疗方案治疗效果不佳,儿童患者的10年生存率约60%,成人患者为70%~89%[20],婴儿期患者在确诊5年后的存活率仅为42%~55%。因此,迫切需要发现有效的治疗靶点以提高患者的生存率。近年有学者提出CpG高甲基化和PRC2复合物的过度活跃使肿瘤抑制基因沉默,导致EPN-PFA的发生[21],用去甲基化药物和PRC2抑制剂治疗EPN-PFA能够使肿瘤抑制基因恢复表达,抑制肿瘤的进展。此外,这些药物还对异体移植EPN-PFA具有抑制作用,并能降低其肿瘤启动能力。目前,该治疗方法还需体内及体外实验进一步分析。
综上所述,运用免疫组化方法对后颅窝EPN标本进行H3K27me3蛋白检测,可以帮助临床预测和评估患者的预后,进而指导临床对H3K27me3蛋白缺失患者行个体化治疗,本实验为后续研究EPN的发病机制和治疗提供新的研究方向。
