2019版乳腺癌HER-2检测指南对FISH可疑阳性病例判读及其预后分析
2021-10-12商久妍刘月平
商久妍,刘 畅,刘月平
乳腺癌是我国女性发病率较高的恶性肿瘤,每年我国乳腺癌新发病例和死亡病例分别占全球总病例数的12.2%和9.6%[1]。HER-2可编码膜受体酪氨酸激酶,与肿瘤细胞生长、侵袭和转移密切相关[2]。研究发现,HER-2扩增和过表达是乳腺癌和胃癌的确定治疗靶点[3],其在20%~30%的浸润性乳腺癌(invasive breast cancer, IBC)中扩增或过表达,而HER-2阳性乳腺癌患者可以接受HER-2靶向治疗[4]。目前,我国最新《乳腺癌HER2检测指南(2019版)》(简称2019版指南)已经发布[5],本文收集IBC患者,并根据2019版指南进行免疫组化和FISH检测,比较与《乳腺癌HER2检测指南(2014版)》(简称2014版指南)的一致性和优劣性[6]。早期临床实验已证实HER-2阳性患者服用曲妥珠单抗药物可以提高肿瘤对药物的反应性,增加患者的无进展生存和总生存时间,降低乳腺癌患者的复发率和病死率[7]。因此,HER-2阳性的判定标准对乳腺癌预后判断、治疗方案选择,尤其是对筛选HER-2靶向药物获益患者尤为重要[7-10]。目前,免疫组化和荧光原位杂交(fluorescence in situ hybridization, FISH)是FDA批准用于HER-2测试的两种测定法。本文根据最新2019版HER-2检测指南,进一步分析不同HER-2指南判读对患者预后的影响,比较两版指南的临床意义,并分析HER-2表达与乳腺癌临床病理特征及预后的关系。
1 材料与方法
1.1 临床资料筛选2014年10月~2017年10月河北医科大学第四医院术后组织病理学诊断为IBC,且术前未接受任何治疗的患者3 483例。对所有病例进行随访,其中3 206例获得随访。
1.2 方法回顾性分析3 483例IBC,对其行免疫组化及FISH检测,并依据两版指南进行HER-2判读。其中免疫组化使用罗氏公司兔单克隆一抗,BenchMarK XT全自动免疫组化仪进行检测。分析2014版乳腺癌HER-2检测指南FISH检测HER-2为可疑阳性,而2019版指南判定为阴性的病例,收集患者的临床病理资料并对患者进行随访,进一步分析不同指南判读对患者预后的影响,比较两版指南的临床意义,并分析HER-2表达与临床病理特征及预后的关系。
1.3 判断标准关于乳腺癌HER-2的判读,两版指南不同之处主要为:(1)2014版指南HER-2/CEP17比值≥2.0判读为阳性,2019版指南还需结合平均HER-2拷贝数/细胞≥4.0才可判为阳性;HER-2/CEP17比值≥2.0而HER-2拷贝数/细胞<4.0者,2019版指南还需增加细胞计数,结果不变者判为阴性。(2)2014版指南中HER-2/CEP17比值<2.0,平均HER-2拷贝数/细胞≥6.0者判读为阳性,2019版还需增加细胞计数,结果不变者判为阳性。(3)2014版指南HER-2/CEP17比值<2.0,平均HER-2拷贝/细胞数≥4.0且<6.0判为可疑,2019版指南需重新计数细胞后综合判读,若结果仍不变还需结合免疫组化结果进行判读,若免疫组化3+则判为阳性,若免疫组化0~2+则判为阴性。
1.4 统计学分析采用SPSS 22.0软件进行统计学分析和处理,χ2检验进行差异的显著性检验,Kaplan-Meier法进行单因素生存分析,组间比较使用Log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 临床特征3 483例IBC中,男性11例,女性3 472例,年龄20~78岁,中位年龄53岁,平均49.8岁。非特殊型浸润性癌(invasive carcinoma of no special type, NST)2 905例(83.41%),其他类型浸润性癌578例(16.59%)。NST中,组织学分级Ⅰ级124例(3.56%),Ⅱ级1 977例(56.76%),Ⅲ级804例(23.08%)。分子分型:Luminal A型487例(13.98%),Luminal B型HER-2阴性1 628例(46.74%),Luminal B型HER-2阳性623例(17.89%),HER-2过表达型262例(7.52%),Basal-like型390例(11.20%)。
2.2 免疫组化判读HER-2状态3 483例IBC术后标本均行免疫组化检测,其中,免疫组化HER-2 0者635例(18.23%),HER-2 1+者544例(15.62%),HER-2 2+者1 419例(40.74%),HER-2 3+者885例(25.41%)(图1),其中免疫组化HER-2 2+者需行FISH检测以明确其最终表达。
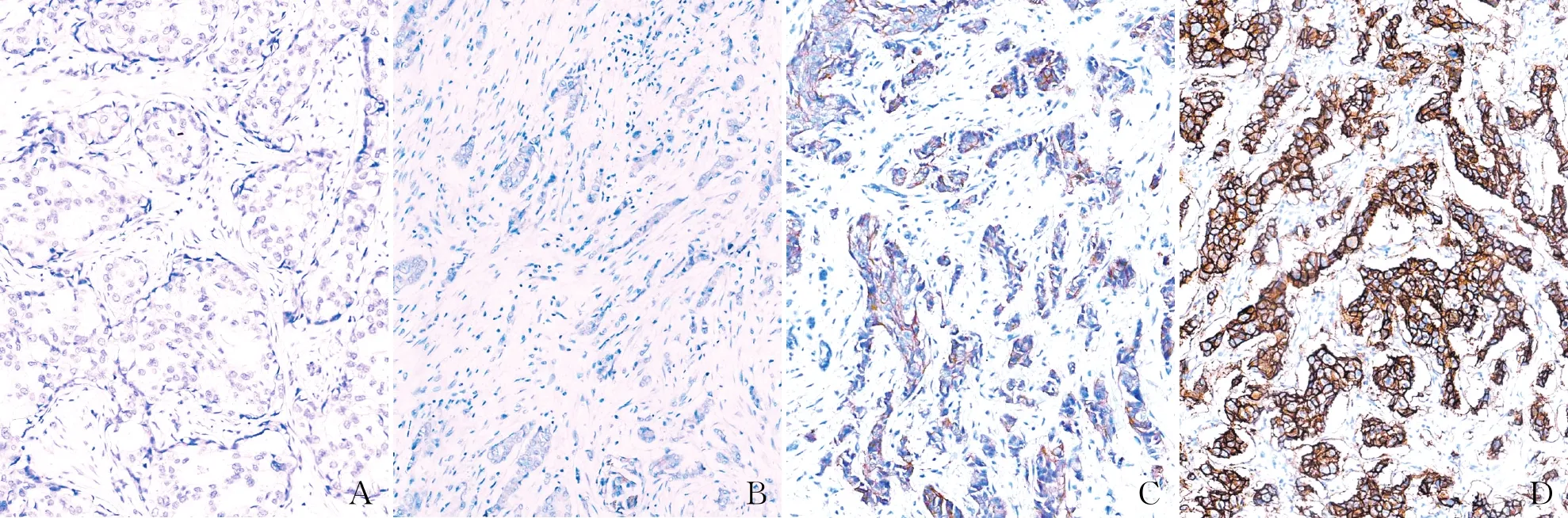
图1 免疫组化检测乳腺癌中HER-2状态,SP法:A.0;B.1+;C.2+;D.3+
2.3 FISH判读HER-2状态对1 419例HER-2 2+患者行FISH检测,2014版指南判读结果:HER-2阴性1 114例,阳性212例,可疑93例;2019版指南判读结果:HER-2阴性1 210例,阳性209例(图2)。其中2014版指南可疑结果93例,而根据2019版指南该93例可疑病例均被判定为阴性。结合免疫组化及FISH检测分析3 483例患者,根据2014版判读结果:HER-2阴性2 505例,阳性885例,可疑93例;2019版判读结果:HER-2阴性2 601例,阳性882例。经统计分析,2014版和2019版指南HER-2检测结果差异有统计学意义(χ2=94.810,P<0.05,表1、2)。
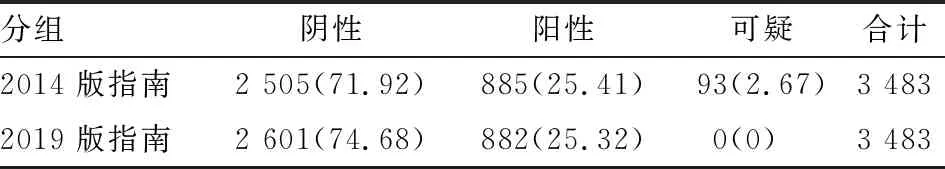
表1 2014版和2019版HER-2检测指南对乳腺癌HER-2检测的判读结果[n(%)]
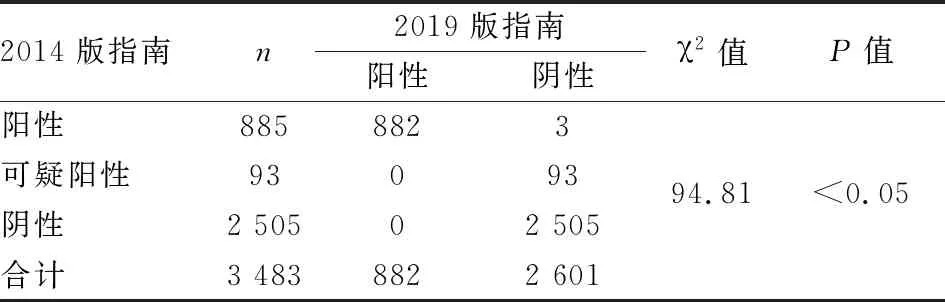
表2 2014版和2019版指南对免疫组化HER-2 2+的FISH结果比较
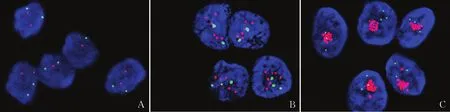
图2 FISH检测HER-2状态:A. 阴性,无HER-2扩增;B. 阳性,HER-2点状扩增;C. 阳性,HER-2簇状扩增
2.4 随访及生存分析对2014版指南FISH判读可疑阳性,而2019版指南判读为阴性的93例患者进行随访,其中行抗HER-2治疗组7例(7.53%),出现复发转移1例(1.08%);未行抗HER-2治疗组86例(92.47%),出现复发转移3例(3.23%)(表3)。采用Kaplan-Meier生存分析显示,差异无统计学意义(χ2=1.471,P=0.225,图3)。提示这类患者是否进行抗HER-2治疗预后差异无统计学意义(P>0.05)。

图3 2014版指南FISH结果判读为可疑阳性的患者Kaplan-Meier生存曲线

表3 93例新判读阴性病例HER-2治疗情况及预后[n(%)]
3 讨论
HER-2是酪氨酸激酶受体蛋白,属于EGFR家族。HER-2参与乳腺癌的病理生理过程,HER-2/ErBb2/neu致癌基因位于染色体位置17q12上,其蛋白表达和基因扩增状态有助于预测早期和晚期疾病患者的预后[11]。本文根据2019版指南对3 483例IBC患者FISH检测结果与临床病理特征的关系进行再评价,并与2014版指南进行比较与分析,从而指导肿瘤标本的准确HER-2判读,使患者做出最优选择。
分析2014版指南判读结果,1 419例免疫组化HER-2 2+病例中,FISH检测阳性212例,阴性1 114例,可疑93例,其中阳性率14.94%,阴性率78.51%,可疑病例达6.55%;2019版指南中,阳性212例,阳性率14.94%,阴性则达1 207例,阴性率85.06%。这是由于2019版指南考虑到目前临床试验数据中,仍缺乏充分证据证明HER-2/CEP17比值≥2.0,平均HER-2拷贝数/细胞<4.0的患者能从HER-2靶向治疗中获益[12-13]。本组对于2014版指南判读可疑阳性的病例,进行随访调查,证实可疑阳性病例并未从HER-2靶向治疗中获益,进一步证实了2019版指南有效规避了2014版指南中的可疑阳性病例,使靶向药物的应用更加准确和完善,因此2019版指南标准更具明确性和科学性。
美国临床肿瘤学会(ASCO)和美国病理学家学会(CAP)根据免疫组化测定的HER-2蛋白表达水平和HER-2基因扩增水平,制定了HER-2状态评估指南[14]。根据文献报道现有数据,对于判读0、1+和3+的HER-2状态,免疫组化和FISH检测之间具有优异的一致性,但是对于免疫组化HER-2 2+组仍存在争议。因此,对于HER-2 2+的判读仍是目前备受关注的问题。对于免疫组化HER-2 2+的判读,各国标准也不尽相同。首先,其在2015年补充并被2018版ASCO/CAP指南采纳:>10%浸润癌中出现弱~中等强度的完整细胞膜染色。2013版ASCO/CAP指南:(1)≤10%的肿瘤细胞呈现完整、强的环周膜染色;(2)>10%的肿瘤细胞呈现不完整和(或)弱/中等程度细胞膜染色。2014版法国指南:(1)≤10%的肿瘤细胞呈现完整、强的环周膜染色;(2)>10%的肿瘤细胞呈现完整,中等程度的细胞膜染色;(3)>10%的肿瘤细胞呈现不完整的中~强细胞膜染色。2015版英国指南:(1)≥10%的肿瘤细胞呈弱~中等的完整膜染色;(2)≤10%的肿瘤细胞呈现完整、强的细胞膜染色;(3)>10%中等或中等~强的细胞膜染色,但不完整。其诊断的染色模式有多种变化组合,且其染色强度缺乏定量标准,缺乏客观性。
HER-2免疫组化和FISH测定结果的不一致,可能由各种因素引起且并不罕见。例如,肿瘤组织处理方法的变化比HER-2基因检测对HER-2蛋白检测的影响更大。因此,关于样本处理技术的标准化也是一个重要问题,样本的固定时间和使用不同固定剂被认为是导致检测结果不一致的原因,除此之外,免疫组化检测结果也受抗原修复方法的影响[15]。根据现有的文献报道认为,固定的方式和持续时间可能导致不一致和不正确的免疫组化结果。FISH检测技术比免疫组化对标本的要求更高,对实验室的要求也较高,因此标本的处理、实验流程质控和人工判读也会对HER-2的结果判读造成影响。若FISH信号解释由经验丰富的病理学家进行,FISH测定更加可靠[16]。另一方面,肿瘤异质性也可能导致HER-2免疫组化和FISH评分之间的不一致[17]。当联合使用两种测定时,乳腺癌患者不正确的HER-2状态评估可能性降低。
对IBC患者进行准确的HER-2评估,对于确定哪些患者可能从HER-2靶向治疗中获益至关重要。有研究报道2014版指南更新后可疑阳性病例数增加[18],2019版指南的更新再次重新定义了HER-2基因扩增是通过双探针FISH确定的。目前乳腺癌患者的HER-2检测方案是首先用免疫组化评估样本,然后用FISH检测跟踪可疑阳性或不一致结果的样本。因此,本组主要针对免疫组化HER-2 2+的病例,分析FISH可疑阳性结果的新判读,将2014版指南与更新的2019版指南进行比较。
综上分析,2019版指南更适用于临床。准确的HER-2检测策略关乎乳腺癌患者的后期治疗。目前的研究仍主张使用2019版乳腺癌HER-2检测指南。当然,不断更新的研究也可以确定是否应纳入新定义的HER-2阳性或其他生物标志物,以决定是否推荐曲妥珠单抗。此外,仍然需要大量的研究和数据来研究人类乳腺癌。目前HER-2检测指南对于乳腺癌患者的治疗起决定性作用,但病理诊断判读以及患者预后长期随访数据在评估检测标准时仍然重要。
