阿仑膦酸钠在地塞米松诱导C2C12细胞自噬中的作用机制探讨
2021-10-12田爱现马剑雄马信龙李岩
田爱现,马剑雄,马信龙△,李岩
骨骼肌的功能与其肌纤维的数量和体积有关,当骨骼肌出现萎缩时,其质量会相应减少,机体的运动系统功能也会受到明显影响,从而影响患者的身体健康,降低生活质量,老年患者尤为明显[1]。当前对骨骼肌萎缩的研究已成为热点。药物治疗以其独特的优势与良好的疗效在防治骨骼肌萎缩方面发挥着重要作用。阿仑膦酸钠(Alendronate,ALN)作为第3代双膦酸盐药物,可有效抑制骨吸收,维持骨量,是治疗原发性及继发性骨质疏松的一线药物[2]。ALN除了可治疗骨质疏松症外,还能明显增加骨骼肌质量[3],并能通过提高自噬、抑制骨骼肌蛋白降解等途径抑制骨骼肌萎缩[4-5]。本研究以地塞米松(Dexamethasone,Dexa)诱导C2C12细胞肌小管萎缩,通过体外细胞实验探讨ALN在骨骼肌萎缩中的作用及机制。
1 材料与方法
1.1 实验材料及仪器 阿仑膦酸钠(Merck Sharp&Dohme Italia SPA,国药准字J20130085,600 mg/片);地塞米松购自Sigma公司;DMEM培养基、胎牛血清购自Gibco公司;4%中性多聚甲醛固定液、HE染色试剂盒、免疫组化试剂盒为武汉赛维尔生物科技有限公司产品;微管相关蛋白1轻链3(LC3)、Beclin-1、肌球蛋白重链(MHC)抗体,肌肉特异性环指蛋白1(MuRF1)单克隆抗体及辣根过氧化物酶(HRP)标记的对应二抗均购自英国Abcam公司;CCK-8检测试剂盒(碧云天生物技术有限公司)。酶标仪(Rayto,RT6100),离心机(大龙,D3024R),成像系统(上海天能科技有限公司,Tanon-1600R),光学显微镜(日本,Nikon EclipseE100),Western blot电泳仪(Bio-Rad公司,美国)。
1.2 研究方法
1.2.1 C2C12细胞培养、分化和分组 C2C12肌细胞来源于天津市骨科研究所,培养于含10%胎牛血清的DMEM高糖培养基,添加1%青霉素和链霉素(生长培养基),细胞置于37℃、5%CO2孵箱,48 h更换生长培养基。细胞生长至70%左右时更换含2%马血清的DMEM高糖培养基(分化培养基)继续培养4 d,以诱导C2C12细胞肌小管形成。实验设对照组(DMSO处理),Dexa组(100μmol/L Dexa处理),Dexa+ALN组(100μmol/L Dexa+1.0μmol/L ALN处理)。
1.2.2 CCK-8检测细胞增殖 取对数生长期细胞,以5×103细胞/孔接种于96孔板,接种12 h后加入药物处理。实验设4组,ALN浓度分别为0、0.1、0.5和1.0μmol/L,设置仅含有等体积DMEM全培养基的空白孔排除培养基干扰,每组设置3个复孔。药物处理48 h后,根据CCK-8试剂盒说明书操作,弃原有培养基,每孔加入100μL的CCK-8试剂,37℃孵育2 h。用酶标仪测定450 nm处的光密度(OD)值,计算细胞存活率,筛选ALN合适剂量。
1.2.3 C2C12细胞肌小管HE染色 细胞生长至70%左右时更换含2%马血清的DMEM高糖培养基继续培养4 d,弃掉培养基,加冷PBS(pH=7.4~7.6)清洗2次,每次30 s,每孔加入4%中性多聚甲醛固定液15 min,PBS清洗3次,每次5 min。每孔加入苏木素染液2 min,适量PBS清洗3次,每次5 min。每孔加入伊红染液30 s,适量PBS清洗3次,每次5 min。光镜下观察C2C12细胞肌小管情况。
1.2.4 C2C12细胞肌小管直径和融合指数测定 C2C12细胞肌小管呈长梭形,以每条肌小管中部2/3作为其直径测量部位,沿轴线方向测定多组数据,每组随机拍摄3张图。肌小管是多个C2C12细胞融合而形成的,因此以视野下肌小管中的细胞核数量占总细胞核数量的百分比评估C2C12细胞的分化程度。其计算方式:融合指数(%)=视野肌小管中细胞核数(n)/视野中细胞核总数(N)×100%。每个实验组随机取6张照片,最终结果取其平均值,采用Image J 1.48软件统计肌小管直径和融合指数。
1.2.5 Dexa刺激诱导C2C12细胞肌小管萎缩模型的建立 C2C12细胞采用分化培养基培养4 d形成肌小管,更换分化培养基,使用浓度100μmol/L的Dexa刺激24 h。
1.2.6 Western blot法检测肌蛋白和自噬相关蛋白表达 细胞生长至70%左右时更换含2%马血清的DMEM高糖培养基继续培养4 d,24 h后收集各组细胞并提取总蛋白,BCA法测量蛋白浓度,经SDS-PAGE、转膜、5%脱脂奶粉封闭,随后加入MHC、MuRF1、LC3、Beclin-1和抗β肌动蛋白一抗(均为1︰1 000稀释),于4℃孵育过夜,次日TBST震荡洗涤3次,加入按比例稀释的HRP标记的对应二抗(1∶4 000),室温孵育60 min,TBST洗涤3次后进行ECL化学发光显影,成像系统显影,所有蛋白条带灰度值定量密度分析采用Image J 1.48软件。
1.2.7 免疫荧光检测肌合成蛋白MHC表达 细胞生长至70%左右时更换含2%马血清的DMEM高糖培养基继续培养4 d,24 h后弃掉培养基,加冷PBS(pH=7.4~7.6)清洗2次,每次30 s;每孔加入4%中性多聚甲醛固定15 min,适量PBS清洗3次,每次5 min;每孔加入0.3%TritonX-100作用20 min,适量PBS清洗3次,每次5 min;每孔加入5%胎牛血清封闭液,在37℃摇床下孵育1 h;加入一抗兔源MHC(1︰1 000),4℃孵育过夜,一抗孵育结束后,加入适量PBS清洗3次,每次5 min;加入荧光标记的羊抗兔二抗,室温孵育1 h,加入适量PBS清洗3次,每次5 min;每孔加入DAPI染细胞核,室温孵育5 min,加入适量PBS清洗3次,每次5 min;防荧光淬灭树脂胶封片,共聚焦显微镜下进行观察。
1.3 统计学方法 采用SPSS 16.0软件进行数据分析,计量资料以均值±标准差(x±s)表示,多组间均数比较采用单因素方差分析,组间多重比较采用LSD-t检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 不同浓度ALN对C2C12细胞增殖能力的影响 结果显示,0、0.1、0.5和1.0μmol/L ALN组细胞增殖能力组间比较差异有统计学意义(n=3,F=74.978,P<0.01);相较于其他浓度组,1.0μmol/L ALN组细胞增殖能力更高(P<0.05),见图1。因此本实验选择1.0μmol/L ALN进行后续实验。
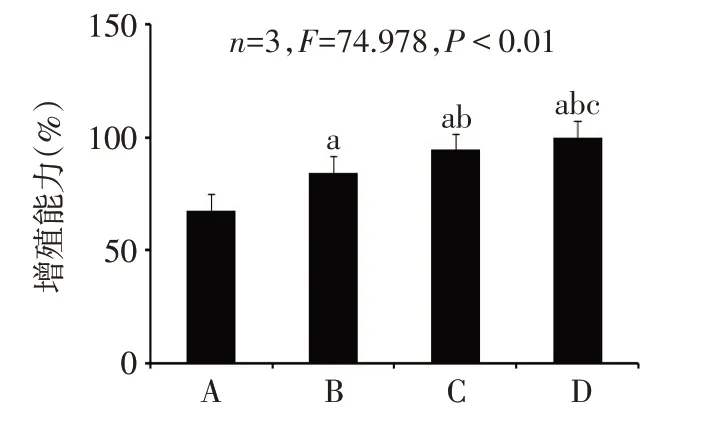
Fig.1 Effects of different concentrations of ALN on theproliferation of C2C12 cells图1 不同浓度ALN对C2C12细胞增殖能力的影响
2.2 不同浓度ALN对C2C12细胞分化的影响 结果显示,0、0.1、0.5和1.0μmol/L ALN处理后,1.0 μmol/L ALN组相较于其他组的细胞分化能力更高,其肌小管直径最大、肌小管融合指数最高(P<0.05),见图2。
2.3 ALN对Dexa诱导C2C12细胞肌蛋白表达的影响 Western blot结果显示,与对照组相比,Dexa组细胞MuRF1蛋白表达水平升高(1.00±0.00vs.2.46±0.12),Dexa+ALN组中MuRF1蛋白表达水平(0.67±0.03)较Dexa组显著下调,组间比较差异均有统计学意义(n=3,F=337.335,P<0.01),见图3。免疫荧光结果显示,与对照组相比,Dexa组肌小管萎缩,并且MHC蛋白荧光表达强度(红光)明显降低,Dexa+ALN组MHC蛋白荧光表达强度表达较Dexa组显著升高,见图4。
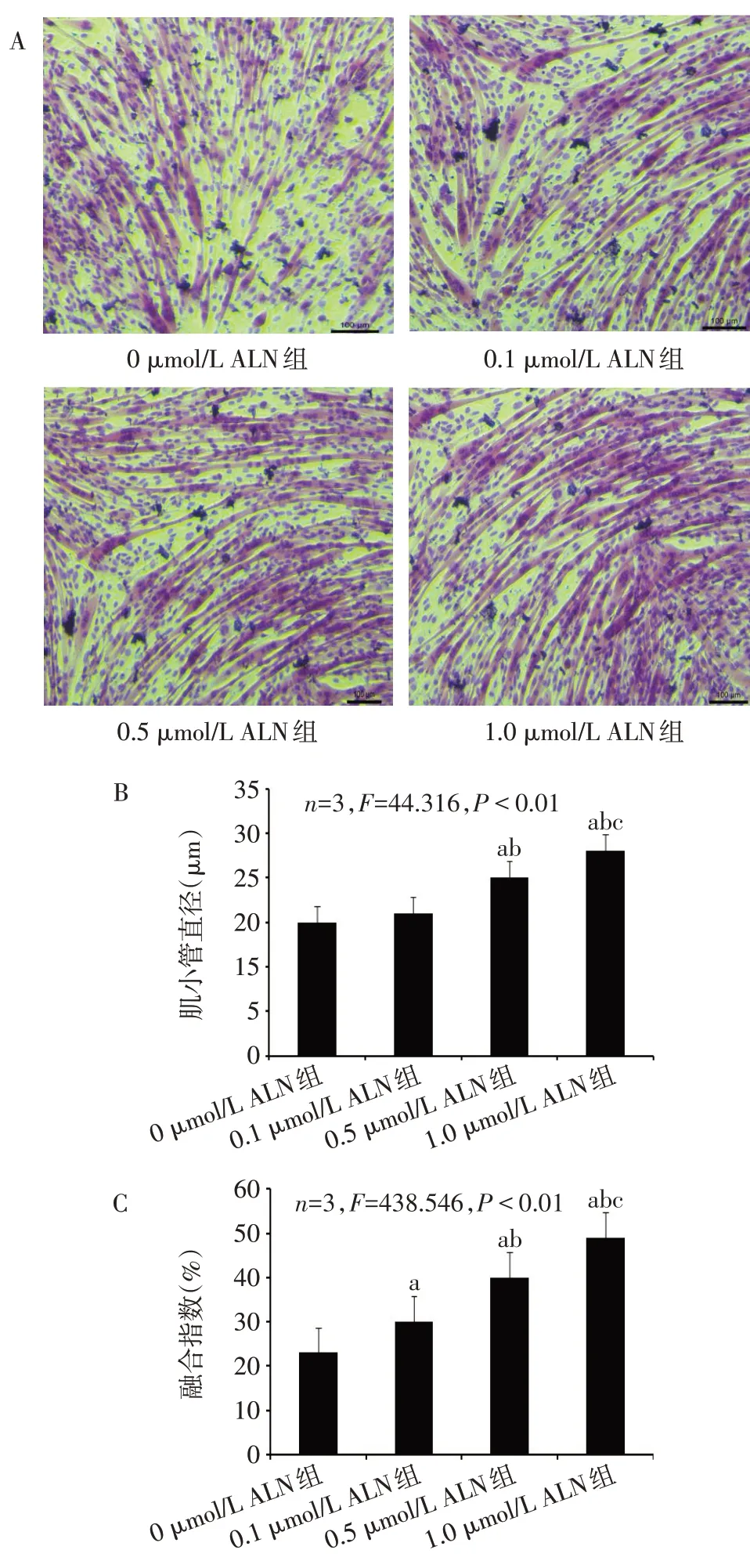
Fig.2 Effects of different concentrations of ALN on the differentiation of C2C12 cells图2 不同浓度ALN对C2C12细胞分化的影响
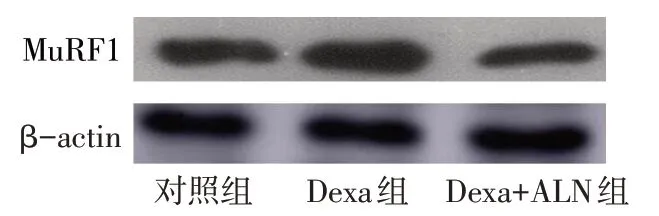
Fig.3 Western blot assay showed the effect of ALN on the expression of MuRF1 protein induced by Dexa in C2C12 cells图3 Western blot法检测ALN对Dexa诱导C2C12细胞MuRF1蛋白表达的影响
2.4 ALN对Dexa诱导C2C12细胞自噬水平的影响 Western blot结果显示,与对照组相比,Dexa组自噬信号通路相关蛋白LC3-Ⅱ/LC3-Ⅰ、Beclin-1表达水平较对照组显著下调(P<0.05),Dexa+ALN组中LC3-Ⅱ/LC3-Ⅰ、Beclin-1蛋白表达较Dexa组显著上调(P<0.05),见图5、表1。
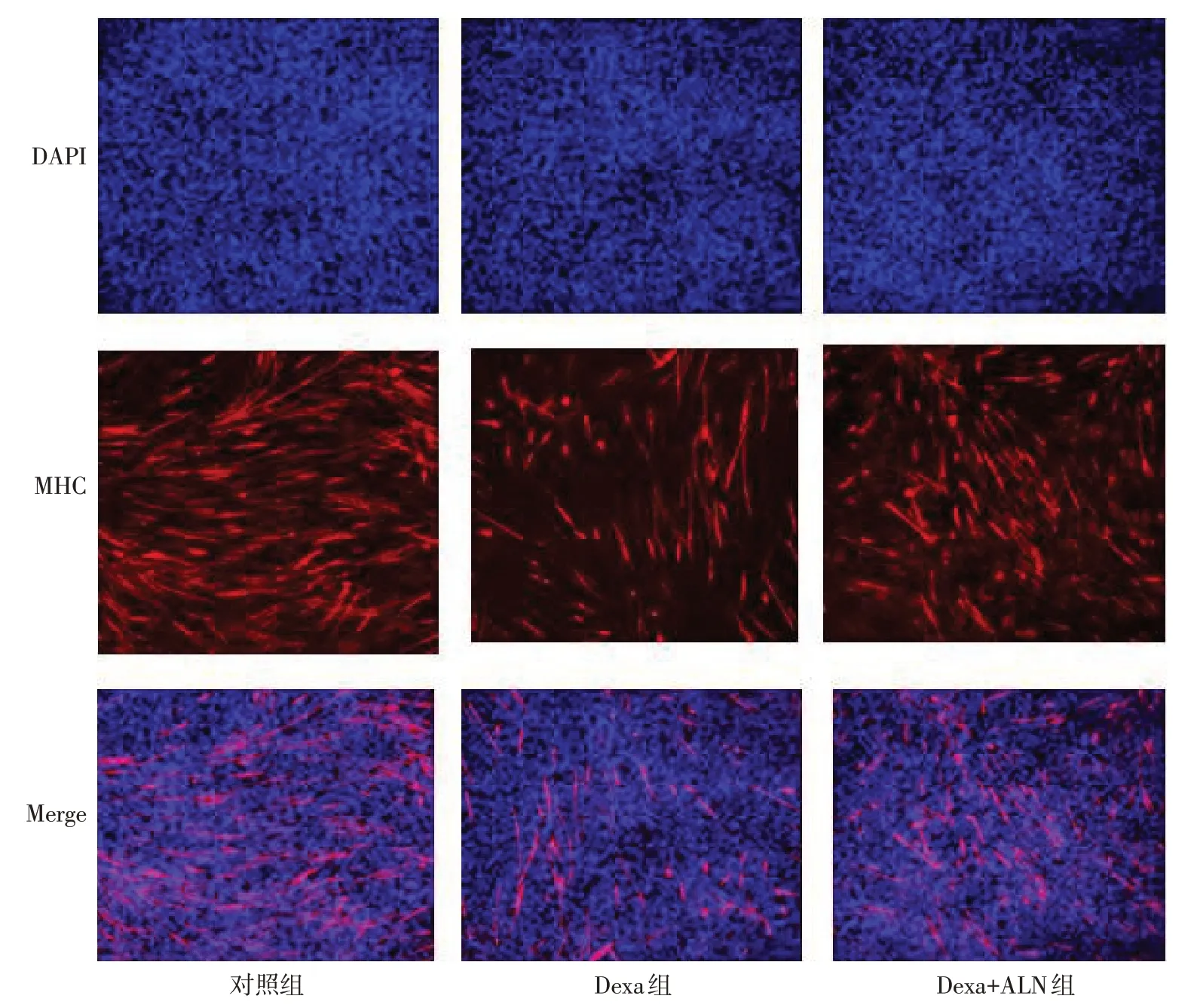
Fig.4 The effects of ALN on Dexa-induced MHC protein expressions in C2C12 cells detected by immunofluorescence图4 免疫荧光检测ALN对Dexa诱导C2C12细胞MHC蛋白表达的影响
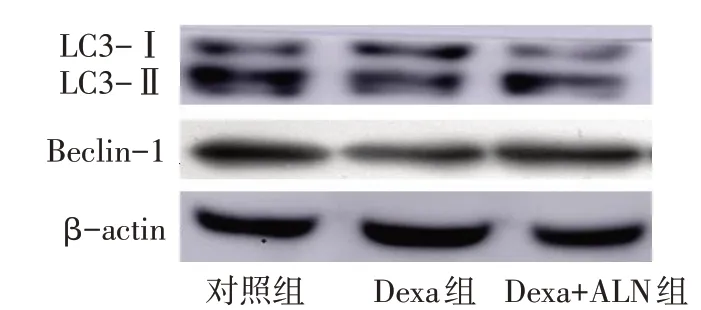
Fig.5 Western blot assay showed the effect of ALN on Dexa-induced autophagy in C2C12 cells图5 Western blot法检测ALN对Dexa诱导C2C12细胞自噬水平的影响

Tab.1 Comparison of the expression levels of autophagy related proteins between three groups of C2C12 cells表1 各组C2C12细胞中自噬相关蛋白表达水平比较(n=3,x±s)
3 讨论
3.1 双膦酸盐类抗骨质疏松药物在骨骼肌中的作用 双膦酸盐类抗骨质疏松药物对骨骼肌生长和功能的影响目前尚存在争议。Yoon等[6]研究表明双膦酸盐中的帕米膦酸盐对杜氏肌萎缩症小鼠模型具有增加骨骼生长和提高骨骼肌功能的作用。Børsheim等[7]认为,帕米膦酸钠可通过调节骨骼肌蛋白的合成和分解来减轻骨骼肌萎缩,并提高烧伤后患者的骨骼肌力量。Uchiyama等[8]发现32例骨质疏松症患者服用双膦酸盐治疗3年后,股骨周围骨骼肌密度明显改善。Widrick等[9]研究结果也表明一定剂量的ALN在可以增加去势大鼠骨量,但对骨骼肌功能没有影响。Shiomi等[10]研究发现100μmol/L ALN可抑制人肌细胞的增殖和分化。本研究发现,与0、0.1和0.5μmol/L ALN组相比,1.0μmol/L ALN组能够显著促进C2C12细胞增殖和分化,增加肌小管直径和肌小管融合指数,并显著改善Dexa诱导的C2C12细胞肌小管萎缩,促进骨骼肌合成蛋白MHC表达上调,抑制肌降解蛋白MuRF1的表达。
3.2 自噬信号通路相关蛋白在骨骼肌细胞中的作用 LC3是自噬标志蛋白之一。LC3作为一种前肽可产生含C末端的肽,并释放到细胞质中。LC3-Ⅰ通过Atg7和Atg3将磷脂酰乙醇胺偶联,生成脂质化形式的LC3,也称作LC3-Ⅱ。LC3-Ⅱ广泛存在于真核生物中,其表达程度与自噬活性密切相关。LC3-Ⅱ可被整合到细胞膜中,并与LC3-Ⅰ强烈结合,常用LC3-Ⅱ/LC3-Ⅰ来评价自噬水平[11]。研究发现,小鼠在跑台运动1 h或急性钝挫伤干预后,骨骼肌细胞的自噬标志蛋白含量均明显升高[12]。Takegaki等[13]发现过度训练能抑制骨胳肌降解蛋白表达,激活自噬信号通路,使ULK1 Ser757和Ser555磷酸化,LC3-Ⅱ表达增加。Kotani等[14]研究发现,反复的电刺激可通过磷酸化自噬启动因子(ULK1)减弱雷帕霉素靶蛋白复合体1(mTORC1)活性,激活自噬体LC3的形成。本研究体外实验结果显示,100μmol/L Dexa处理C2C12细胞24 h后,1.0μmol/L ALN通过上调LC3-Ⅱ/LC3-Ⅰ和Beclin-1蛋白含量,增加肌小管内肌合成蛋白MHC表达,抑制肌降解蛋白MuRF1表达,有效改善Dexa诱导的骨胳肌萎缩,促进骨骼肌再生。ALN对骨骼肌萎缩的逆转,可能与刺激肌小管形成有关。
综上所述,抗骨质疏松药物ALN可以通过上调自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ和Beclin-1表达,抑制肌降解蛋白MuRF1表达,显著预防体外Dexa诱导的细胞肌小管萎缩。
