M2型巨噬细胞外泌体对小鼠自身免疫性肝炎的保护作用
2021-10-12张璐陈黎薇刘曼张洁周璐赵经文王邦茂
张璐,陈黎薇,刘曼,张洁,周璐,赵经文,王邦茂
自身免疫性肝炎(AIH)是一种免疫介导的进行性肝脏炎性疾病,近年来发病率在全球范围内呈上升趋势[1-2]。AIH的发病机制尚不明确,多数患者需终身接受免疫抑制剂治疗,不良反应较大且部分患者不耐受,迫切需要开发针对AIH的新型治疗方法[3-5]。研究发现,巨噬细胞参与AIH的发生和发展,AIH急性期患者肝组织的巨噬细胞活化水平和疾病严重程度呈正相关[6]。外泌体(Exos)是由活细胞分泌的直径为40~160 nm的脂质双层膜囊泡,是细胞间通讯的重要介质[7],其内容物如蛋白质、脂质和核酸等物质由供体细胞转移至受体细胞后可导致靶细胞的功能变化[8-9]。Exos在肝脏炎性疾病及免疫疾病的发生和治疗方面具有重要作用。如脐带来源间充质干细胞Exos可改善白细胞介素(IL)-6引起的小鼠急性肝损伤[10],骨髓来源间充质干细胞Exos可改善小鼠的免疫性肝炎等[11-12]。而M2型巨噬细胞Exos在自身免疫性疾病中的治疗作用尚待进一步探索。刀豆蛋白A(Con A)诱导的小鼠AIH模型是模仿人类AIH的成熟模型,被广泛应用于评估AIH候选药物的活性[13-14]。本研究采用此模型,探讨M2 Exos对其保护作用,为AIH的治疗提供新的思路。
1 材料与方法
1.1 实验材料 RAW264.7小鼠巨噬细胞系购于中国科学院干细胞库。无特定病原体(SPF)级7周龄雌性C57BL/6J小鼠购于北京华阜康生物科技股份有限公司,小鼠自由饮食并置于12 h/12 h明暗周期下饲养,适应环境1周后进行实验。Con A、含DAPI抗荧光衰减封片剂、BCA蛋白试剂盒、FITC标记鬼笔环肽(Phalloidin)均购于北京索莱宝科技有限公司,胎牛血清、DMEM培养基、青霉素-链霉素购于美国Gibco公司,IL-4购于美国PeproTech公司,PKH26红色荧光细胞连接迷你试剂盒购于美国Sigma公司,DiR染料购于美国ThermoFisher公司,丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)测定试剂盒(IFCC法)购于深圳迈瑞生物医疗电子股份有限公司,苏木素-伊红(HE)染色液购于湖北百奥斯生物科技有限公司,FastKing cDNA第一链合成试剂盒购于北京天根生化科技有限公司,SYBR Green RT-qPCR Master Mix购于美国ABI公司,精氨酸酶1(ARG1)、甘露糖受体C1(MRC1)、肿瘤坏死因子-α(TNF-α)和IL-6的实时荧光定量PCR(qPCR)引物委托苏州金唯智生物科技有限公司合成,TSG101抗体和CD9抗体购于英国Abcam公司,抗鼠CD16/32抗体、PE抗鼠F4/80抗体、FITC抗鼠CD11b抗体均购于美国Biolegend公司。HT7700透射电子显微镜购于日本日立公司,NanoSight 300纳米颗粒跟踪分析仪购于英国Malvern公司,Chemidoc XRS凝胶成像系统购于美国Bio-Rad公司,DM5000B荧光显微镜购于德国Leica公司,IVIS Spectrum小动物活体成像系统购于美国PerkinElmer公司,BS-240VET动物专用全自动生化仪购于深圳迈瑞生物医疗电子股份有限公司,荧光定量PCR仪购于美国ABI公司,Optimal-100XP超速离心机、CytoFLEX流式细胞仪购于美国Beckman Coulter公司。
1.2 实验方法
1.2.1 M2型巨噬细胞的诱导 RAW264.7巨噬细胞培养于含有10%胎牛血清、1%青霉素-链霉素的DMEM培养基中。待细胞在T175细胞培养瓶中汇合至30%~50%后,更换培养基为无外泌体血清培养基。用IL-4(20μg/L)刺激24 h后,收集细胞培养上清液。培养过程始终在5%CO2的37℃恒温培养箱中进行。
1.2.2 M2 Exos的提取及鉴定 将收集的M2巨噬细胞培养上清液依次进行300×g 10 min,2 000×g 20 min,10 000×g 30 min梯度离心,收集上清液并用0.22μm滤器过滤。然后以110 000×g超速离心70 min,PBS清洗外泌体沉淀后,再以110 000×g超速离心70 min,获得的外泌体保存于-80℃,所有的过程均在4℃下进行。外泌体的蛋白浓度通过BCA蛋白试剂盒测定。取上述实验所得外泌体20μL,滴于碳支持膜铜网上吸附3 min,再滴加2%磷钨酸负染色3 min,烤干后使用HT7700透射电子显微镜观察并记录图像。将外泌体稀释至1 mL,用NanoSight 300纳米颗粒跟踪分析仪对外泌体的粒径分布及浓度进行检测。取外泌体蛋白样品,通过SDSPAGE分离并转移至PVDF膜上,用含5%脱脂牛奶的TBST封闭后,加入CD9、TSG101抗体于4℃孵育过夜。第2天加入对应二抗室温孵育1 h,使用Chemidoc XRS凝胶成像系统进行信号采集。
1.2.3 M2 Exos的细胞摄取实验 将RAW264.7巨噬细胞接种于24孔板,每孔细胞接种数量约为5×104个,接种3个孔。培养细胞12 h后,每孔加入20μg用PKH26荧光染料标记的M2 Exos,继续培养细胞24 h后,用4%多聚甲醛,0.5%的Triton X-100对细胞进行固定和通透化,用FITC标记的鬼笔环肽室温孵育1 h,DAPI对细胞核进行复染30 s,封片后使用荧光显微镜观察染色结果,全程避光操作。
1.2.4 M2 Exos的体内分布 将DiR染料与PBS稀释的外泌体在室温条件下孵育30 min,然后于4℃,110 000×g离心70 min以去除未结合染料。使用等量的DiR染料与PBS孵育30 min后,于相同条件下超速离心以验证超速离心对染料的去除效果。12只小鼠根据体质量编号后采用随机数字表法分为4组,分别为PBS组、DiR-M0 Exos组、DiR-M2 Exos组和DiR染料对照组,每组3只。M0为未经处理的RAW264.7巨噬细胞分泌的外泌体。每组均给予尾静脉注射Con A(15 mg/kg)。Con A注射完成1 h后,DiR-M0 Exos组、DiR-M2 Exos组和DiR染料对照组分别尾静脉注射相应100μg Exos或者等体积DiR染料,PBS组尾静脉注射等体积PBS溶液。在Exos注射后的1、2、6、24 h,使用IVIS Spectrum小动物活体成像系统拍摄小鼠活体图像(激发光745 nm,发射光800 nm)。注射后24 h将小鼠安乐死,收集肝、脾、心、肺、肾、肠组织进行器官离体成像,观察AIH小鼠体内M0 Exos和M2 Exos随时间变化在各器官分布情况。
1.2.5 动物模型的建立及分组处理 20只小鼠根据体质量编号后采用随机数字表法分为4组,分别为Control组、Con A组、M0 Exos组和M2 Exos组,每组5只。为排除巨噬细胞外泌体自身对AIH小鼠的影响,故设置M0 Exos组作为M2 Exos组的对照。除Control组外,其余小鼠尾静脉注射Con A(15 mg/kg)以诱导AIH,Control组注射等体积PBS溶液。Con A注射完成1 h后,M0 Exos组、M2 Exos组小鼠分别经尾静脉注射200μg M0 Exos、200μg M2 Exos,Con A组和Control组尾静脉注射等体积PBS溶液。
1.2.6 小鼠血清转氨酶检测 Con A诱导造模12 h后,收集小鼠眼眶静脉血,室温静置2 h后,4℃下以3 000 r/min离心20 min,分离血清。使用动物专用全自动生化仪检测小鼠血清ALT和AST水平。
1.2.7 HE染色观察小鼠肝组织病理变化 将小鼠肝组织置于4%多聚甲醛中固定48 h。然后依次进行梯度乙醇脱水、二甲苯透明及石蜡包埋,将组织蜡块制成4μm切片。将切片进行脱蜡复水后,依次进行苏木素染色、1%盐酸乙醇分化、0.2%氨水反蓝和伊红染色,经无水乙醇脱水和二甲苯透明后用中性树胶封片,显微镜下观察小鼠肝脏的病理变化。
1.2.8 qPCR检测ARG1、MRC1、TNF-α和IL-6的mRNA表达 采用Trizol法分别提取RAW264.7巨噬细胞RNA(用于检测ARG1、MRC1)和小鼠肝组织RNA(用于检测TNF-α和IL-6)。用FastKing cDNA第一链合成试剂盒将其逆转录为cDNA,然后使用SYBR Green RT-qPCR Master Mix进行qPCR反应。反应体系:SYBR Green Mix 10μL,上下游引物(10μmol/L)各0.8μL,cDNA 2μL,超纯水6.4μL。反应条件:95℃预变性3 min;95℃变性15 s,60℃退火10 s,40个循环。以GAPDH为内参,采用2-ΔΔCt法计算mRNA的相对表达量,引物序列见表1。

Tab.1 Primer sequence for qPCR表1 qPCR引物序列
1.2.9 流式细胞术检测小鼠肝脏巨噬细胞的亚群变化 小鼠肝组织剪碎后置于Ⅳ型胶原酶中消化,用200目筛网将其过滤为单细胞悬液。然后用30%和70%的Percoll分离液分离出肝脏单个核细胞。向单个核细胞悬液中依次加入封闭用CD16/32抗体,PE抗鼠F4/80抗体、FITC抗鼠CD11b抗体并于4℃下避光孵育。使用CytoFLEX流式细胞仪采集数据,并用CytExpert软件进行分析。
1.3 统计学方法 使用GraphPad Prism 8.0.2软件进行统计分析,计量资料以均数±标准差(x±s)表示,2组间均数比较采用独立样本t检验,多组间均数比较采用单因素方差分析,组间多重比较采用Tukey-q法,P<0.05为差异具有统计学意义。
2 结果
2.1 M2型巨噬细胞的诱导结果 使用IL-4刺激RAW264.7巨噬细胞24 h后,qPCR结果显示,M2型巨噬细胞相关标志基因ARG1和MRC1的mRNA表达水平明显增高(均P<0.01),见表2。

Tab.2 Changes of ARG1 and MRC1 mRNA expression levels in RAW264.7 macrophages in the Control group and IL-4 group表2 Control组和IL-4组RAW264.7巨噬细胞ARG1和MRC1 mRNA表达水平变化 (n=3,x±s)
2.2 M2 Exos的鉴定 纳米颗粒跟踪分析结果显示,M0 Exos和M2 Exos的粒径分别集中于107.5 nm和123.3 nm,均处于40~160 nm范围内,见图1A、B。透射电子显微镜显示,M0 Exos和M2 Exos均具有典型的类圆形双层膜结构,见图1C、D。蛋白质免疫印迹结果显示,其均表达外泌体标志性蛋白CD9和TSG101,见图1E。
2.3 RAW264.7巨噬细胞可摄取M2 Exos 将PKH26标记后的M2 Exos添加到RAW264.7巨噬细胞中继续培养24 h后,可见RAW264.7巨噬细胞的细胞质内呈现明显的红色荧光,见图2。表明M2 Exos可被RAW264.7巨噬细胞摄取。
2.4 M2 Exos在AIH小鼠体内的治疗性分布情况 体内成像系统示,DiR染料对照组没有荧光信号表达,DiR-M0 Exos组和DiR-M2 Exos组的荧光信号在24 h内持续累积,并且主要富集在肝脏,见图3A。为更好地分辨各个器官的Exos荧光信号,在Exos注射后24 h收集小鼠器官并进行离体成像,结果显示,M0 Exos和M2 Exos均在小鼠的肝脏和脾中富集,其他组织未见荧光信号,见图3B。
2.5 M2 Exos对AIH小鼠血清转氨酶的影响 与Control组相比,Con A组血清ALT和AST水平明显升高(P<0.05)。与Con A组相比,M2 Exos组血清ALT和AST显著降低(P<0.05),M0 Exos组血清ALT和AST未见明显变化,见表3。
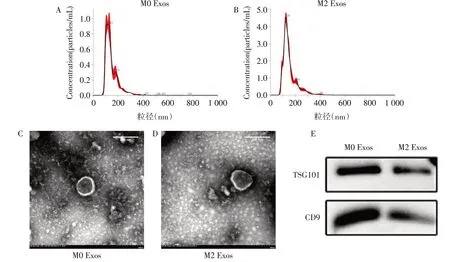
Fig.1 Identification of Exos derived from M0 and M2 macrophages图1 M0 Exos和M2 Exos的鉴定
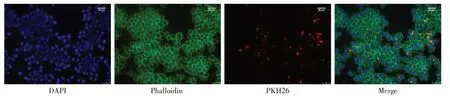
Fig.2 Uptake of M2 Exos by RAW264.7 macrophages(immunofluorescence staining,scale=25μm)图2 RAW264.7巨噬细胞对M2 Exos的摄取(免疫荧光染色,比例尺=25μm)
2.6 M2 Exos对AIH小鼠肝组织病理学变化的影响 HE染色显示,Control组小鼠肝组织结构清晰,肝细胞形态完整,肝板和肝血窦围绕中央静脉呈放射状分布。Con A组肝脏结构紊乱,肝血窦内大量红细胞淤积,汇管区炎性细胞浸润增多,肝细胞不同程度坏死。M0 Exos组肝脏坏死区域较Con A组减少,但仍有较多炎性细胞浸润。M2 Exos组肝脏结构恢复正常,炎性细胞浸润和肝细胞坏死明显减轻,见图4。
2.7 M2 Exos对AIH小鼠肝脏炎性细胞因子的影响 与Control组相比,Con A组小鼠肝组织TNF-α和IL-6mRNA的表达水平均明显升高(P<0.05);与Con A组相比,M2 Exos组小鼠肝组织TNF-α和IL-6mRNA的表达水平均显著下降(P<0.05),M0 Exos组小鼠肝组织TNF-αmRNA水平下降(P<0.05),而IL-6mRNA未见明显变化,见表4。
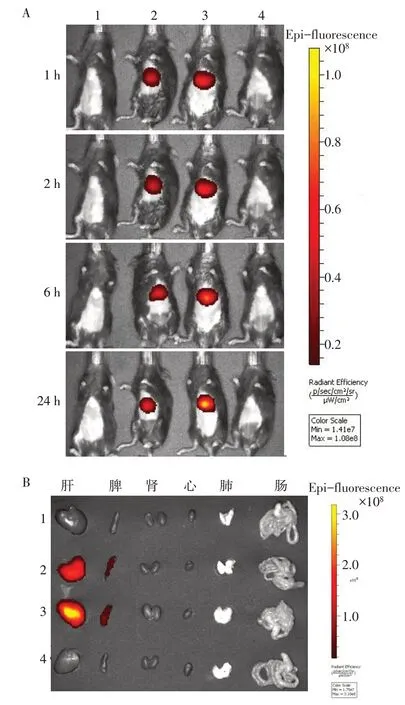
Fig.3 Distribution of Exos after intravenous administration in mice with autoimmune hepatitis图3 经尾静脉注射的Exos在AIH小鼠体内的分布情况

Tab.3 Comparison of serum levels of ALT and AST between the four groups of mice表3 4组小鼠血清ALT和AST水平比较(n=5,x±s)

Tab.4 Comparison of TNF-αand IL-6 mRNA expression levels in liver tissues between the 4 groups of mice表4 4组小鼠肝组织TNF-α和IL-6 mRNA表达水平比较(n=5,x±s)
2.8 M2 Exos可以降低肝脏单核来源巨噬细胞的浸润 使用流式细胞术检测各组小鼠肝脏中的F4/80hiCD11blow枯否细胞(KCs)和F4/80intCD11bhi单核细胞来源巨噬细胞(MoMFs),见图5。相较于Control组,Con A组肝脏单核细胞中MoMFs细胞比例显著升高,KCs细胞比例明显下降(均P<0.05)。相较于Con A组,M2 Exos组肝脏单核细胞中MoMFs细胞比例显著下降,而KCs细胞比例明显升高(均P<0.05),见表5。
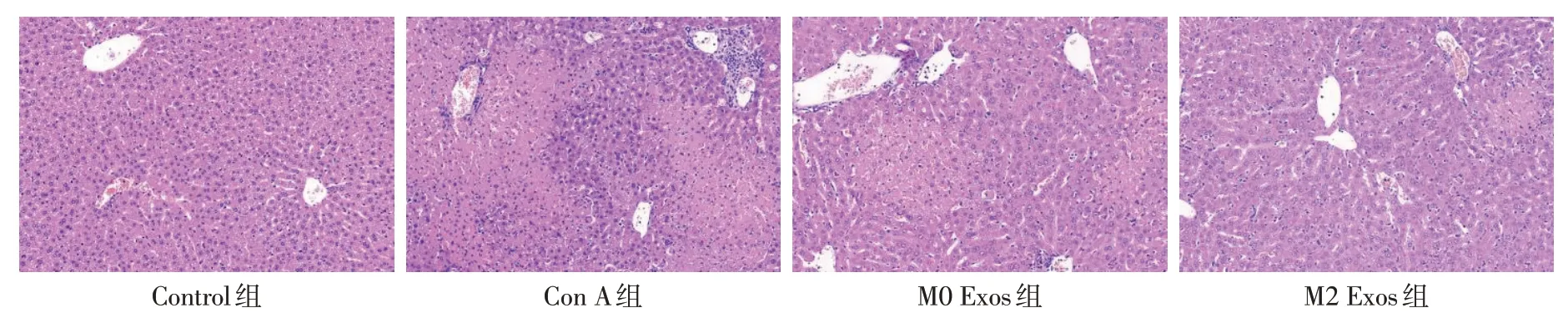
Fig.4 Histological profiles of liver tissue in 4 groups of mice(HE staining,×400)图4 4组小鼠肝组织形态学变化(HE染色,×400)
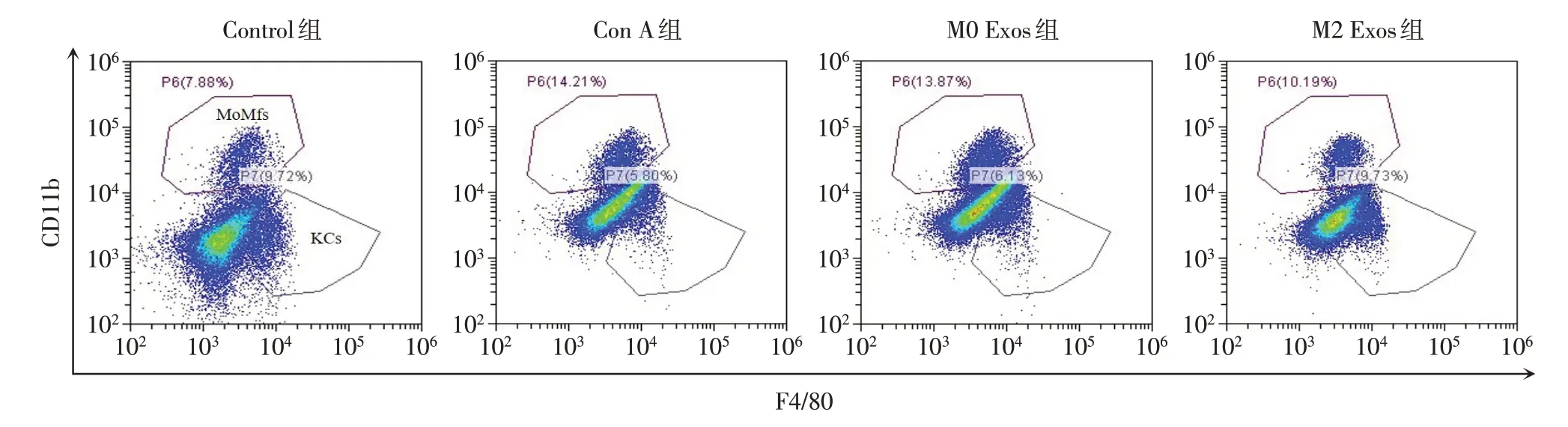
Fig.5 The liver macrophage subsets of four groups detected by flow cytometry图5 流式细胞术检测4组小鼠肝脏巨噬细胞亚群
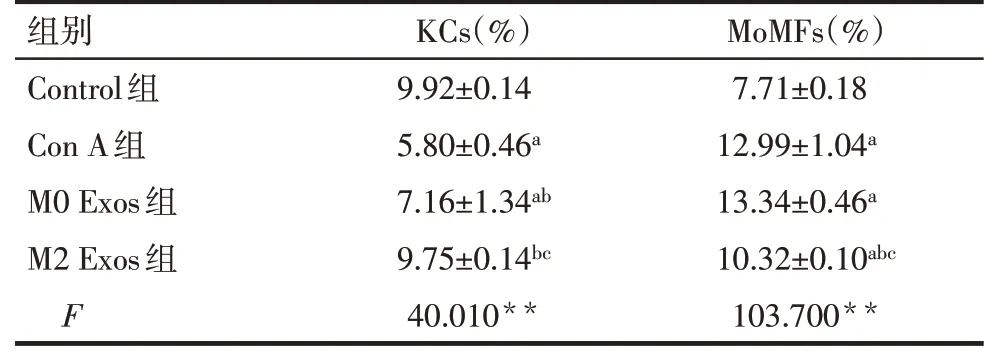
Tab.5 Changes of liver macrophage subpopulations in four groups of mice表5 4组小鼠肝脏巨噬细胞亚群变化(n=5,x±s)
3 讨论
AIH可发生于任何年龄和种族的个体中,通常以女性为主,约25%的病例始于急性肝炎发作,可发展为肝硬化或肝癌。目前AIH具体病因尚不明确,但其主要涉及遗传和环境的相互作用[15]。AIH的组织学特征为门静脉周围的单核细胞浸润,包括淋巴细胞、单核/巨噬细胞及浆细胞等。自身的免疫细胞对肝脏的异常攻击是AIH的发病基础,并最终导致正常肝脏结构的破坏。目前AIH的临床治疗需求是减少长期使用免疫抑制剂的不良反应,同时为标准免疫抑制治疗无反应的患者提供可耐受的替代方案[16-17]。
肝脏巨噬细胞主要由组织驻留的KCs和募集的MoMFs组成,是肝脏中最大的先天性免疫细胞群[18]。活化的巨噬细胞常分为两类,M1型巨噬细胞具有促炎功效,而M2型巨噬细胞可抑制炎症反应并促进组织修复[19-20]。正常情况下,KCs主要通过诱导调节性T细胞的表达来维持机体的免疫耐受状态。当肝脏免疫稳态被破坏时,KCs会极化为M1型来促进炎症反应,同时循环中的单核细胞会被募集进入肝脏并参与肝脏疾病的进展。KCs和MoMfs具有较高的可塑性,可迅速调整其表型以适应肝脏免疫微环境的变化[21]。靶向肝脏巨噬细胞被认为是治疗包括AIH在内的多种肝脏疾病的一个新策略,核心在于调节KCs的活化,MoMfs的募集或两者的极化[22]。
Exos通过将其携带内容物递送给受体细胞,起到调节受体细胞的免疫和炎性状态的作用[23-24]。目前发现多种细胞分泌的Exos具有治疗潜力,如间充质干细胞来源Exos可对小鼠的心肌缺血、结肠炎、实验性免疫性肝炎等疾病起到保护作用[25]。M2 Exos作为具有抑制炎性反应的M2型巨噬细胞释放的外泌体,可以减轻小鼠结肠炎和小鼠大脑缺血再灌注损伤[26-28]。
既往研究表明,通过尾静脉注射的方式,Exos优先在小鼠的肝、肺、脾和肾脏中积累[29]。为了探究M2 Exos在AIH小鼠体内的治疗性分布情况,本研究首先分离并鉴定M2 Exos,并将DiR荧光染料标记的M2 Exos通过尾静脉注射。结果表明,M2 Exos能良好靶向小鼠的肝脏和脾,在24 h内有蓄积效果,且其他组织对其没有明显的摄取作用,提示该种治疗方式可用于靶向治疗肝脏疾病。
为了观察M2 Exos是否对小鼠的AIH有治疗效果,笔者将小鼠随机分为4组,相较于Con A造模组,经M2 Exos治疗后AIH小鼠的血清转氨酶水平明显下降,肝脏病理情况改善。在AIH患者中,肝组织常见促炎细胞因子TNF-α和IL-6的表达水平升高。为了探究M2 Exos对AIH小鼠的保护机制,笔者检测了肝组织炎性因子IL-6和TNF-αmRNA水平以及肝脏巨噬细胞亚群的比例变化,结果显示,M2 Exos治疗可降低肝组织炎性细胞因子的表达水平,减少MoMfs的浸润;在体外,RAW264.7巨噬细胞可大量摄取M2 Exos。
综上所述,M2 Exos可经由静脉循环进入小鼠肝脏,被肝脏巨噬细胞摄取,通过降低肝脏炎性细胞因子的产生及减少对MoMfs的招募来改善小鼠AIH。本研究为AIH的治疗提供了新的思路。
