LncRNA-PVT1/miR-15a/Bmi-1通路调控HGC-27胃癌细胞的体外增殖
2021-10-12侯婧瑛吴雅娴金小岩于霆峰王凌云
侯婧瑛,吴雅娴,金小岩,凌 辉,于霆峰,王凌云
(1.中山大学孙逸仙纪念医院临床研究中心,广东广州510120;2.中山大学孙逸仙纪念医院消化内科,广东广州510120;3.中山大学孙逸仙纪念医院综合科,广东广州510120;4.深圳市人民医院,广东深圳518020)
研究表明长链非编码RNA(long non-coding RNA,lncRNA)在肿瘤的发生发展过程中具有重要调控作用[1-2]。浆细胞瘤变异易位基因1(plasmacy⁃toma variant translocation 1,PVT1)作为lncRNA家族的成员之一,在多种恶性肿瘤中呈高表达,并与不良预后相关[3]。证据显示PVT1在胃癌中呈异常表达并参与了肿瘤的发展进程和不良预后[4-5]。不仅如此,PVT1高表达与胃癌生存及化疗耐药等密切相关,可作为胃癌患者早期诊断和预测预后的标记物[6]。目前PVT1在胃癌中的具体调控机制仍未完全明确。B细胞特异性莫洛氏鼠白血病病毒插入位点-1(B cell specific murrow mouse leukemia vi⁃rus insertion site-1,Bmi-1)是多梳基因家族中的重要成员,在细胞增殖、分化及自我更新中起到了调节作用[7]。研究表明,Bmi-1是胃癌发生发展的一个重要调控因子。Bmi-1过表达能够在体外诱导胃上皮细胞的恶性转化[8],而敲除Bmi-1能够显著促进胃癌细胞衰老、抑制胃癌的生长、侵袭和转移[9-10]。然而,PVT1是否通过调控Bmi-1影响胃癌的生物学行为及具体中间机制如何,仍未见报道。现已证实除lncRNA外,微小RNA(microRNAs,miRNAs)也参与了对肿瘤的调控[2]。miR-15a被报道与胃癌的发生发展、生存和不良预后相关[11]。miR-15a可作为Bmi-1的一个抑制因子,通过靶向下调Bmi-1影响胃癌的临床病理进程包括分化,肿瘤侵袭性及淋巴结转移等[12]。lncRNA作为竞争性内源性RNA(competing endogenous RNA,ceRNA)与miRNA发生相互作用进而调节靶基因的表达,是促进肿瘤发生发展的重要机制之一[1]。最新的一项研究显示,由PVT1介导的ceRNA网络在胃癌的发病机制及生存预后中发挥重要作用[13]。故PVT1是否可作为ceRNA通过靶向抑制miR-15a进而上调Bmi-1,值得进一步探讨。在本研究中,我们在体外观察PVT1对胃癌细胞体外增殖的影响,并探讨ln⁃cRNA-PVT1/miR-15a/Bmi-1通路是否在其中起到调控作用。
1 材料与方法
1.1 细胞系和试剂
胃癌细胞株HGC-27(上海细胞库),293T细胞(中国科学院细胞库);DMEM高糖培养液(Hy⁃clone),胎 牛 血 清(fetal bovine serum,FBS,Hy⁃clone),胰 蛋 白 酶(Hyclone),转 染 试 剂Lipo⁃fectamine2000(Invitrogen),转染试剂Lipofectamine™RNAi MAX(Invitrogen),cellTiter96AQ单溶液细胞增殖检测试剂(Promega),酶标仪(Thermo Fisher Scientific),FACS流式细胞仪(BD公司),96孔板细胞培养板(NEST),巴氏吸管(JET BIOFIL),Bmi-1鼠单克隆抗体(Abcam),辣根过氧化物酶标记的Ⅱ抗(Southern biotech),Ⅱ抗及I抗稀释液(中杉金桥),BCA法蛋白含量检测试剂盒(Abcam),TRIzol RNA提取试剂盒(Santa Cruz),PVDF膜和发光液(Millipore),PVT1小干扰RNA(small interference RNA,siRNA)1#、PVT1siRNA2#,PVT1siRNA NC对照、Bmi-1siRNA1#、Bmi-1siRNA2#,Bmi-1siR⁃NA NC对照,miR-15a模拟物和抑制剂及对照序列合成(广州锐博生物科技有限公司),QuickMutation™基因定点突变试剂盒(碧云天),DpnI酶(Pro⁃mega),psiCHECK-2双萤光素酶报告基因载体、萤光素酶检测试剂盒和Dual-Luciferase ReporterAs⁃say System(Promega)。本研究所有实验操作程序获得中山大学孙逸仙纪念医院伦理委员会批准。
1.2 细胞转染
以5×104cells/well的密度接种细胞,充分摇匀,次日细胞融合度达40%再进行转染。转染方法详见课题组前期已发表文献[2,14]。
1.3 MTS细胞增殖检测
MTS法检测细胞增殖,获取OD490值并计算细胞增殖率,具体检测及计算方法详见课题组前期已发表文献[2,14]。
1.4 qRT-PCR检测
提取总RNA并进行分析。RNA提取、后续具体检测及计算方法详见课题组前期已发表文献[2,14],引物序列见表1。

表1 qRT-PCR引物序列Table 1 The sequence of primersfor qRT-PCR
1.5 PVT1表达载体及其突变载体构建
分析PVT1和Bmi-1基因序列,采用Reg RNA 2.0预测PVT1与miR-15a以及miR-15a与Bmi-1之间的结合位点,在PVT1和Bmi-1合成片段的上下游分别引入酶切位点XhoI和NotI,以及XhoI和PmeI(表2下划线部分所示)。具体合成、连接产物转化、PCR扩增条件、酶切鉴定及质粒测序等参照课题组前期已发表文献[2]。测序结果进行Blast比对确认目的基因(PVT1和Bmi-1)及突变体已成功克隆至psiCHECK-2载体中[2]。扩增引物序列及测序序列见表2和表3。

表2 引物序列Table2 Thesequencesoftheprimers
表3 测序引物序列Table3 Thesequencesoftheprimersforsequencing
1.6 双萤光素酶报告实验
采用293T细胞,阳离子脂质体法进行细胞转染,具体细胞培养及转染方法详见课题组前期参考文献[2]。萤光素酶活性检测采用Promega公司的Dual-Luciferase Reporter Assay System(E1910),具体操作及数据采集方法详见课题组前期参考文献[2,14]。
1.7 统计学处理
采用SPSS 17.0统计软件进行分析,经检验数据符合正态分布,计量资料以均数±标准差(xˉ±s)表示。细胞增殖、mRNA和蛋白表达、以及萤光素酶的结果比较,采用单因素方差分析,组间两两比较采用Bonferroni法,以P<0.05(双侧)为差异有统计学意义。
2 结 果
2.1 PVT1siRNA和Bmi-1siRNA筛选
本研究中,为明确PVT1和Bmi-1的调控功能,我们采用两条不同的siRNA,分别进行不同浓度的筛选,结果显示,PVT1siRNA筛选中,总体差异具有统计学意义(F=1082.00,P<0.001);PVT1siR⁃NA1#在浓度为100nmol/L时,转染后mRNA表达最低,具有最大的抑制效率(P<0.001,图1A)。Bmi-1siRNA筛选中,总体差异具有统计学意义(F=1049.38,P<0.001)Bmi-1siRNA1#在浓度为100nmol/L时,转染后mRNA表达最低,具有最大的抑制效率(P<0.001,图1B)。因此,我们采用PVT1siRNA1#(100nmol/L)和Bmi-1siRNA1#(100 nmol/L)进行后续研究。

图1 PVT1 siRNA和Bmi-1筛选Fig.1 PVT1 siRNA and Bmi-1 siRNA screening
2.2 PVT1、miR-15a和Bmi-1对胃癌细胞增殖的影响
MTS结果显示:在0h以后的不同时间点,抑制PVT1后,各组OD490值在总体差异上均具有统计学意义(24h:F=279.29,P<0.001;48h:F=1796.31,P<0.001;72h:F=328.91,P<0.001);si-PVT1组OD490值和细胞增殖率均低于si-PVT1NC组和空白对照组(n=3,P<0.001,图2B)。转染miR-15a后,各组OD490值在总体差异上均具有统计学意义(24h:F=65.14,P<0.001;48h:F=132.50,P<0.001;72h:F=971.42,P<0.001);miR-15a组OD490值和细胞增殖率均低于miR-15a NC组和空白对照组(n=3,P<0.001,图2C;n=3,P<0.001,图2D)。抑制Bmi-1后,各组OD490值在总体差异上均具有统计学意义(24 h:F=41.60,P<0.001;48 h:F=103.69,P<0.001;72 h:F=291.15,P<0.001);si-Bmi-1组的OD490值和细胞增殖率均低于si-Bmi-1NC组和空白对照组(n=3,P<0.001,图2E;n=3,P<0.001,图2F)。

图2 各组胃癌细胞的增殖情况Fig.2 Detection of gastric cancer cell proliferation in each group
2.3 PVT1对Bmi-1表达的影响
我们采用siRNA转染抑制PVT1的表达后,检测各组PVT1和Bmi-1的表达水平,结果显示:各组PVT1的mRNA表达水平总体差异有统计学意义(F=2 929.50,P<0.001),各组Bmi-1的mRNA和蛋白表达水平总体差异具有统计学意义(F=1 238.36,P<0.001;F=224.84,P<0.001)。si-PVT1组PVT1的mRNA表达量较si-PVT1NC组和空白对照组明显降低(P<0.001,图3A)。si-PVT1组Bmi-1的mRNA和蛋白表达量较si-PVT1NC组和空白对照组明显下降(P<0.001,图3B;P<0.001,图3C、D)。
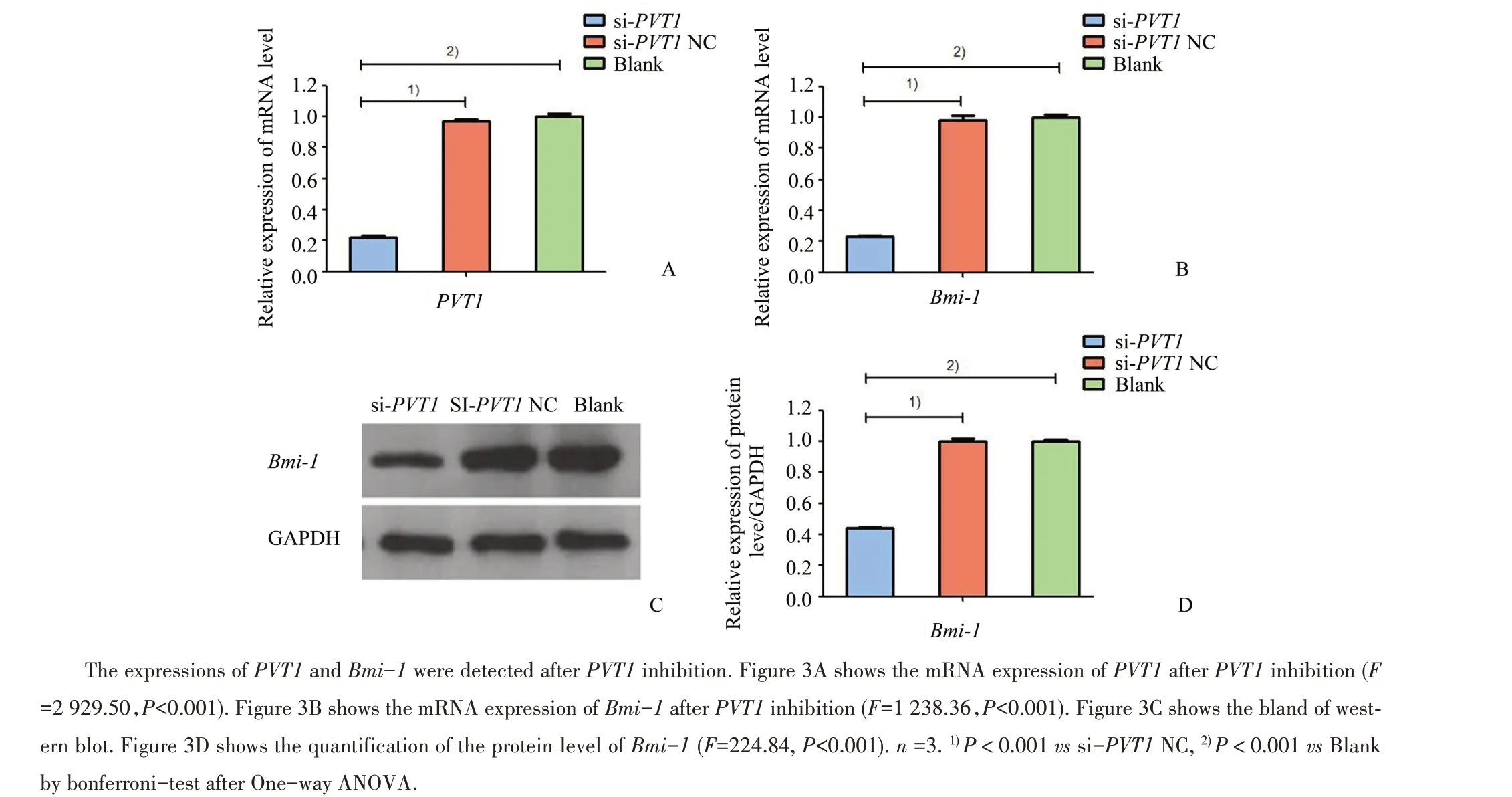
图3 PVT1对Bmi-1表达的影响Fig.3 The effect of PVT1 on the expression of Bmi-1
2.4 萤光素酶报告基因载体的酶切鉴定和测序
psiCHECK-2-PVT1野生型和突变型酶切鉴定及测序、psiCHECK-2-Bmi-1野生型和突变型酶切鉴定及测序结果均显示,目的基因PVT1和其突变型、Bmi-1和其突变型均已成功构建到psiCHECK-2载体中。酶切结果分析可见,PVT1(图4A)、Bmi-1(图4B)在相应的位置切出一条目的条带,psi⁃CHECK-2-PVT1和psiCHECK-2-Bmi-1双荧光素酶报告基因载体构建成功。

图4 重组质粒酶切鉴定和测序Fig.4 Endonuclease digestion and sequence analysis of the constructed recombinant plasmid
2.5 miR-15a对Bmi-1表达的影响
我们采用miR-15a模拟物转染上调miR-15a后,检测各组miR-15a和Bmi-1的表达水平。结果显示:各组miR-15a的mRNA表达水平总体差异有统计学意义(F=6895.93,P<0.001),与miR-15a NC组和空白对照组相比较,miR-15a组miR-15a的mRNA表达量明显升高(P<0.001,图5A)。各组Bmi-1的mRNA和蛋白表达水平总体差异均具有统计学意义(F=1 110.17,P<0.001;F=1 291.23,P<0.001)。miR-15a组Bmi-1的mRNA和蛋白表达量较NC组和空白对照组明显下降(P<0.001,图5B~D)。双萤光素酶报告基因检测结果显示,miR-15a模拟物与Bmi-1野生型或突变型报告基因共转染293T细胞后,在Bmi-1野生型中,各组总体差异有统计学意义(F=1 976.55,P<0.001)。miR-15a模拟物组的双荧光素酶活性与空白对照和NC相比明显降低,下调约32%(P<0.001,图6);在Bmi-1突变型中,miR-15a模拟物组的萤光素酶活性与其阴性对照和空白对照相比,差异无统计学意义(P=1.00,P=0.99,图6),并且miR-15a抑制剂组的萤光素酶活性与其阴性对照和空白对照相比,差异无统计学意义(P=1.00,P=1.00;图6)。
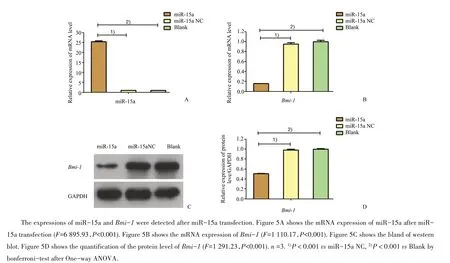
图5 miR-15a对Bmi-1表达的影响Fig.5 The effect of miR-15a on the expression of Bmi-1

图6 miR-15a与Bmi-1靶向关系的双萤光素酶报告基因检测结果Fig.6 The relationship between miR-15a and Bmi-1 tested by promega dual luciferase reporter gene test
2.6 PVT1竞争性结合并抑制miR-15a
我们在采用siRNA转染抑制PVT1的表达后,检测了各组miR-15a的表达水平,结果显示:各组总体差异有统计学意义(F=1 611.92,P<0.001)。si-PVT1组miR-15a的mRNA表达量较si-PVT1NC组和空白对照组明显增高(P<0.001,图7)。双萤光素酶报告基因检测结果显示,在PVT1野生型中,各组总体差异有统计学意义(F=708.55,P<0.001),miR-15a模拟物组的荧光素酶活性与空白对照和NC相比出现明显降低,下调约56%(P<0.001;图8);而在PVT1突变型中,miR-15a模拟物组的萤光素酶活性与空白对照和其阴性对照相比,差异无统计学意义(P=1.00,P=1.00;图8),miR-15a抑制剂组的萤光素酶活性与空白对照和其阴性对照相比,差异无统计学意义(P=1.00,P=1.00;图8)。由此说明,miR-15a可以结合预测的PVT1位点。

图7 PVT1对miR-15a表达的影响Fig.7 The effect of PVT1 on the expression of miR-15a
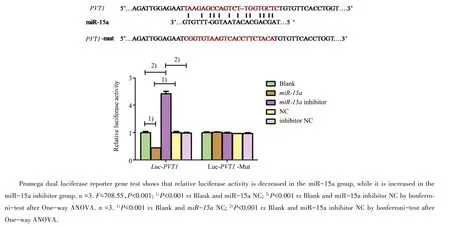
图8 PVT1与miR-15a靶向关系的双萤光素酶报告基因检测结果Fig.8 The relationship between PVT1 and miR-15a tested by promega dual luciferase reporter gene test
2.7 PVT1、miR-15a和Bmi-1三者关系的逆向验证试验
在抑制PVT1的同时加入miR-15a或者miR-15a的抑制剂,再观察Bmi-1的表达变化情况,结果显示:各组PVT1的mRNA表达总体差异有统计学意义(F=984.56,P<0.001),miR-15a的mRNA表达总体差异有统计学意义(F=5 433.56,P<0.001),Bmi-1的mRNA和蛋白表达量总体差异均有统计学意义(F=2 773.18,P<0.001;F=693.01,P<0.001)。与si-PVT1NC组和空白对照组相比,si-PVT1组PVT1的mRNA表达量下降(P<0.001;图9C),miR-15a的mRNA表达量增高(P<0.001;图9D),Bmi-1的mRNA和蛋白表达量均下降(P<0.001;图9A、B、E)。与si-PVT1和si-PVT1+miR-15a inhibitor NC对照组相比较,si-PVT1+miR-15a inhibitor组PVT1的mRNA表达量出现回升(P<0.001;图9A),miR-15a的mRNA表达量下降(P<0.001;图9B),而Bmi-1的mRNA和蛋白表达量均有所回升(P<0.001;图9A、B、E)。与si-PVT1和si-PVT1+miR-15a NC对照组相比较,si-PVT1+miR-15a组PVT1的mRNA表达量进一步降低(P<0.001;图9A),miR-15a的mRNA表达量增加(P<0.001;图9B),而Bmi-1的mRNA和蛋白表达量均出现进一步下降(P<0.001;图9A、B、E)。

图9 PVT1/miR-15a/Bmi-1调控通路的逆向验证Fig.9 The reverse validation of PVT1/miR-15a/Bmi-1 regulatory network
3 讨 论
既往研究显示,PVT1参与对胃癌发生发展的调控,其与胃癌的进展程度、淋巴结侵犯及不良预后相关[5],有学者提出PVT1是胃癌患者诊断和预后的一个潜在生物学标记物[6]。PVT1不仅在体内外促进胃癌生长和扩增,还通过激活STAT3/VEGFA信号通路诱导肿瘤内部的血管形成[15]。PVT1可通过激活凋亡相关基因抑制胃癌细胞凋亡,进而造成胃癌对化疗药物如5-氟尿嘧啶及紫杉醇等产生耐药[16]。在本研究中,我们在体外采用两种不同的siRNA,并进行不同浓度的筛选,在筛选出具有最大抑制效率的siRNA后,我们采用对应的siRNA进行转染抑制PVT1的表达并检测不同组别mRNA表达水平,结果显示si-PVT1组PVT1的mRNA表达水平呈现显著下降,表明PVT1被成功抑制。我们检测不同组别的细胞扩增情况,与既往研究相一致,我们的结果显示,在PVT1被抑制后,OD490值以及细胞增殖率均出现显著下降。以上说明,PVT1能够促进胃癌细胞的体外增殖。于是,我们进一步探索PVT1的具体作用机制。
现已发现Bmi-1参与胃癌的发生发展,其在胃癌组织中呈高表达并与临床病理分期密切相关[10]。此外,循环血中Bmi-1的mRNA表达水平与患者年龄、病理分型、临床分期、分化程度及转移情况呈正相关[17]。鉴于Bmi-1在调控胃癌发生发展及预后中的重要作用,PVT1是否通过调控Bmi-1以及中间分子机制如何,引起了我们的关注。在本研究中,我们体外采用两种不同的siRNA,并进行不同浓度的筛选,在筛选出具有最大抑制效率的siRNA后,我们采用对应的siRNA转染胃癌细胞,并检测OD490值以及细胞增殖率。结果表明,Bmi-1被抑制后,OD490值以及细胞增殖率均出现显著下降。以上说明,Bmi-1能够促进胃癌细胞的体外增殖。我们在PVT1被抑制后,检测Bmi-1的表达,结果显示,Bmi-1的表达水平亦出现显著下调,说明PVT1能够通过正向调控Bmi-1在体外促进胃癌细胞的扩增。于是,我们进一步探索PVT1通过何种机制上调了Bmi-1。
目前已有报道一些miRNAs能够通过下调Bmi-1来抑制肿瘤细胞扩增、侵袭及迁移等。miR-15a在胃癌的发病机制中有潜在作用,且其与晚期肿瘤分级和转移相关[18]。因此,有人提出,临床上可将miR-15a作为胃癌新的治疗靶点和预后标记物[11]。现已发现,miR-15a能够负向调控Bmi-1。miR-15a能够通过直接下调Bmi-1来削弱胃癌细胞的扩增和侵袭性,而通过转染miR-15a抑制Bmi-1的表达后胃癌细胞的生存力和迁移能力出现明显减弱[12]。在本研究中,为验证miR-15a的调节作用,我们在体外培养的HGC-27胃癌细胞株中转染miR-15a的模拟物,观察细胞增殖情况,并进一步检测Bmi-1的表达变化。与既往研究相一致,我们发现,与空白对照及NC对照相比,转染miR-15a后细胞增殖显著下降,而Bmi-1的表达明显下降,表明在胃癌细胞中,miR-15a可下调Bmi-1抑制细胞增殖。我们进一步通过生物信息学网站数据库预测Bmi-1和miR-15a的结合位点,在此基础上,构建含Bmi-1野生型和突变型质粒的双荧光素酶报告载体,并用双萤光素酶报告基因检测分析Bmi-1与miR-15a之间的靶向关系。我们发现,miR-15a转染组Bmi-1野生型报告基因的萤光素酶活性显著降低,miR-15a抑制剂组Bmi-1野生型报告基因的荧光素酶活性则较miR-15a和空白对照及NC组明显增加;而miR-15a模拟物、miR-15a抑制剂以及阴性对照对Bmi-1突变型的表达均无明显影响,以上充分说明了miR-15a能够在胃癌细胞中直接结合并下调Bmi-1。
lncRNA作为ceRNA来调控靶基因的表达,是肿瘤的发生发展中的一个重要调控机制[1-2]。PVT1作为ceRNA参与对胃癌进行调控的系列研究显示,PVT1可通过吸附miR-186解除后者对HIF-1α的抑制作用,进而增强胃癌细胞的扩增能力和侵袭性[19];另外,一项新近的研究报道,PVT1的同型转录本PVT1-214可通过抑制miR-128来上调TrkC进而促进胃癌的进展[20]。然而到目前为止,PVT1是否在胃癌中通过ceRNA作用调控miR-15a,进而引起Bmi-1表达上调,以此进一步影响胃癌细胞的增殖等,现仍未见报道。在本研究中,为了明确PVT1与miR-15a之间的调控关系,我们在体外对胃癌细胞转染PVT1的siRNA抑制其表达,并以空白细胞组和NC为对照,在转染后检测了不同组别PVT1和miR-15a的表达情况,结果显示在采用siR⁃NA抑制PVT1的表达后,PVT1表达明显下调,而miR-15a表达显著上调,表明PVT1能够抑制miR-15a的表达。我们进一步通过生物信息学网站预测PVT1和miR-15a的潜在结合位点,在此基础上,构建含PVT1野生型和突变型质粒的双荧光素酶报告载体,并用双萤光素酶报告基因检测分析PVT1与miR-15a之间的靶向关系。我们发现,miR-15a转染组PVT1野生型报告基因的萤光素酶活性显著降低,miR-15a抑制剂组PVT1野生型报告基因的萤光素酶活性则较miR-15a和空白对照及NC组明显增加;而miR-15a模拟物、miR-15a抑制剂以及阴性对照对PVT1突变型的表达均无明显影响,以上充分说明了PVT1能够靶向结合并下调miR-15a。
在对上述3个因子进行两两关系的验证后,我们进一步采用逆向验证实验明确PVT1/miR-15a/Bmi-1这一调控通路。通过采用siRNA抑制PVT1,并在此基础上加入miR-15a的模拟物或者抑制剂及相应的阴性对照,观察3个指标的表达变化情况。我们发现,在抑制PVT1的基础上同时加入miR-15a的抑制剂后,PVT1和Bmi-1的表达量均出现回升,而miR-15a的表达量则进一步下降;在抑制PVT1的基础上同时加入miR-15a的模拟物后,miR-15a的表达量回升,而PVT1和Bmi-1的表达量出现了进一步降低。综合以上充分表明,PVT1通过靶向下调miR-15a,从而进一步上调了Bmi-1。
综合以上,本研究发现lncRNA-PVT1能够通过靶向结合并抑制miR-15a上调Bmi-1的表达,进而促进胃癌细胞的体外增殖。对lncRNA-PVT1/miR-15a/Bmi-1调控通路的进一步研究,将为胃癌的临床治疗提供新的靶点和突破口。
