Sorafenib通过诱导铁死亡抑制DU145前列腺癌细胞增殖的分子机制
2021-10-12朱芝静姜依凡张迪泽
朱芝静,姜依凡,张迪泽,郭 鹏
(西安交通大学第一附属医院泌尿外科,陕西西安 710061)
前列腺癌是西方国家男性中常见的恶性肿瘤,在美国其发病率居男性肿瘤首位[1]。近年来我国前列腺癌的发病率也有增高趋势。大部分前列腺癌经雄激素剥夺治疗后进展为去势抵抗型前列腺癌,预后较差,目前开发新的前列腺癌治疗药物已成为泌尿外科研究的热点。铁死亡是近几年发现的不同于坏死和凋亡的一种新的程序性细胞死亡方式,其特征是铁依赖的脂质过氧化物积累到致死水平。铁死亡参与肝癌、胰腺癌、前列腺癌和乳腺癌等多种肿瘤的发生发展过程;SLC7A11和GPX4是铁死亡关键的调控基因。Sorafenib是一种阻断细胞内促癌激酶——酪氨酸激酶的靶向药物,已被批准用于肾癌等肿瘤的临床治疗,可有效延长患者的总生存时间。据报道,Sorafenib可作为肝癌细胞铁死亡的诱导剂[2],但是目前Sorafenib对前列腺癌细胞的作用及作用机制尚未完全了解。
本研究的目的旨在探讨Sorafenib是否能诱导前列腺癌细胞发生铁死亡及其机制,为铁死亡诱导剂在前列腺癌治疗中的应用提供实验依据。
1 材料与方法
1.1 细胞株及主要试剂2种人前列腺癌细胞株PC3和DU145均由本院泌尿外科研究所留存,培养在含体积分数为10%的胎牛血清及10 g/L青链霉素的RPMI-1640培养基中(37 ℃,体积分数为5% CO2)。RPMI-1640培养基购自美国Sigma公司,胎牛血清及青、链霉素购自以色列Biological Industrial(BI)公司;BCA蛋白定量试剂盒购自美国Thermo公司,ECL显影液购自中国北京迪宁生物公司;兔抗人GPX4单克隆抗体购自美国Abcam公司,兔抗人SLC7A11单克隆抗体购自美国CST公司,鼠抗人β-actin单克隆抗体购自中国北京康为世纪公司,辣根过氧化物酶标记的山羊抗兔/鼠IgG抗体购自美国Pierce Biotechnology公司;BODIPYTM581/591 C11购自美国Invitrogen公司。Sorafenib、RSL3和FIN56均购自美国Selleck公司。
1.2 细胞生存能力分析将细胞悬液(1.5×104个细胞/mL)接种在96孔板中,每孔200 μL,待细胞贴壁后分别给予Sorafenib(10 μmol/L)、铁死亡诱导剂RSL3(200 nmol/L)和FIN56(200 μmol/L)以及这些药物联合铁死亡抑制剂ferrostatin-1(Fer-1)(1 μmol/L)处理前列腺癌细胞(DU145、PC3)24 h,然后每孔加入20 μL MTT溶液(0.5 mg/mL)并在培养箱中继续孵育4 h。将含有MTT的培养基吸净后,加入150 μL DMSO溶液,低速震荡10 min以充分溶解结晶。酶联免疫检测仪490 nm处测量各孔的吸光度值。
1.3 Western blotting方法检测GPX4和SLC7A11蛋白表达Sorafenib(2.5/5 μmol/L),RSL3(200/500 nmol/L)和FIN56(200/500 μmol/L)处理前列腺癌细胞(DU145、PC3)24 h,提取药物处理后的各组细胞蛋白并定量。使用12%的SDS-PAGE凝胶进行电泳,采用湿转法将蛋白转移到PVDF膜上,室温下用50 g/L脱脂牛奶封闭1 h。根据蛋白质分子量大小将目的条带裁下,然后分别与相应一抗孵育,4 ℃过夜,1×TBST洗膜,10 min/次,共洗3次;与相应的辣根过氧化物酶标记的二抗室温孵育1 h,再用TBST洗膜3次;滴加电化学发光(electrochemiluminescence,ECL)液于聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上,成像系统拍照。
1.4 脂质过氧化物含量测定Sorafenib(5 μmol/L),RSL3(500 nmol/L)和FIN56(500 μmol/L)以及铁死亡抑制剂Fer-1(1 μmol/L)对前列腺癌细胞(DU145、PC3)处理6 h,药物处理结束后,更换为不含药物的新鲜培养基,并按1∶1 000的比例加入BODIPYTM581/591 C11储存液(1.5 mmol/L),轻轻摇晃混匀后放入培养箱孵育20 min。然后离心收集细胞团块并用平衡盐溶液(Hank’s balanced salt solution,HBSS)洗涤3次,用1 mL HBSS液将细胞重悬后进行流式细胞术检测分析。
1.5 统计学分析应用SPSS 22.0软件对数据进行分析,两组计量资料采用t检验,多组计量资料采用方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 Sorafenib通过诱导DU145细胞发生铁死亡抑制其增殖为了检测Sorafenib能否诱导前列腺癌细胞发生铁死亡,分别用Sorafenib、铁死亡诱导剂RSL3和FIN56以及这些药物联合铁死亡抑制剂ferrostatin-1(Fer-1)处理前列腺癌细胞(DU145、PC3)24 h,经MTT检测其细胞活力,发现Sorafenib明显抑制PC3细胞与DU145细胞增殖,而Fer-1能逆转Sorafenib对DU145细胞的抑制作用,却不影响Sorafenib对PC3细胞的抑增殖作用。另外,我们还采用RSL3和FIN562铁死亡诱导剂作为对照组,发现在DU145细胞中RSL3处理后的抑增殖作用能被Fer-1逆转,FIN56效果则不明显;而在PC3细胞中RSL3和FIN56处理后的抑增殖作用均能被Fer-1逆转(图1)。这些结果表明Sorafenib诱导DU145细胞发生铁死亡。
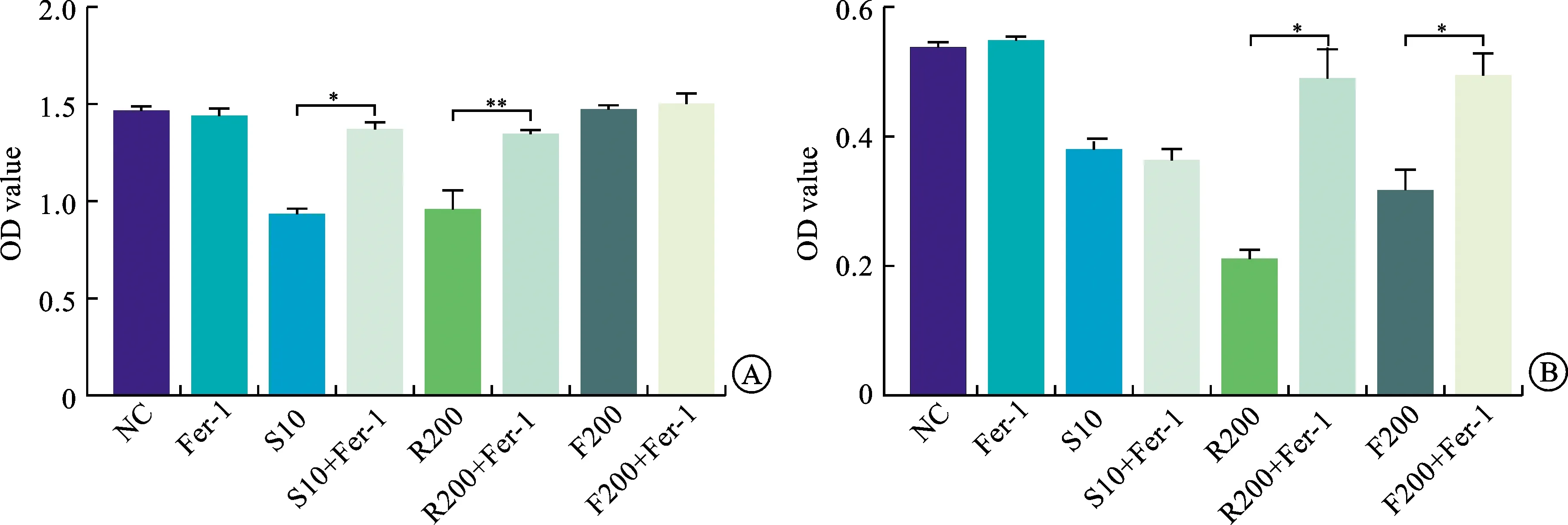
A:对DU145前列腺癌细胞活性的影响;B:对PC3前列腺癌细胞活性的影响,**P<0.01,*P<0.001。
2.2 Sorafenib诱导DU145细胞脂质过氧化物水平上调脂类过氧化是细胞铁死亡的关键步骤,为了探究Sorafenib处理的前列腺癌细胞6 h后细胞内脂质过氧化物水平的变化,我们将细胞与特异性荧光探针BODIPYTM581/591 C11共同孵育,然后通过流式细胞术检测,发现DU145细胞经Sorafenib处理后细胞内脂质过氧化物含量增加,而使用Fer-1处理后下降至基础水平;作为对照组,RSL3处理DU145细胞后脂质过氧化物含量增加,而使用Fer-1处理后下降至基础水平。PC3细胞经Sorafenib处理后细胞内脂质过氧化物含量不变,而经RSL3和FIN56处理后脂质过氧化物含量增加,使用Fer-1处理后下降至基础水平(图2)。Fer-1的这种抑制作用与MTT检测细胞活性时的抑制作用一致。这些结果进一步证明Sorafenib诱导DU145细胞发生铁死亡。
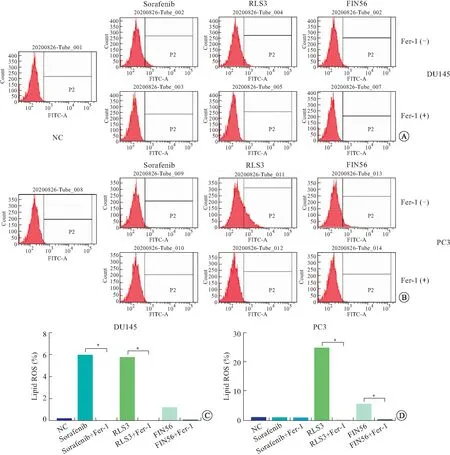
A:流式细胞术检测Sorafenib、RSL3和FIN56对DU145细胞脂类过氧化物水平的影响;B:流式细胞术检测Sorafenib、RSL3和FIN56对PC3细胞脂类过氧化物水平的影响;C:对A图中细胞脂类过氧化物水平的定量分析;D:对B图中细胞脂类过氧化物水平的定量分析(*P<0.001)。
2.3 Sorafenib处理的前列腺癌细胞中SLC7A11蛋白水平明显下调SLC7A11和GPX4是铁死亡关键的调控基因与分子标志物。使用不同浓度Sorafenib处理前列腺癌细胞(DU145、PC3)24 h后,通过Western blotting方法检测,发现Sorafenib处理后DU145和PC3细胞中SLC7A11蛋白水平下调,且呈一定的浓度依赖性,而GPX4蛋白水平未改变;作为对照组,RSL3和FIN56处理后在DU145和PC3细胞中GPX4蛋白水平下调,而SLC7A11表达变化不明显(图3)。这些结果表明Sorafenib诱导DU145细胞发生铁死亡可能主要通过下调SLC7A11蛋白。
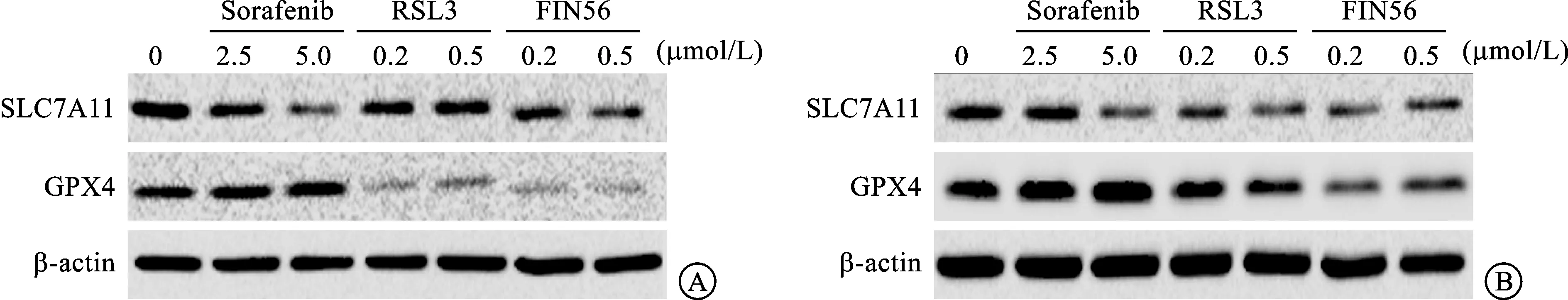
A:DU145细胞蛋白表达水平;B:PC3细胞蛋白表达水平。
3 讨 论
铁死亡是一种非凋亡的细胞程序性死亡形式,可能是由谷胱甘肽(glutathione,GSH)耗竭等代谢应激引起的[3]。铁死亡重要调控蛋白SLC7A11(又称xCT)是构成System Xc-的底物特异性亚基,负责将胱氨酸从细胞外运输到细胞内[4]。研究发现SLC7A11在肿瘤组织中高表达,并且SLC7A11的高表达可以抑制活性氧(reactive oxygen species,ROS)诱导的铁死亡。铁死亡相关酶GSH过氧化物酶4(glutathione peroxidase,GPX4)是唯一能够使用GSH作为电子供体将生物膜中的有毒脂质氢过氧化物还原成相应醇的酶。前列腺肿瘤细胞中过表达GPX4会通过降低ROS水平、增加GSH抑制细胞周期进程和细胞迁移,进而抑制前列腺癌进展[5]。最新研究显示,铁螯合剂去铁胺以防止Sorafenib在肝癌细胞中诱导氧化反应[6]。基于以上事实,我们推测Sorafenib也可诱导前列腺癌细胞发生铁死亡。本课题研究发现,Sorafenib可诱导DU145前列腺癌细胞发生铁死亡。
我们发现Sorafenib只在DU145细胞中诱导铁死亡,铁死亡抑制剂Fer-1能逆转Sorafenib处理DU145细胞后的抑增殖作用(图1A);而Sorafenib无法诱导PC3细胞发生铁死亡。Sorafenib处理DU145细胞与PC3细胞后,2种细胞中的SLC7A11都下调(图3)。SLC7A11的功能是将胱氨酸转运到细胞内还原为半胱氨酸,参与GSH合成;而GSH在GPX4的作用下还原活性氧和活性氮,因此GSH的耗竭和GPX4的活性下降都将造成细胞内脂质过氧化物累积,从而促使细胞发生铁死亡[7]。我们推测由于SLC7A11是铁死亡发生过程的上游节点分子,如果在PC-3细胞中其下游信号通路被阻断,比如胱氨酸的摄取以及GSH的合成受阻,就无法诱发铁死亡;另外,某些关键脂代谢酶如ALOX12缺失或失活也会导致SLC7A11抑制无法诱导细胞铁死亡[8]。可能上述原因导致Sorafenib处理PC-3细胞虽下调SLC7A11表达却未能诱导其发生铁死亡。其中的具体分子机制尚待以后进一步研究。另外,已有研究表明RSL3和FIN56是广泛应用的GPX4抑制剂[9-10]。RSL3和FIN56能在神经元HT22细胞中浓度依赖性抑制GPX4活性和脂质过氧化过程[11]。本研究发现,RSL3抑制DU145细胞与PC3细胞增殖,而Fer-1能逆转RSL3的抑增殖作用和促脂质氧化作用,表明RSL3能够诱导前列腺癌细胞发生铁死亡;另一种对照试剂FIN56与此类似。有趣的是,RSL3和FIN56并不影响DU145细胞与PC3细胞中的SLC7A11表达,表明RSL3诱导铁死亡功能并不涉及SLC7A11,与文献报道一致。总之,本课题发现Sorafenib通过下调SLC7A11蛋白诱导DU145细胞发生铁死亡,而RSL3和FIN56主要通过抑制GPX4诱导前列腺癌细胞发生铁死亡。
氧化应激是指机体氧化与抗氧化系统失衡而发生氧化,当机体受到各种有害物质的刺激时,体内产生过量的以ROS为主的自由基[12],其中ROS可诱导生物膜磷脂中的多不饱和脂肪酸产生脂质过氧化链式反应,造成细胞显著的过氧化损伤和死亡[13]。肿瘤细胞代谢异常旺盛,细胞内产生大量ROS,通过氧化应激反应调控肿瘤细胞的生存和死亡[14]。本研究利用流式细胞术检测发现Sorafenib处理的DU145细胞前列腺癌细胞中脂质过氧化物水平明显增加,而使用Fer-1处理后脂质过氧化物下降至基础水平,表明Sorafenib处理DU145细胞后发生氧化应激反应,诱导细胞发生铁死亡。而Sorafenib处理PC3细胞后细胞内脂质过氧化水平含量不变,也进一步证明PC3细胞中没有发生铁死亡。
本课题研究证实Sorafenib通过下调SLC7A11蛋白水平来诱导铁死亡,从而抑制DU145细胞增殖。但是我们对SLC7A11上下游的信号通路并没有进行探究,其机制尚待探索。此外,随着铁死亡相关研究的逐渐深入,今后人们可能探索更多与铁死亡相关的药物分子是否能用于前列腺癌治疗,有望为PCa治疗提供新的策略。
