肾血管周上皮样细胞肿瘤10例临床分析
2021-10-12陈景勉莫承强王妙燕关键烽
陈景勉,莫承强,王妙燕,关键烽
(1.广东省廉江市人民医院泌尿外科,广东廉江 524400 2.中山大学第一附属医院泌尿外科,广东广州 510000)
血管周上皮样细胞肿瘤(perivascular epithelioid cell tumor,PEComa)是一组在组织学和免疫组化上具有独特表型的间叶源性肿瘤[1],包括血管平滑肌脂肪瘤、镰状韧带的透明细胞肌黑色素细胞肿瘤、淋巴管平滑肌瘤病以及肺、肺外组织透明细胞瘤等[2-4],可发生在身体多个部位,尤以纵隔、肝脏、子宫、肾脏、膀胱、前列腺、胃肠道等多见[5-6]。该肿瘤多发于女性,且多为中青年患者。PEComa在细胞形态学、免疫组化、超微结构和遗传学上都具有独特的特征,因此其诊断主要依据病理。影像学上,PEComa的肿块通常边界较清,可有包膜,密度不均匀,无明显特征性表现。PEComa在组织学形态上主要由脂肪、血管及上皮样肿瘤细胞3种成分构成。目前PEcoma主要依靠手术治疗,常规放、化疗的疗效欠佳,对于巨大肿瘤难以手术以及晚期转移的病例尚缺乏有效的治疗方式。本研究回顾性分析2013年1月至2020年12月中山大学附属第一医院收治的10例经病理确诊为肾PEComa患者的临床资料,归纳其临床特点以加强对该疾病的了解。
1 资料与方法
1.1 一般资料回顾性分析2013年1月至2020年12月中山大学附属第一医院收治的10例肾PEComa的临床资料,包括所有患者的性别、年龄、症状、肿瘤最大径、B超或计算机断层扫描(computed tomography,CT)表现、手术治疗方式及术后随访时间、肿瘤预后(根据术后复查影像学情况确定有无带瘤生存)。10例患者中男性1例,女性9例;年龄29~52岁,平均(32.70±9.71)岁;肿瘤最大径2.5~22.0 cm,平均(7.60±5.67)cm;肿瘤位于左侧7例,右侧3例;1例因患侧腰痛而就诊,其中9例因体检发现。手术切除术后所有患者均未行放化疗、免疫抑制等辅助治疗。
1.2 检查方法肾PEComa从影像学上不易诊断,主要依据病理学诊断,所有患者术后标本均使用体积分数为4%的中性缓冲甲醛液固定,然后石蜡制片,经苏木精-伊红(HE)染色后镜下观察。免疫组化采用链霉菌抗生物素蛋白-过氧化物酶连结法,对HMB45、Melan-A等进行染色。由2名病理医师分别检查、报告及审核,病理分型参考2016年WHO肾细胞癌病理分类标准。
1.3 术后随访所有患者均需长期随访,采用门诊及电话随访相结合,每3~6个月进行1次,连续3年,之后每年1次至术后5年,5年后每2年随访1次,随访内容主要为复查腹部超声或腹部CT,最后一次随访时间为2020年12月。
2 结 果
2.1 患者临床及影像学表现所有患者的标本经病理最终确诊为肾PEComa,均采用手术治疗,其中5例行肾部分切除术,3例行根治性肾全切除术,1例行根治性肾全切除术+腹膜后淋巴结清扫术,1例行根治性肾全切除术+腹膜后肿瘤切除术。10例肾PEComa中,男女比例差异较大,男∶女为1∶9。肿瘤位于左肾偏多,左肾及右肾各为7例(70%)和3例(30%)。
B超或CT表现不典型,与其他良恶性肿瘤往往难以鉴别,影像学无特征性表现。术前6例患者行泌尿系超声检查,其中4例肿瘤表现为高回声,1例肿瘤表现为低回声,1例肿瘤表现为等回声,边界均清。9例患者术前行CT平扫及增强检查:7例表现为肾占位性病变,考虑肾癌可能性大,增强后为均匀或不均匀强化,或呈“快进快出”表现;1例考虑左肾肿物,乏脂肪瘤与肾细胞癌鉴别;1例提示左侧腹膜后巨大肿物,考虑脂肪肉瘤合并出血可能,并左肾局部受侵犯。另1例行MRI检查,考虑右肾上极巨大肿瘤,低度恶性肿瘤。患者临床资料见表1。
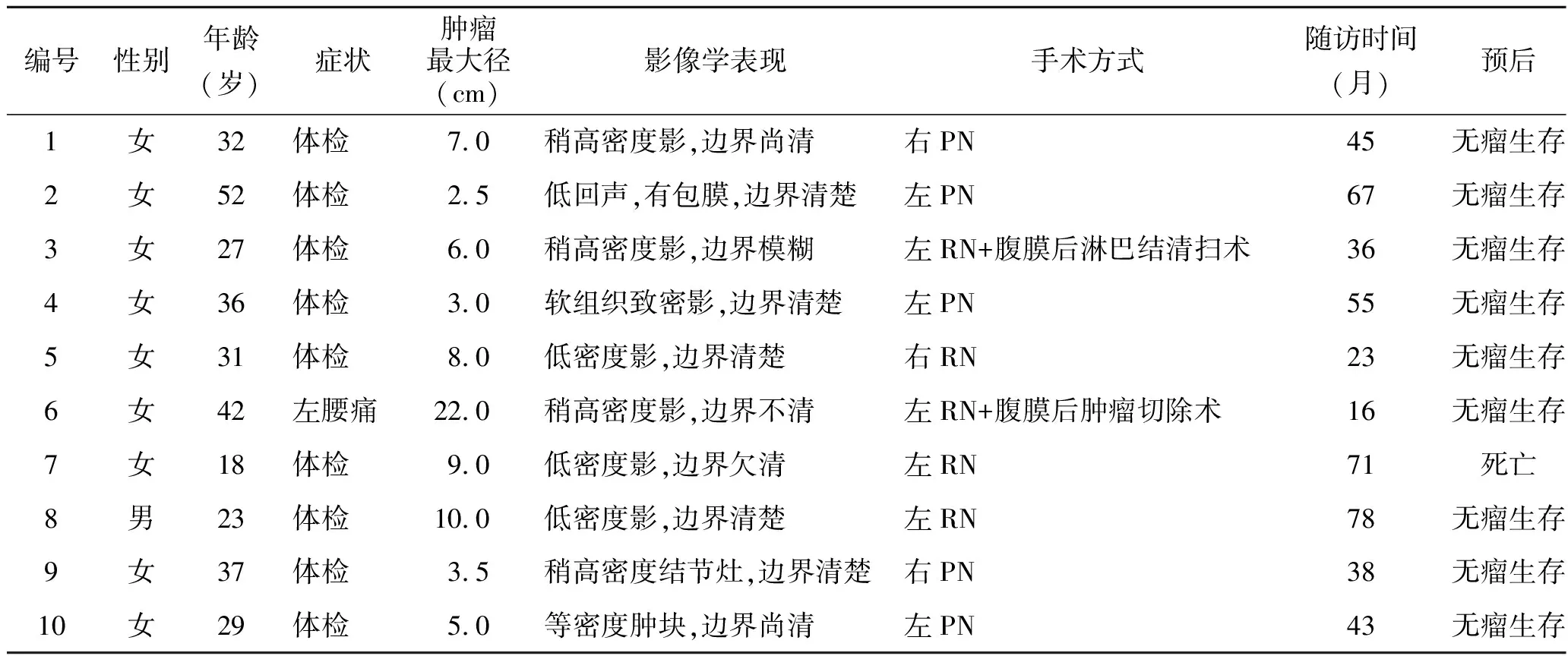
表1 10例肾PEComa患者的临床资料
2.2 患者病理学特征10例病理诊断均为肾PEComa。镜下可见肿瘤组织与肾组织分界尚清,但未见明显包膜,肿瘤细胞排列呈片状,局部呈腺泡样,细胞体积大,胞质丰富红染或透明,部分胞质内可见色素颗粒,核圆形,部分细胞核仁明显,局部可见不规则厚壁血管(图1)。10例患者中8例免疫组化染色检查示HMB45阳性、8例Melan-A阳性、8例Actin灶性阳性、6例Vimentin阳性、2例Desmin阳性、1例CD34阳性、1例S-100阳性、Ki-67呈不同程度表达(1%~5%)可考虑为阴性。手术方式PN、RN各占 5例(50%)。术后随访时间为16~78个月,平均随访(47.2±20.4)个月,1例(10%)术后71个月死亡(死亡原因不明);其余9例(90%)均未见转移或复发。
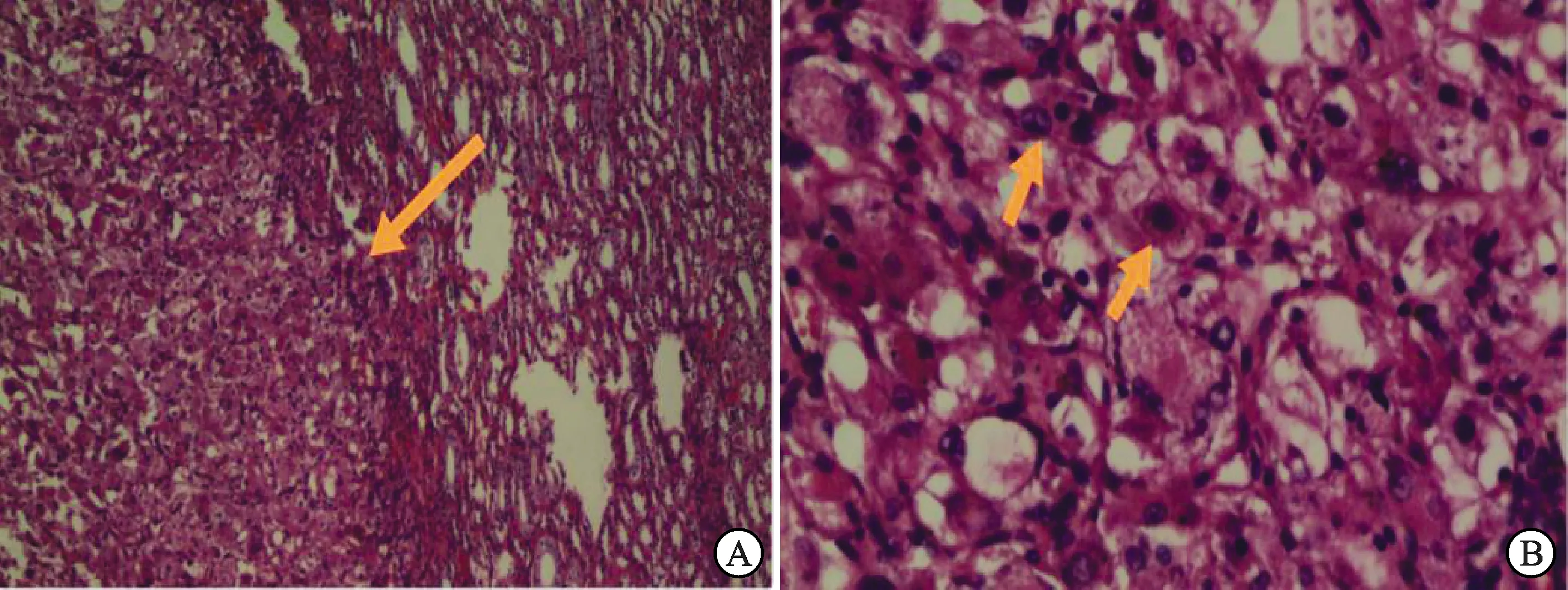
A:片状排列肿瘤细胞(HE,×4,橙色箭头所指);B:肿瘤细胞(HE,×20,橙色箭头所指)。
3 讨 论
PEComa临床罕见,由ZAMBONI等[7]于1994年首先将所有具有血管周上皮样细胞这一细胞类型的病变家族命名为PEComa。PEComa是一类由血管性上皮样细胞组成的间充质肿瘤,具有上皮样肿瘤表现,胞质透明嗜酸性,肿瘤细胞沿血管周围分布[8]。王功伟等[9]指出PEComa患者男女比例为1∶3.2,发病年龄16~76岁,平均51.3岁,以中年最为多见,肿瘤最大径0.6~30.0 cm,平均6.6 cm。本研究10例患者中男女比例为1∶9,平均年龄(32.70±9.71)岁,肿瘤平均最大径(7.60±5.67)cm,这与文献报道稍有偏差,可能为样本量较少所致。肾PEComa的患者始发症状不明显,多因体检而发现,偶有腰部疼痛或血尿而就诊的患者[10]。本研究中9例患者因体检而发现,1例表现为患侧腰痛,2例术前尿常规隐血阳性,无肉眼血尿。影像学检查对肾PEComa诊断有一定参考价值,但并没有特征性表现。超声检查表现为高回声、低回声或等回声,多数边界清楚。CT则表现为高低混杂密度占位影为主,密度不均匀,增强扫描呈均匀或不均匀强化,或为“快进快出”表现,与肾癌难以鉴别。MRI表现为生长异常信号肿块影,T1呈等信号,T2压脂呈等、稍低信号,反相位片未见明显低信号区,DWI、ADC见病灶弥散受限,增强扫描显示病变内部微小、曲折的血管以及异常的供血动脉或引流静脉有助于 PEComa 的诊断[14]。
肾PEComa主要依据病理诊断。肾PEComa肉眼观的形态往往是:肿瘤呈不规则形,切面灰黄、灰红色,可见包膜;而镜下观主要由弥漫成片分布的梭形细胞构成,细胞异型性不明显,胞质丰富,核分裂象少见,局部可见肿瘤细胞围绕血管呈放射状排列。若肿瘤细胞生长活跃,细胞胞质丰富嗜酸,核仁明显,可见多核瘤巨细胞,核分裂易见,并存在散在分布的多核巨细胞,这提示恶性可能,临床注意密切随访[11]。因血管周上皮样细胞具有色素和肌源性分化,因此PEComa通常表达色素细胞标记和平滑肌标记,联合应用色素标记和肌源性标记对PEComa的诊断起关键作用。肿瘤细胞表达的色素细胞标记物主要有HMB45、Melan-A,一般不表达S-100,而表达的肌源性标记物主要有SMA、Desmin等[12]。因此,其免疫组化特点通常为:黑色素细胞源性标志物HMB45、Melan-A常为阳性,Vimentin、Desmin、SMA也可阳性表达,而S-100和CK通常为阴性[12]。
本研究中HMB45、Melan-A、Actin灶性、Vimentin、Desmin、SMA、CD34、S-100和CK阳性率分别为:80%、80%、80%、60%、20%、10%、10%、10%、0%,与国内外相关研究基本相符。本研究中Ki-67呈不同程度表达(1%~5%),其指数较低,表明肾PEComa恶性程度较低。
目前,手术切除作为肾PEComa的首选治疗方案,腹腔镜或机器人辅助对比开放手术具有术野清晰、操作简便、创伤小、恢复快等优点,故常常为首选手术方式。而对于肿瘤破裂出血、内生性生长或巨大肿瘤患者,建议行开放肾部分切除术或全切术。有研究指出,肾PEComa由于其恶性潜能,甚至有远处转移,目前大多数研究均推荐以手术切除为主,必要时辅以其他治疗[13]。既往认为术后放化疗效果甚微,但有研究表明术后使用阿霉素联合异环磷酰胺化疗可防止病情恶化[14]。有研究认为,部分PEComa可能与结节性硬化症(tuberous sclerosis,TSC)相关,涉及TSC1或TSC2基因突变,突变后会异常激活mTOR通路,促进细胞增殖和血管生成,而在一些与TSC无关的PEComa中也可存在这一通路改变,因此推测PEComa可以从mTOR抑制剂(如西罗莫司、依维莫司等)治疗中受益[15]。免疫治疗效果方面目前国内外研究较少,仍有待今后前瞻性研究验证。除此之外,有研究显示部分PEComa还可能与TFE3基因重排有关,在这部分患者的PEComa中细胞核可弥漫性强表达TFE3,这也为PEComa的靶向治疗方向提供了新的靶点[16]。
综上所述,肾PEComa临床上少见,特征不明显,影像学检查难以确诊,病理为诊断金标准,首选手术切除治疗,放化疗效果欠佳。肿瘤切除术后大多数预后较好,发生复发、转移情况较少。对于晚期或转移性PEComa的患者可考虑应用mTOR抑制剂或抗血管生成药物进行辅助治疗。
