猪源粪肠球菌对常用抗菌药物的耐药性分析及其酰胺醇类耐药基因的检测
2021-10-11伊思达高懿陈丽黄金虎王晓明王丽平南京农业大学动物医学院江苏南京210095
伊思达,高懿,陈丽,黄金虎,王晓明,王丽平(南京农业大学动物医学院,江苏 南京 210095)
肠球菌(Enterococcus)虽在人类和动物消化道内广泛定植,但也是造成人发生院内感染的重要病原菌之一。临床分离的肠球菌以屎肠球菌(E.faecium)和粪肠球菌(E.faecalis)为主,主要引起人泌尿系统、皮肤组织、腹腔和脑部感染。肠球菌有较为坚厚的细胞壁,能对许多抗生素产生固有耐药性[1]。目前,因抗菌药物的广泛应用造成的选择性压力,肠球菌的耐药性也不断增强,尤其是耐万古霉素肠球菌(vancomycin-resistantEnterococci,VRE)的出现,给人类的感染治疗带来巨大挑战,目前VRE菌株已被WHO列为严重威胁人类健康的超级细菌之一[2-3]。中国耐药监测网2015—2018年的数据显示,粪肠球菌对氨苄西林、高浓度庆大霉素、利福平、环丙沙星、红霉素、呋喃妥因、替考拉宁的耐药率均低于屎肠球菌,对氯霉素的耐药率显著高于屎肠球菌;粪肠球菌对呋喃妥因和氨苄西林的耐药率仍保持较低水平,但对红霉素和利福平的耐药率均在55%以上[4-7]。近年来研究显示,动物源性肠球菌不仅会导致动物出现相关感染,而且会成为肠道菌群中耐药基因转移的供体菌,由于肠球菌存在通过食物链传播给人以及成为耐药基因水平转移供体库的风险,会对食品安全与人类临床抗感染治疗造成威胁,因而备受关注,故对粪肠球菌在内的肠球菌进行长期的耐药性监测也具有重要的公共卫生意义[8-10]。
酰胺醇类抗生素(phenicols)包括氯霉素、甲砜霉素以及氟苯尼考,在临床抗感染治疗中对多种革兰阳性菌和革兰阴性菌及支原体均有较强抗菌活性[11]。随着该类抗菌药在兽医临床上的广泛应用,动物源性粪肠球菌对其耐药率也日趋上升[12-14]。肠球菌不仅是人畜共患机会致病菌,而且其耐药相关可移动遗传元件的种内、种间的水平转移可促进耐药性的水平扩散,给动物和人类以及公共卫生安全造成极大的威胁。因此,对动物源性粪肠球菌进行长期的耐药性监测有助于我们掌握该菌耐药性变迁的情况,可为抗菌药物的合理使用提供参考,并进一步为深入研究细菌耐药产生和传播机制提供理论基础。
1 材料与方法
1.1 样品
2016—2017年间,在江苏省苏北地区10个猪场共采集300份肛门拭子样品。其中,2016年采集120份样品,2017年采集180份样品。
1.2 主要试剂和药品
四环素、红霉素、青霉素G、万古霉素、链霉素、庆大霉素,购自阿拉丁(Aladdin)公司;麻保沙星、利福平、氟苯尼考,购自阿达玛斯(Adamas)公司;氨苄西林、利奈唑胺,购自麦克林(Macklin)公司;肠球菌肉汤、肠球菌琼脂、胰蛋白胨大豆肉汤、阳离子调节MH肉汤、脑心浸液琼脂,购自青岛海博生物;1×TE buffer、50×TAE(用前稀释至1×),购自 Biosharp 公司;2×TaqMaster Mix,购自南京诺唯赞生物科技有限公司;Gold view核酸染料,购自南京百斯凯科技有限公司;DNA Maker、琼脂糖,购自日本TaKaRa公司。
1.3 方法
1.3.1 菌株的分离与鉴定
取肛门拭子样品于肠球菌肉汤培养基中培养12 h,并于肠球菌琼脂平板上分离培养,挑取菌落周围变为褐色的菌落培养,保存并粗提取菌株DNA用于粪肠球菌PCR反应模板。其中特异性引物为:5′-ATCAAGTACAGTTAGTCTTTATTAG-3′和5′-ACGATTCAAAGCTAACTGAATCAGT-3′。目的片段大小为941 bp。反应程序:94 ℃ 5 min;94 ℃ 30 s,54 ℃ 30 s,72 ℃ 45 s,35个循环;72 ℃ 10 min[15]。
1.3.2 药敏试验
根据美国临床和实验室标准协会(Clinical and Laboratory Standard Institute,CLSI)推荐的微量肉汤稀释法测定了11种抗菌药对临床分离的猪源粪肠球菌及质控菌株金黄色葡萄球菌ATCC29213(购自中国药品生物制品检定所)的最小抑菌浓度(MIC)[16]。
1.3.3 酰胺醇类耐药基因检测
采用PCR的方法检测氟苯尼考耐药粪肠球菌中酰胺醇类耐药基因fexA、fexB、floR、cfr和optrA。PCR反应体系:2×TaqPCR Master Mix 10 μL,10 μmol·L-1的上、下游引物各1 μL,DNA模板2 μL,加灭菌三蒸水至20 μL。按参考文献合成的各基因引物序列及退火温度,产物片段大小见表1。对扩增的阳性PCR产物进行测序验证,确证为待检基因。

表1 检测耐药基因的引物序列
2 结果与分析
2.1 粪肠球菌的分离率
2016—2017年从苏北地区10个养猪场的300份猪肛门拭子中分离粪肠球菌230株,分离率为76.7%。其中2016年样品中分离到89株粪肠球菌,2017年样品中分离到141株粪肠球菌。
2.2 粪肠球菌对11种抗菌药物的耐药率分析
230株粪肠球菌对各种药物的耐药率情况见表2,其中,氟苯尼考耐药菌株为223株,耐药率高达97.0%,仅次于四环素(100%)和红霉素(98.3%),对其他药物的耐药率分别为庆大霉素78.7%、链霉素75.2%、麻保沙星70.9%、利奈唑胺54.8%、利福平30.4%、氨苄西林1.7%、青霉素G 0.4%,未检测到万古霉素耐药菌株。

表2 猪源粪肠球菌临床分离株对11种抗菌药物的耐药性 (n=230)
对临床分离的粪肠球菌的多药耐药情况进行分析,多药耐药菌株的分布情况如图1所显示,结果显示所有耐药粪肠球菌均为多药耐药菌株,其中大多数对5~8种药物耐药,尤以6耐为主,达27.8%(64株),另有1株菌表现为同时对10种抗菌药物耐药。

图1 猪源粪肠球菌的多药耐药菌株分布
2.3 不同年代分离粪肠球菌对11 种抗菌药物的耐药性比较
进一步比较了2016和2017年分离的粪肠球菌对11种抗菌药物的耐药率(图2),结果显示2017年分离的猪源粪肠球菌对兽医临床常用抗菌药物青霉素G和人医临床常用的抗菌药物利福平均高于2016年分离株,而对其他抗菌药物的耐药率略有下降或持平。
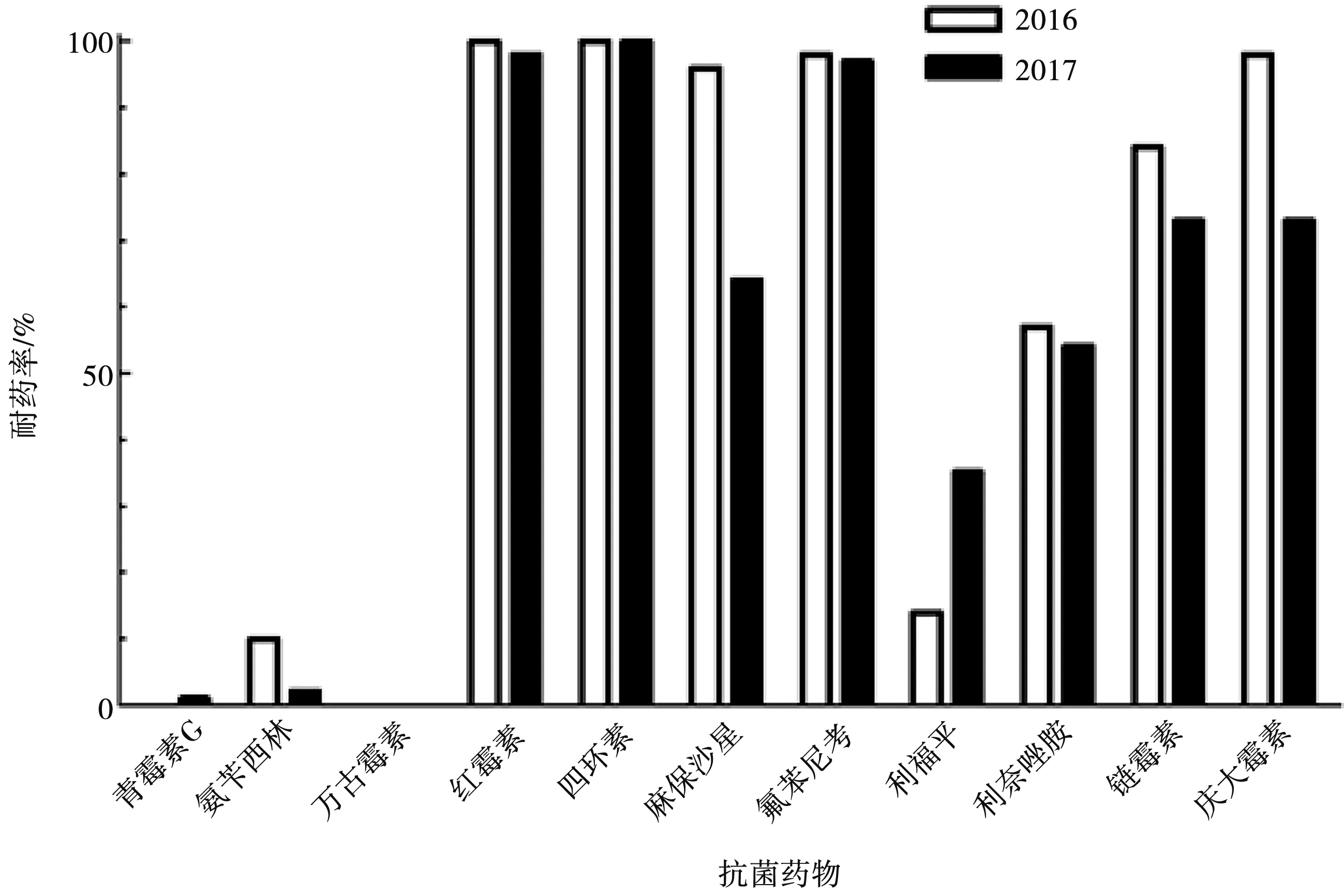
图2 2016 年和2017 年分离粪肠球菌对常用抗菌药物的耐药率比较
2.4 猪源粪肠球菌酰胺醇类耐药基因的检出率分析
对230株粪肠球菌进行耐药基因fexA、fexB、floR、cfr、optrA的检测,结果如图3所示。
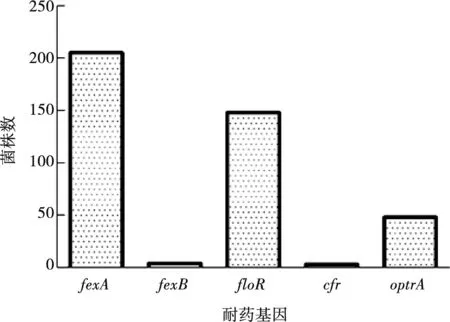
图3 猪源粪肠球菌的耐药基因检出数
223株氟苯尼考耐药粪肠球菌中,30.5%(68/223)的菌株携带1种耐药基因,55.2%(123/223)的耐药菌株携带2种耐药基因,12.1%(27/223)携带3 种耐药基因, 0.9%(2/223)的菌株携带4种耐药基因,1.4%(3/223)的菌株不携带上述任何一种耐药基因。氟苯尼考耐药的粪肠球菌耐药基因谱型见表3所示,最常见的基因谱型为fexA+floR(44.8%),其次为fexA(24.7%),另有2 株粪肠球菌同时携带4 种酰胺醇类耐药基因,表现分别为cfr+optrA+fexA+floR和optrA+fexA+fexB+floR。

表3 氟苯尼考耐药粪肠球菌的酰胺醇类耐药基因谱
3 讨论
肠球菌因具有独特的天然耐药机制以及丰富的耐药相关水平转移元件,如质粒、转座子等,易发生耐药基因的水平传播而获得耐药性,因此常被认为是耐药基因的传递体[20-21],故了解肠球菌耐药性变迁,遏制耐药菌株流行传播尤为重要。根据CHINET 的报导[4-7, 22],粪肠球菌对红霉素与利福平的耐药率均处于一个比较高的水平(>55%)。本试验中的猪源性粪肠球菌对红霉素(98.3%)和利奈唑胺(54.8%)的耐药率均高于同年人分离菌株对红霉素(64.0%)与利奈唑胺(1.9%)的耐药率,但人源性粪肠球菌对四环素的耐药率(69.5%~81.8%)低于猪源性粪肠球菌(100%)[23-26],推测其主要原因为人与猪抗菌药物的用药环境差异,并且由于近年来人医抗感染治疗中抗生素的使用管控较为严格,抗生素使用减少,而相对于人医,兽医抗感染治疗仍存在着抗生素滥用、管控不严格等现象,也是猪源性粪肠球菌耐药率普遍高于人源性粪肠球菌的重要原因。值得注意的是,猪源性粪肠球菌的氟苯尼考耐药率高达97.0%,这种极高的耐药率在之前的报道中从未出现过,可能与氟苯尼考作用兽医常用广谱抗生素广泛用于猪的细菌性疾病的治疗有关。在本次样品中利奈唑胺耐药菌株的分离率较高(54.8%),而利奈唑胺作为人医临床专用抗菌药物,未被批准用于动物,其耐药性的产生与菌株携带的耐药基因optrA相关。研究发现该基因可同时使菌株对氟苯尼考的敏感性下降,故利奈唑胺耐药性的产生可能与氟苯尼考在养猪业中的广泛使用有关[19]。在本次苏北猪场分离的猪源性粪肠球菌中未发现VRE,这并不意味着可以放松警惕,万古霉素作为抗革兰阳性菌感染最后一道防线,仍需要严格防控万古霉素耐药菌株以及万古霉素耐药基因的传播以及转移。多重耐药的出现给临床抗感染带来了极大的挑战[27-28]。在本次分离的猪源性粪肠球菌中多为多药耐药菌株,其中以5~8耐为主,这就表明一些传统的联合用药治疗方法可能会失去意义。上述信息应该引起高度的重视,相关部门应该完善相关法律法规严格控制抗生素的使用,一线医护人员应严格遵守抗生素使用规范并采取有效的感染防治措施防控、防止耐药菌株大范围传播,科研人员应定期实时跟踪细菌耐药性的变化。
由于氟苯尼考在兽医临床中的重要地位,本研究对其耐药基因fexA、fexB、floR以及多药耐药基因cfr进行进一步检测。fexA、fexB、floR为外排泵基因,其编码的外排泵蛋白可同时介导氯霉素与氟苯尼考的耐药;cfr基因编码的则可以编码23S rRNA甲基化酶并同时提高菌株对酰胺醇类、噁唑烷酮类、林可霉素类、截短侧耳素类和链阳菌素A等5类药物的耐药水平[11-12,14,17];optrA基因编码的ATP结合盒(ATP-binding cassette,ABC)转运蛋白则能够赋予对利奈唑胺和泰地唑胺以及酰胺醇类的可转移抗性[19]。上述基因均可以通过转座子、质粒在多种类型的肠球菌,葡萄球菌以及一些阴性菌中转移[29-30]。本试验中,223株分离的氟苯尼考耐药粪肠球菌中,152株携带2种以上的耐药基因,说明了氟苯尼考耐药机制的复杂性,多种耐药机制相互协同提升耐药水平。有3株氟苯尼考耐药菌中未发现相关耐药基因,推测可能有其他耐药机制,值得进一步探究。
