lnc-005028序列及其在鹅肥肝形成中的作用
2021-10-15陈雪霏唐彬铖胡博刘贺贺胡继伟胡深强韩春春何桦王继文李亮
陈雪霏, 唐彬铖,胡博,刘贺贺,胡继伟,胡深强,韩春春,何桦,王继文,李亮
( 四川农业大学动物遗传育种与繁殖研究院,四川 成都 611130 )
肝脏作为脂质代谢的主要器官之一,对脂质具有吸收、合成、氧化和分泌的能力,并且这些过程都会影响肝脏的脂质含量[1]。当肝脏中甘油三酯(TG)含量超过肝脏总重量的5%时,TG的生成速度快于极低密度脂蛋白(VLDL),临床上将其定义为脂肪肝。脂肪肝存在于许多动物中,如长途迁徙的野鸟和哺乳期的奶牛[2]。作为候鸟的后代,鹅具有从重度脂肪肝中恢复的能力,且无明显的病理症状[3],表明鹅存在一种调节机制能保护其肝脏免受严重脂肪肝的影响。在实际生产中,鹅肥肝是对鹅进行短时间碳水化合物填饲导致大量 TG 沉积于肝脏的产物,富含不饱和脂肪酸(60%以上)、人类必须氨基酸和卵磷脂,具有降血脂、降胆固醇和预防心脑血管等疾病的功能[4]。相反,哺乳动物非酒精性脂肪肝(NAFLD)是一种代谢性疾病,通常伴有炎症和肝硬化。中国长三角等发达地区NAFLD患病率逐年上升,而肥胖是导致哺乳动物脂肪肝的主要原因[5],若患者还伴随有糖尿病等疾病,机体内环境和免疫系统功能受损,不能清除异常的变异细胞,还会发生癌变[6]。与哺乳动物中的NAFLD类似,鹅脂肪肝与能量摄入过多(如高糖或高脂饮食)有关[7],表明鹅可能与哺乳动物存在一些共同之处,使得鹅成为肝脏脂质代谢独特的研究模型。因此,通过对鹅肝脂质代谢调节机制的研究,可为NAFLD以及鹅肥肝的形成提供借鉴和参考。
长非编码RNA(long non-codingRNAs,lncRNAs)是长度大于200 nt且不编码蛋白质的RNA转录本。lncRNA可通过与DNA、RNA或蛋白结合在表观遗传、转录及转录后水平控制基因的表达,因此与mRNA相比更具有多样性,功能更繁复[8]。随着高通量测序等先进技术的发展,越来越多lncRNA的调控作用被发现并用于相关疾病的治疗,包括X-染色质激活、p53介导的细胞凋亡、癌症转移以及重新编程诱导多能干细胞,其作用范围几乎涉及到生命活动的所有方面[9]。目前,在脂质代谢方面,已通过RNA-seq和生物信息学分析鉴定了许多与脂质代谢相关的lncRNA。如在鸡腹部脂肪前体细胞分化的不同阶段发现了1 336个差异表达的lncRNAs,涉及糖脂代谢、哺乳动物雷帕霉素靶蛋白(mTOR)、过氧化物酶体增殖物激活受体(PPAR)和丝裂原活化蛋白激酶(MAPK)等信号通路[10]。通过对填饲前后的鹅肝进行高通量测序发现302个差异表达的lncRNAs,其中lnc-005028表达水平在填饲后发生了显著下降[11]。然而,这些脂质代谢相关的lncRNA在家禽上的功能研究很少。因此,进一步开展脂质代谢相关lncRNA的功能研究,可为探讨lncRNA调节家禽脂质代谢的机制提供参考和借鉴。本试验将研究lnc-005028的序列及其在鹅肥肝形成过程中的可能作用,可为研究鹅肥肝形成机制提供新的参考。
1 材料与方法
1.1 试验动物
所有动物处理程序均经四川农业大学动物福利委员会批准,所用试验动物四川白鹅来源于四川农业大学家禽饲养试验场。将12只14周龄健康四川白鹅公鹅随机分为填饲组和对照组,每组6只,其中填饲组所用饲料为煮熟并盐渍的玉米(14 MJ/kg,9%蛋白质和0.45%脂肪)、0.4%水禽脂肪和水,填饲步骤参照文献[12];对照组自由采食,饲料喂煮熟玉米。在过度喂养期间,所有的鹅都可以自由饮水。保持室温15~18 ℃,湿度70%~80%,持续2周,最后12 h仅为2组试验动物提供自由饮水,在试验第14天时取填饲组和对照组四川白鹅的部分肝脏、心脏、肾脏、腿肌、胸肌、皮脂和腹脂于2 mL离心管,储存于-80 ℃冰箱待用。
1.2 lnc-005028的克隆与序列分析
引物采用Primer Premier 5软件(Primer Biosoft International, Palo Alto, USA)设计并由北京六合华达基因科技有限公司(中国)合成(表1)。将纯化的PCR产物连接到pMD19-T载体(TaKaRa, Japan)中,转化为大肠杆菌DH5α细胞后冰浴30 min,接着42 ℃水浴45 s,冰浴2 min,随后移入800 mL液体培养基,37 ℃摇床,速度150 r/min,45 min后取出菌液,8 000 r/min离心5 min,弃800 mL上清液后,混匀分散打到固体培养基上,用涂抹棒向一个方向画圆涂抹均匀,放入37 ℃恒温箱,30 min后翻板,12 h后挑菌,37 ℃摇床,速度175 r/min,时间不少于4 h。阳性克隆产物由北京六合华大基因科技有限公司筛选测序,测序得到的cDNA片段用Editseq和Seqman编辑组装(DNAStar, Inc., Madison, USA)。
1.3 鹅原代肝细胞分离与培养
将8日龄禁食12 h后的四川白鹅静脉注射戊巴比妥钠(每千克体重30 mg)使其完全昏迷,再静脉注射肝素钠(100 IU/kg)。腹部切开后取出全肝,立即用37 ℃生理盐水清洗表面。用100 mL 0.05% IV型胶原酶灌流液(GIBCO, USA)反复灌流至包膜下组织裂开,撕开后膜,切肝,置37 ℃水浴中振荡10 min。摇匀后加入含10%胎牛血清(Clark, Australia)的5 mL高糖培养基DMEM(GIBCO,USA)终止消化,200 目无菌过滤器过滤。滤液在室温下以950 r/min离心2 min,用含10%胎牛血清的DMEM稀释沉淀后,以细胞3×105个/mL的密度接种于12孔细胞培养板中。5% CO2和37 ℃下培养6 h后用PBS洗涤3次,用含有10%牛血清白蛋白(BSA)和2% BSA的DMEM稀释棕榈酸(0.2、0.4、0.6、0.8 mmol/L)和油酸(0.25、0.5、0.75、1 mmol/L)并对原代肝细胞进行处理,对照组仅用10% BSA和2% BSA的DMEM 处理,24 h后用PBS清洗并收集原代肝细胞。每个试验均设置3个重复。
1.4 总RNA提取和荧光定量RT-PCR(qRT-PCR)检测
根据TRIzol(Invitrogen, USA)说明书对组织和细胞样品的总RNA进行提取和纯化,并分别用1.5%琼脂糖凝胶电泳和紫外分光光度法(UV-1201; Shimadzu, Japan)检测总RNA的数量和质量。qRT-PCR扩增反应混合物(12.5 mL)中含有6.25 mL SYBR®PremixExTaqTMⅡ(TaKaRa, China),各0.5 mL正反向引物(10 mmol/L),1 mL cDNA和4.25 mL ddH2O,ddH2O代替引物反应作为空白对照。将混合物500 r/min离心5 min后,95 ℃预变性3 min;95 ℃变性30 s,特定温度下退火30 s,72 ℃延伸30 s,共34个循环;最后72 ℃延长10 min。设计引物:脂肪酸氧化相关基因:肉碱棕榈酰转移酶1(CPT1)、PPARα;TG合成相关基因:二酰基甘油酰基转移酶2(DGAT2)、长链脂肪酸延长酶(ELOVL6);促进炎症基因:白细胞介素-6(IL-6);促进凋亡基因:半胱氨酸蛋白酶3(caspase-3)(表1)。使用Roche LightCycler®480 Ⅱ(Roche, Switzerland)对阴性对照(ddH2O为模板)进行PCR扩增,并通过β-actin和GADPH对基因表达数据进行标准化。

表1 qRT-PCR引物序列
1.5 统计分析
基因的相对表达水平用标准化相对定量法和2-ΔΔCt法计算。使用IBM SPSS统计软件(Version 22.0, 2014)Student’st检验法进行分析。所有结果以“平均值±标准差”表示。
2 结果与分析
2.1 序列信息与蛋白质编码能力
通过测序结果发现lnc-005028共有1 066 bp,将获得的序列与NCBI(https://blast.ncbi.nlm.nih.gov/Blast.cgi)上鹅转录组NW_013185654.1:10248135-10249201的序列相对比,匹配率为99.34%,差异表现为MN_.1:n.234A>G,MN_.1:n.628C>T,MN_.1:n.898T>A,MN_686114.1:n.898T>A。
通过ORFfinder(http://www.ncbi.nlm.nih.gov/orffinder) 在lnc-005028中共发现18个开放阅读框(ORF),长度均小于200 nt,所有正义短肽(+)均与同源蛋白不匹配(表2)。已将lnc-005028的具体序列提交给NCBI,检索号为MN686114。
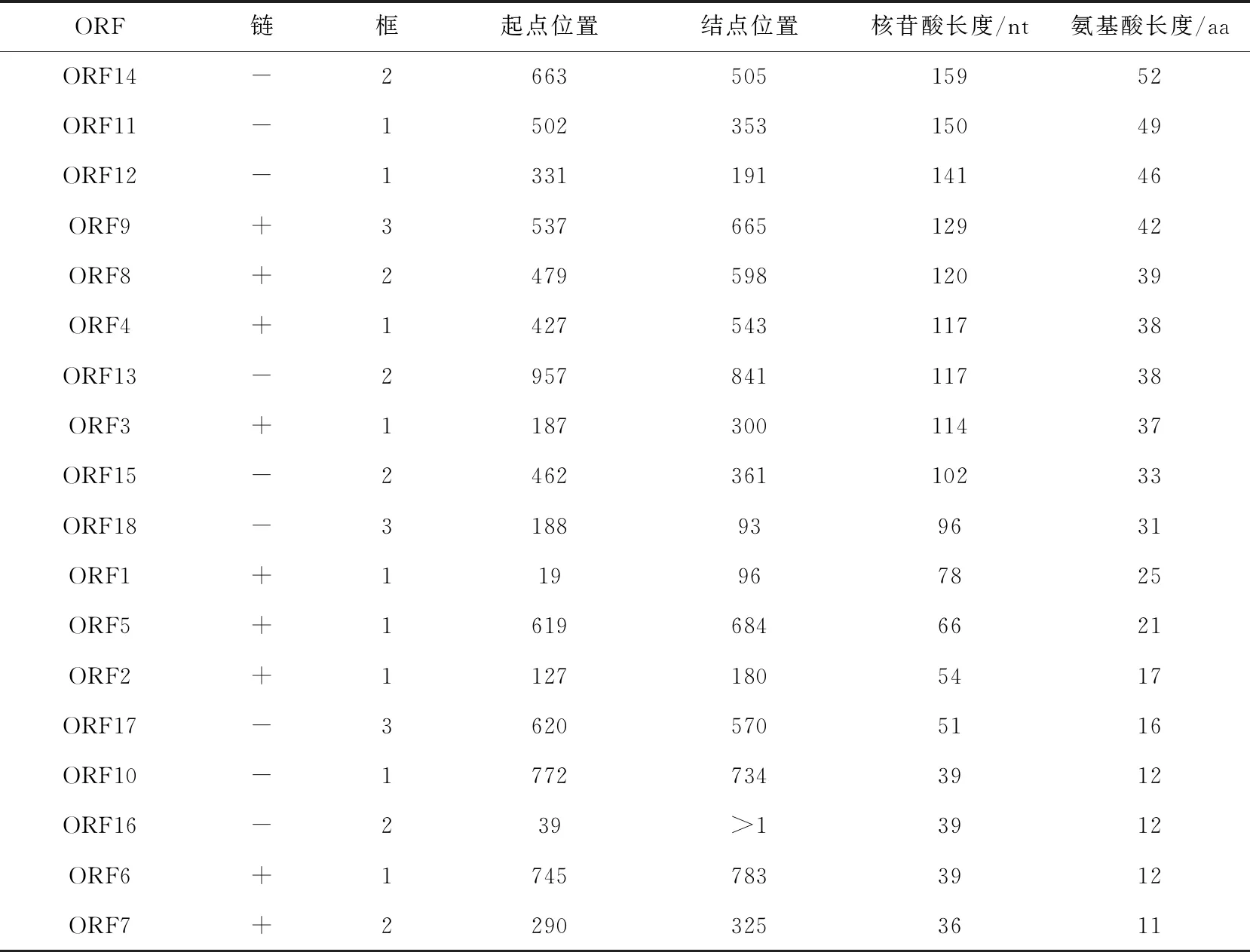
表2 lnc-005028序列中的ORF
2.2 填饲对lnc-005028的影响
lnc-005028在填饲组和对照组四川白鹅的肝脏、肾脏、心脏、胸肌、腿肌、皮脂和腹脂中均有表达(图1)。在对照组中,lnc-005028在肝脏中的表达水平极显著高于其他组织(P<0.01)。与对照组相比,填饲组鹅肝脏中lnc-005028表达水平出现极显著下降(P<0.01),但肾脏、脾脏、心脏、胸肌、腿肌、皮脂和腹脂中lnc-005028表达量均出现极显著上升(P<0.01)。在填饲组中,肝脏中lnc-005028的表达量与皮脂无显著性差异(P>0.05),但仍极显著高于其他组织(P<0.01)。

相同组织组间比较,大写字母不同表示差异极显著(P<0.01);同一处理组不同组织与肝脏相比,**表示P<0.01
2.3 棕榈酸对鹅原代肝细胞lnc-005028的影响
根据qRT-PCR研究结果,lnc-005028在鹅原代肝细胞中的表达水平不随油酸浓度的增加而变化(P>0.05)(图2A),而在棕榈酸的处理下,lnc-005028呈现出先升高后降低的趋势,在0.2 mmol/L时表达量达到最高,在0.6 mmol/L时达到最低(P<0.01)(图2B)。随后在不同浓度棕榈酸处理过的鹅原代肝细胞中检测了caspase-3、CPT1、DGAT2、ELOVL6、IL-6和PPARα,结果发现,PPARα、caspase-3和IL-6 在0.2 mmol/L棕榈酸浓度下均显著升高(P<0.01),但只有caspase-3在0.4和0.6 mmol/L时显著下降(P<0.01),在0.8 mmol/L时与对照组无显著差异(P>0.05)(图2C)。

与对照(NC)组相比,*表示P<0.05,**表示P<0.01
3 讨论
分子生物学研究的焦点以往大部分集中在蛋白质编码基因上,lncRNA在发现之初被认为是基因转录噪音而一直被忽视。除了ORF,lncRNA一般与mRNA无生化区别,但其长度普遍更短,具有较少且较长的外显子,一级序列保守性低,细胞特异性、组织特异性和不同发育阶段的疾病特异性更强[13]。先前的研究通过高通量测序发现lnc-005028属于鹅的lncRNA,本试验确定lnc-005028总长1 066 bp,在鹅的肝脏中特异性高表达,且ORF均无蛋白编码能力,再一次验证lnc-005028属于鹅lncRNA一员。
lncRNA控制代谢组织的发育和功能,包括棕色和米色脂肪细胞分化、肝脏脂质代谢、骨骼和心肌发育等,是多种生物过程中必不可少的调节因子[14]。lncRNA可通过调节细胞生长、凋亡、神经疾病进展和癌症转移成为脂质代谢的调控因子,尤其是调控脂肪生成、脂肪酸、胆固醇和磷脂代谢和转运,以及高密度脂蛋白(HDL)和低密度脂蛋白(LDL)的形成,从而参与脂肪肝的发生发展[15]。肝脏在多种代谢调控中起着举足轻重的作用,包括葡萄糖和脂质代谢、胆汁酸合成、异生化合物的解毒功能以及大量血浆蛋白的分泌[16]。肺腺癌转移相关转录子1(MALAT1)是最早发现的与癌症转移和预后有关的lncRNA,能通过上调沉默调节蛋白(SIRT1)[17]或作为miR-101b的ceRNA调节Rac1的表达[18]。在丙型肝炎病毒感染引起的肝纤维化中,转化生长因子-β(TGF-β)活化lncRNA(ATB)与β-catenin 表达均增加[19]。肝癌上调基因(HULC)是第一个在肝癌细胞中特异性高表达的lncRNAs,它诱导miR-9启动子的CpG岛甲基化,并在转录后水平下调miR-9靶向PPARα的能力。lncRNA不仅可以促进肝脏的纤维化,也可以抑制脂肪肝的形成。研究发现,用四氯化碳诱导人与鼠的肝脏发生纤维化后,母系印记基因3(MEG3)表达水平明显下降,过表达MEG3能激活p53并介导细胞色素C的释放,从而引起caspase-3依赖的造血干细胞(HSCs)凋亡[20]。lncLSR可以抑制VLDL介导的TG代谢,减少胰岛素抵抗的发生,抑制脂肪肝[21]。本试验对四川白鹅进行填饲后,lnc-005028在鹅肝中的表达发生了显著下降,不再呈现组织特异性,提示肝脏脂质代谢的状态可以影响lnc-005028的表达。在细胞试验中,经棕榈酸处理的原代肝细胞lnc-005028表达水平变化趋势与鹅肝不同,而油酸没有显著性影响,这是因为虽然脂肪酸形成相关因子均会促进TG沉积,引起细胞变形,但并非所有因子对同一基因调控结果一致[22]。
在鹅肥肝生成过程中,脂肪酸合成通路中的功能蛋白,如乙酰辅酶羧化酶(ACC)、脂肪酸合成酶(FAS)、超长链脂肪酸延伸蛋白6(ELOVL6)等在TG在肝中快速沉积后,mRNA的表达水平均出现一个显著下调的过程[23]。李富原等[24]将填饲鹅与对照鹅的转录本进行对比,发现352个lncRNA存在显著差异,其中212个表达量显著上升,且LOCl06047490与鹅肥肝的形成密切相关,受高葡萄糖、胰岛素和不饱和脂肪酸的诱导[25]。鹅肝形成过程中涉及脂肪酸氧化、TG合成、炎症和凋亡等方面。本试验发现,不同浓度棕榈酸处理下,CPT1、 ELOVL6、DGAT2、PPARα和IL-6 表达水平变化趋势与lnc-005028存在差异性,唯有caspase-3表现出一致性。蛋白水解酶的激活是凋亡程序的一个特征,包括ced-3/ICE家族中的某些胱氨酸蛋白酶,而caspase-3是胱氨酸蛋白酶的ced-3/ICE家族成员,参与通过B淋巴细胞瘤-2(Bcl-2)家族诱导的凋亡途径,caspase-3抑制剂可降低MG132诱导的细胞凋亡[26]。此外,caspase-3参与了HIV-Env介导的细胞凋亡[27],是HIV-gp41介导的细胞凋亡中活性氧(ROS)生成的关键调节因子[28]。lnc-005028受饱和脂肪酸调节,与棕榈酸影响的caspase-3表达一致。以上结果提示lnc-005028可能通过凋亡途径参与鹅原代肝细胞脂质代谢,但其具体调控机制有待进一步研究。
