血清凋亡相关斑点样蛋白水平在儿童急性发作期支气管哮喘中的变化及意义
2021-10-11余佳佳陈利琴陈泽杰
余佳佳,陈利琴,陈泽杰
1.潮州市人民医院普儿一科,广东潮州521000;2.梅州市人民医院儿内一科,广东梅州514000
支气管哮喘是以慢性气道炎症为特征的可逆性气流受限的变态反应疾病[1]。儿童哮喘分为过敏性哮喘、感染性哮喘、运动型哮喘、药物型哮喘、咳嗽变异性哮喘,常于5岁前发病,治疗不及时可导致气道不可逆的狭窄和重塑[2]。凋亡相关点样蛋白(ASC)与天冬氨酸特异性的半胱氨酸蛋白水解酶-1(caspase1)、Nod样受体热蛋白结构域相关蛋白3(NLRP3)共同组成NLRP3炎症小体,参与哮喘慢性炎症的发生和发展[3]。NLRP3在哮喘发作时激活,利用接头蛋白ASC,激活caspase1,促进白细胞介素1β(IL-1β)、白细胞介素18(IL-18)等炎症介质的释放。IL-1参与T细胞等固有免疫,是过敏性哮喘和感染性哮喘等急性发作的重要指标,且与哮喘患者的病情严重程度相关[4]。ASC作为NLRP3炎症小体重要成分,通过调控IL-1β、IL-18来调节机体细胞免疫,参与支气管哮喘发作[5],但是关于ASC在急性发作期支气管哮喘中的水平变化及临床意义尚不明确,该研究在2019年6月—2020年6月纳入的48例急性发作期支气管哮喘儿童和30名健康儿童就此展开研究,现报道如下。
1 资料与方法
1.1 一般资料
方便选择医院收治的48例急性发作期支气管哮喘儿童作为观察组,30名同龄健康体检儿童作为对照组。观察组男27例,女21例;平均年龄(10.7±3.1)岁。对照组男15名,女15名;平均年龄(9.4±3.5)岁,两组性别和年龄等一般资料比较,差异无统计学意义 (P>0.05),具有可比性。支气管哮喘的诊断依据《儿童支气管哮喘诊断和防治指南(2016年版)》[6]。纳入标准:5~18岁的急性发作期支气管哮喘儿童;患儿家属知情同意。排除标准:合并结核、严重感染、自身免疫疾病者;研究期间自动退出者;病情变化不适合继续研究者。该研究开展得到医院医学伦理委员会批准。
1.2 方法
观察组在急性发作期支气管哮喘治疗前、哮喘临床缓解后2个月,对照组则选择纳入研究后随机采集外周血5 mL,3 500 r离心20 min,小心吸取上清。ASC测定采用人凋亡相关斑点样蛋白ELISA检测试剂盒,IL-18、IL-1β的测定采用IL-18 ELISA检测试剂盒、IL-1βELISA检测试剂盒。
1.3 观察指标
①ASC:包括组间和治疗前后ASC水平变化以及ASC与IL-18、IL-1β的相关关系。
②ASC与治疗效果相关性:观察组ASC的水平分为高水平组和低水平组,比较两组间疗效等级差异。
③ASC对疗效预测的效能:将ASC作为独立预测指标,绘制接受者操作特性曲线(ROC曲线)进行分析。
1.4 疗效评估标准
急性发作期支气管哮喘儿童在治疗开始后进行2周观察。疗效标准[6]:显效:症状明显减轻,发作次数明显减少,睡眠质量提高,第1秒用力呼气容积(FEV1)增值>25%;有效:症状有所减轻,发作次数减少,偶尔出现间歇性急喘,需使用药物缓解,FEV1增值15%~25%;无效:哮喘症状和发作次数无明显变化,甚至加重,FEV1无变化。
1.5 统计方法
2 结果
2.1 观察组和对照组ASC、IL-18、IL-1β水平比较
治疗前观察组、治疗后观察组及对照组间ASC、IL-18,以及IL-1β 水平比较,差异有统计学意义(P<0.05)。观察组治疗前和治疗后ASC、IL-18,以及IL-1β水平均显著高于对照组,差异有统计学意义(P<0.05),见表1。
表1观察组和对照组外周血ASC、IL-18、IL-1β水平比较[(±s),pg/mL]

表1观察组和对照组外周血ASC、IL-18、IL-1β水平比较[(±s),pg/mL]
指标 观察组治疗前(n=48)观察组治疗后(n=48)对照组(n=30)ASC IL-18 IL-1β 46.71±19.91 230.89±76.17 51.41±22.98 9.76±3.79 79.97±30.78 23.71±11.88 7.65±2.99 13.43±8.38 8.08±3.36
2.2 ASC水平与IL-18、IL-1β水平关系
治疗前ASC水平与IL-18、IL-1β水平均呈正相关(r=0.926、0.635,P<0.001),见表2。
2.3 ASC高水平组和低水平组ASC水平对治疗效果比较
治疗前,ASC高水平组的疗效等级平均秩次29.29,显著高于ASC低水平组患儿的疗效等级平均秩次19.17,差异有统计学意义(Z=3.736,P<0.001),见表3。
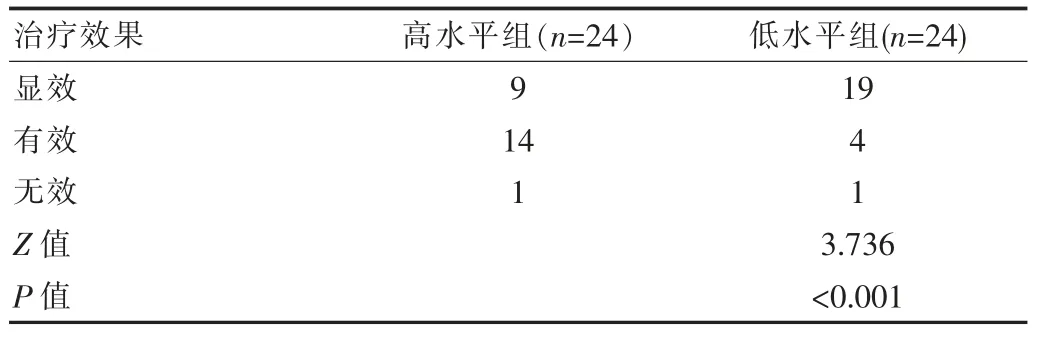
表3 ASC高水平组和低水平组患儿治疗效果等级比较(n)
2.4 ASC水平对治疗效果的预测价值
以ASC水平作为预测儿童急性发作期支气管哮喘治疗效果显效指标,ROC曲线下面积 (AUC)为0.855(P<0.001),95% CI为0.743~0.968,见图1。

图1 以ASC水平预测儿童急性发作期支气管哮喘效果的ROC曲线
3 讨论
支气管哮喘是由多种炎性细胞参与的炎症性疾病[7-8]。NLRP3是NOD样模式识别受体中重要的免疫调节复合物,由NLRP3、caspase1和ASC组成。敲除NL RP3的哮喘小鼠模型中,气道炎症较对照组明显减轻[9],在脂多糖(LPS)诱导的小鼠哮喘模型中caspase1的表达明显上调,说明caspase1也参与哮喘炎症反应的发生机制[10],ASC参与caspase1的活化激活炎症反应,主要表达在单核细胞和上皮细胞的胞核内,受到过敏原或者细菌、病毒等病原体刺激后可进行细胞重新分布至胞质中,并促进NLRP3炎症小体活化,促进IL-1β、IL-18等炎症因子释放,参与支气管哮喘的发生发展[11-13]。IL-1β主要由单核-巨噬细胞产生,可以诱导组织中性粒细胞浸润[14-15]。
研究结果显示,急性发作期支气管哮喘儿童外周血ASC水平和血清IL-1β、IL-18的水平变化情况。IL-1β、IL-18在哮喘儿童中水平升高较为文献已证实[1,7],观察组患儿治疗前后,以及对照组患儿血清中IL-18水平分别为(230.89±76.17)、(79.97±30.78)、(13.43±8.38)pg/mL,IL-1β 水平分别为 (51.41±22.98)、(23.71±11.88)、(8.08±3.36)pg/mL。目前仅见胡博等[16]开展类似研究,研究测得IL-18水平在哮喘儿童和对照儿童血清中则分别为(382.97±81.77)、(247.92±76.53)pB/(ng·L),IL-1β水平在哮喘儿童和对照儿童血清中则分别为(7.26±2.53)、(2.55±1.12)pB/(ng·L),水平与其结果趋势一致,但考虑到入组患儿的差异性、实验手段差异性,以及取样时间的差异性,IL-1β、IL-18在绝对值水平上有所差异。胡博等测定ASC mRNA的水平,结果显示,在哮喘组和对照组患儿中数值分别为 (1.72±0.25)和(1.10±0.08),ASC mRNA水平差异趋势与该研究中的蛋白水平差异趋势一致。同时该研究发现,哮喘发病后,ASC水平与IL-18、IL-1β水平均呈显著正相关,并且ASC水平越高,患者的效果越差,这在既往研究中鲜有报道。在以ASC水平作为预测儿童急性发作期支气管哮喘治疗效果显效指标,ROC曲线下面积 (AUC)为0.855(P<0.001),95% CI为0.743~0.968。可见ASC与IL-18、IL-1β水平一致,均有效反映疾病的严重程度,均有一致性趋势。分析原因为哮喘患儿中显著的NLRP3炎症小体激活,可以促使产生并释放IL-18、IL-1β[17-18],从而刺激ASC的水平增高。由于上述病理机制变化,从而在过敏性哮喘、感染性及咳嗽变异性哮喘患儿中ASC的表达明显升高,且与哮喘的严重程度密切相关,在药物和运动型哮喘患儿中缺乏过敏原及病原体感染等刺激,诱导caspase1活化能力弱,炎症细胞产生IL-1β、IL-18等炎症介质较少。
综上所述,ASC可能在气道炎症反应和固有免疫调节中发挥巨大作用,可能是辅助判断儿童支气管哮喘病情进展和严重程度,以及早期预测患者疗效的生化指标。
