非洲猪瘟病毒p11.5蛋白的表达及其单克隆抗体的制备
2021-10-09赵少若梁严予郑丁丁王彦伟郝丽影逄文强邓均华田克恭
赵少若,梁严予,郑丁丁,王彦伟,郝丽影, 逄文强, 邓均华*, 田克恭,*
(1. 洛阳普泰生物技术有限公司,河南 洛阳 471000;2. 国家兽用药品工程技术研究中心,河南 洛阳 471000)
非洲猪瘟(African swine fever)是由非洲猪瘟病毒(African swine fever virus,ASFV) 引起的一种烈性、传染性强的动物疫病,可感染所有品种和年龄的家猪、野猪,发病率和死亡率最高可达100%,症状与传统猪瘟相似,以全身出血、呼吸障碍和神经症状为主要特征[1-3]。非洲猪瘟于1921年在非洲肯尼亚首次被发现,此后传入欧洲和美洲多个国家,2000年后在临近中国的俄罗斯、乌克兰陆续暴发。2018年我国沈阳市首次报道非洲猪瘟疫情,随后全国各地陆续发生,对我国养猪业和国民经济造成巨大损失[4-5]。
ASFV为非洲猪瘟科、非洲猪瘟病毒属的唯一成员,是一种独特又复杂的病毒,可感染软蜱,同时在脊椎动物和无脊椎动物中复制[6-8]。ASFV为有囊膜的二十面体对称的双股DNA病毒,外形为正六边形,直径175~215 nm,基因大小介于170~190 kb之间,包含151个开放阅读框,基因组编码150~200个蛋白[9-11]。目前对ASFV病原特性和致病机制的认识并不充分,仍无有效的治疗或预防措施,为了更深入地研究该病毒,研究者们已经确认了多个ASFV结构蛋白,p11.5是结构蛋白中的一种,产生于病毒感染的晚期,分子量为12~13 kDa,是病毒的结构组成部分之一[12],但是目前针对该蛋白的报道较少。本研究通过构建重组原核质粒pET28a-SUMO-p11.5进行原核表达,对重组蛋白SUMO-p11.5进行纯化,制备了针对p11.5蛋白的单克隆抗体,为p11.5蛋白生物学功能的研究、ASFV致病机制及诊断试剂产品的研发提供了重要的生物材料。
1 材料与方法
1.1 实验动物
SPF级雌性BALB/c小鼠,购自北京维通利华实验动物技术有限公司。
1.2 主要试剂
大肠杆菌DH5α和BL21(DE3)感受态细胞和质粒提取试剂盒,购自天根生化科技(北京)有限公司;pET28a-SUMO质粒,由国家兽用药品工程技术研究中心构建并保存;限制性内切酶和T4 DNA连接酶,购自ThermoFisher Scientific;Bicinchoninic acid(二喹啉甲酸,简称BCA)蛋白浓度测定试剂盒,购自碧云天生物技术有限公司;弗氏完全佐剂、弗氏不完全佐剂、辣根过氧化物酶(HRP)标记的羊抗鼠IgG、HRP标记的羊抗猪IgG、异硫氰酸荧光素(FITC)标记的兔抗鼠IgG,购自Sigma公司;猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪伪狂犬病病毒(PRV)、猪圆环病毒2型(PCV2)、猪流行性腹泻病毒(PEDV)96孔抗原板由国家兽用药品工程技术研究中心提供;液体石蜡,购自北京陆桥技术股份有限公司;小鼠单抗Ig类/亚类/亚型鉴定用ELISA试剂盒,购自洛阳佰奥通实验材料中心;非洲猪瘟参考阳性血清、ASFV 96孔抗原板来源于欧盟非洲猪瘟参考实验室(Centro de Investigación en Sanidad Animal,CISA-INIA,Madrid,Spain)。
1.3 表达菌株的构建
根据GenBank中ASFV SY-18毒株全基因序列(GenBank:MH766894.1),运用在线软件(http://www.jcat.de/)对基因序列进行大肠杆菌密码子优化,由苏州金唯智生物科技有限公司合成p11.5基因序列,碱基序列414 bp。用Primer Premier 5.0软件设计引物,引入酶切位点BamHⅠ和XhoⅠ,上游引物为p11.5-BamHⅠ-F:5′-CGGGGGATCCATGGAAGCTGTTCT-3′(下划线为酶切位点BamHⅠ),下游引物为p11.5-XhoⅠ-R:5′-GCCGCTCGAGTTAACCTTCTTTGATGTT -3′(下划线为酶切位点XhoⅠ)。以合成的pUC57-ASFV p11.5为模板,用引物p11.5-BamHⅠ-F和p11.5-XhoⅠ-R进行p11.5基因的PCR扩增。扩增的目的基因进行胶回收纯化,用限制性内切酶BamHⅠ、XhoⅠ对纯化后的目的基因和pET28a-SUMO载体分别进行酶切消化,消化后的目的基因和载体经T4 DNA连接酶连接后,转化至大肠杆菌DH5α感受态细胞,涂布含有卡那霉素的LB平板,37 ℃静置培养10~12 h至单菌落清晰可辨。挑取单菌落扩大培养后,提取质粒进行双酶切鉴定和测序验证。将鉴定正确的质粒转化大肠杆菌BL21(DE3)感受态细胞,即为重组蛋白SUMO-p11.5的表达菌株。
1.4 重组蛋白SUMO-p11.5的表达与纯化
取2 mL大肠杆菌BL21(DE3)/pET28a-SUMO-p11.5菌种,接种至200 mL含卡那霉素的LB液体培养基中,置于37 ℃恒温摇床,220 r/min振荡培养至OD600 nm值为0.8~1.0时,加入终浓度0.5 mmol/L的异丙基-β-D-硫代半乳糖苷(IPTG)溶液诱导,28 ℃培养12 h。收集菌液,离心后弃掉上清,菌体沉淀用高压匀质机破碎后,离心收集上清和沉淀,分别制备蛋白电泳样品,进行SDS-PAGE分析,检测重组蛋白表达情况。菌体裂解上清液中加入0.01 mol/L咪唑,使用0.45 μm滤器过滤后,采用镍柱亲和层析法进行蛋白纯化,纯化后的蛋白用SDS-PAGE检测,并经光谱扫描法确定其纯度,以及BCA法进行蛋白定量后,将纯化蛋白进行分装后置于-80 ℃保存备用。
1.5 重组蛋白SUMO-p11.5的Western blot鉴定
纯化的重组蛋白SUMO-p11.5进行SDS-PAGE后,将凝胶用半干式转膜法电转至硝酸纤维素膜(NC膜)。转印的NC膜用含5%脱脂奶粉的PBST封闭,4 ℃封闭过夜,一抗为非洲猪瘟参考阳性血清,1∶500稀释后室温孵育1 h,二抗为HRP标记的羊抗猪IgG,1∶2 500稀释后室温孵育1 h,避光条件下加入DAB显色液,进行显色观察结果。
1.6 单克隆抗体的制备
1.6.1 动物免疫及间接ELISA筛选方法的建立
取4~6周龄雌性BALB/c小鼠,背部皮下多点免疫重组蛋白SUMO-p11.5,免疫剂量为100 μg/只。首次免疫,使用弗氏完全佐剂与重组蛋白SUMO-p11.5等体积混合乳化;第二次及之后免疫,使用弗氏不佐剂与重组蛋白SUMO-p11.5等体积混合乳化。免疫间隔2周,三免后7 d采血,用间接ELISA法检测血清抗体效价。包被纯化的重组蛋白SUMO-p11.5于酶标板,将蛋白浓度稀释至0.5 μg/mL,100 μL/孔,将待检小鼠血清进行梯度稀释,将稀释后的血清作为一抗,同时设置阴性对照,37 ℃孵育1 h;用PBST洗板4次,加入二抗HRP标记的羊抗鼠IgG,按1∶10 000稀释,100 μL/孔;洗板4次,分别加入显色剂A液、B液,50 μL/孔,37 ℃孵育15 min;最后加入2 mol/L H2SO4终止反应,50 μL/孔,在酶标仪上读数。当阴性对照OD450 nm<0.2时试验成立,S/N(待检样品OD450 nm/阴性样品OD450 nm)≥2.1判为阳性,S/N<2.1判为阴性,以阳性孔对应的最高稀释度作为待检血清的抗体效价。选择抗体效价最高的小鼠进行冲击免疫,小鼠腹腔注射纯化的重组蛋白SUMO-p11.5,100 μg/只,3 d后进行细胞融合。
1.6.2 细胞融合及筛选
细胞融合前1 d取小鼠腹腔巨噬细胞作为饲养层细胞,采用杂交瘤技术进行细胞融合,将状态良好的SP2/0细胞,与小鼠脾细胞以1∶10的比例混合,以聚乙二醇(PEG)1500作为融合剂,按常规步骤进行操作[13],融合后的细胞铺于准备好的饲养细胞上。8~10 d后取96孔板细胞上清,用1.6.1建立的间接ELISA方法进行检测,同时将大肠杆菌重组蛋白BL21/pET28a-SUMO包被酶标板作为非特异对照板,包被浓度均为0.5 μg/mL,小鼠融合血清作为阳性对照。以重组p11.5蛋白检测孔的OD值与非特异蛋白对照孔OD值的差值,作为该孔的A值,选择A值较高的细胞孔,用有限稀释法进行亚克隆,3~5次亚克隆后待杂交瘤细胞上清阳性率为100%,细胞长势均一状态较好时,对阳性杂交瘤细胞进行扩大培养及冻存,并收集细胞上清。
1.6.3 腹水的制备
取6~8月龄BALB/c经产母鼠,腹腔注射无菌液体石蜡,0.5 mL/只。7 d后对小鼠腹腔注射0.5 mL细胞密度为30万/mL的杂交瘤细胞。待小鼠腹部明显膨大时,从腹部抽取腹水,12 000 r/min离心10 min,收集上清于-80 ℃保存。
1.7 单克隆抗体的鉴定
1.7.1 单克隆抗体效价的测定
采用1.6.1建立的间接ELISA法测定腹水效价,同时用大肠杆菌重组蛋白BL21/pET28a-SUMO包被酶标板,作为非特异对照。将梯度稀释后的腹水作为一抗,HRP标记的羊抗鼠IgG作为二抗,按照上述操作方法进行检测,将对照值高的单克隆抗体弃掉,进一步排除非特异。
1.7.2 单克隆抗体亚类的鉴定
按照亚类鉴定试剂盒说明书操作步骤,对获得的单克隆抗体轻重链进行亚类鉴定。
1.7.3 单克隆抗体特异性鉴定
使用CSFV、PRV、PRRSV、PCV2、PEDV制备的96孔抗原板,检测单克隆抗体的特异性。同时设置阳性对照,CSFV、PRRSV为相应的阳性血清(由国家兽用药品工程技术研究中心提供),PRV、PCV2、PEDV为相应的阳性单克隆抗体[14-16],并用PBS作为阴性对照,按间接免疫荧光试验(IFA)常规步骤进行检测。
1.7.4 单克隆抗体IFA鉴定
将商品化ASFV 96孔抗原板取出回温后,用PBS润洗1次,分别加入一定稀释倍数的腹水,并设置阴性对照孔,置于37 ℃培养箱孵育1 h;PBS洗涤3次,加入FITC标记的兔抗鼠IgG二抗,37 ℃孵育50 min;PBS洗涤3次后,孔内加入适量PBS于荧光显微镜下观察结果。
2 结果与分析
2.1 重组质粒的构建与鉴定
用p11.5 F/R引物以合成的p11.5基因为模板进行PCR扩增,获得大小为414 bp的目的片段(图1),与预期大小一致。将构建好的重组质粒pET28a-SUMO-p11.5进行双酶切鉴定,核酸电泳可观察到载体条带和目的条带(图2),说明目的基因与载体正确连接。经测序鉴定分析,结果与p11.5目的基因碱基序列一致,表明重组质粒构建成功。
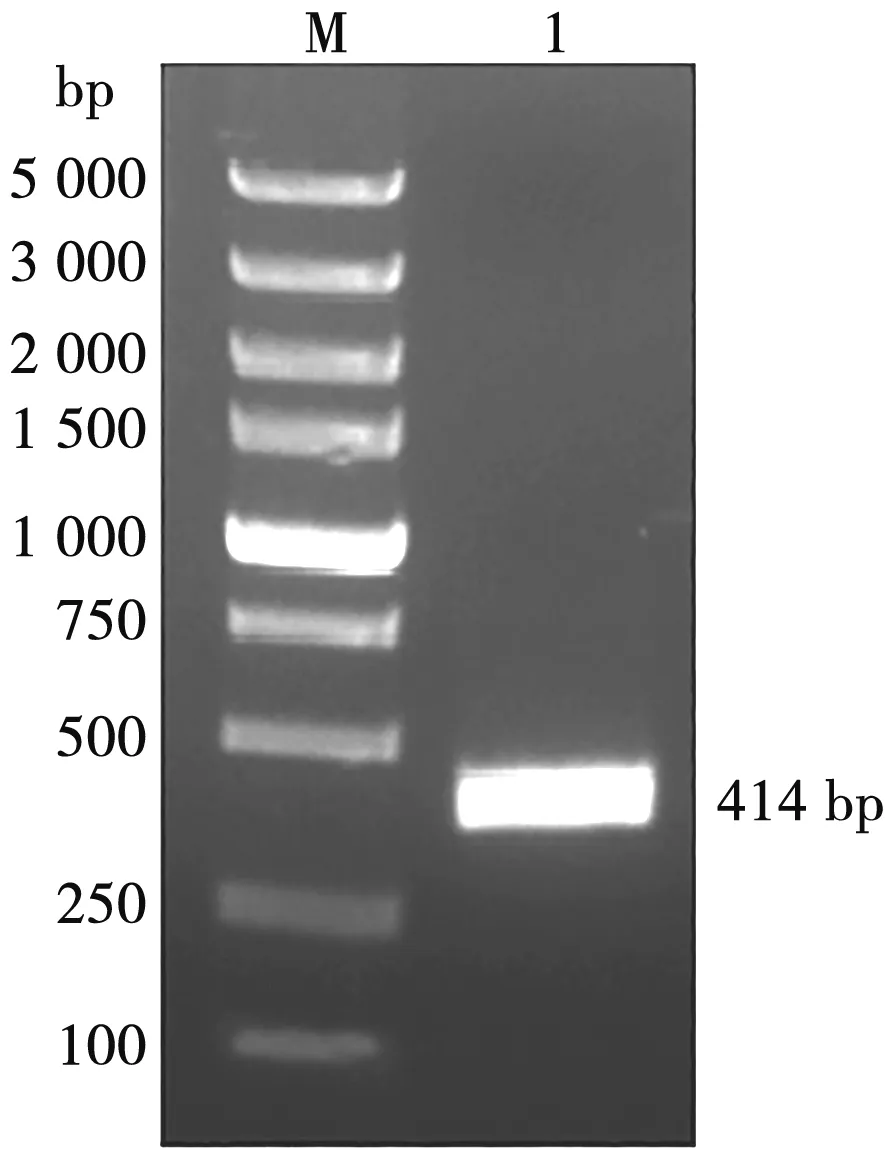
M. DNA Marker; 1. p11.5基因
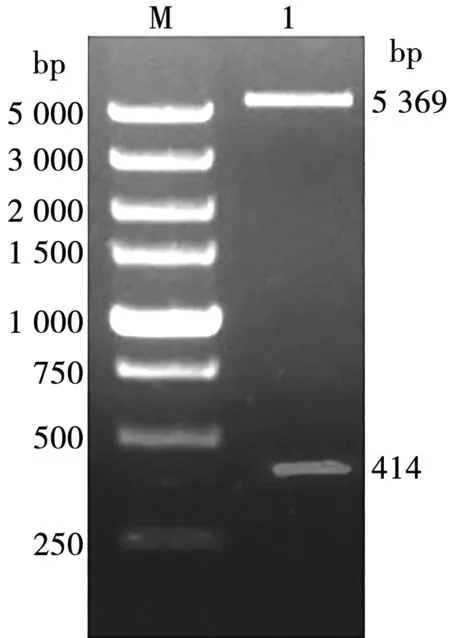
M. DNA Marker;1. pET28a-SUMO-p11.5双酶切
2.2 重组蛋白的表达、纯化与鉴定
经SDS-PAGE检测,与诱导前相比,IPTG诱导后的菌体破碎液上清有明显目的蛋白。诱导表达的重组蛋白SUMO-p11.5分子量大约在30 kDa,且为可溶性表达(图3)。采用镍柱亲和层析法纯化上清中的可溶蛋白,纯化后蛋白纯度约90%(图4A)。经Western blot鉴定,表达的重组蛋白SUMO-p11.5能够与ASFV标准阳性血清反应,显示出特异性的条带(图4B),结果表明重组蛋白SUMO-p11.5具有良好的反应原性。
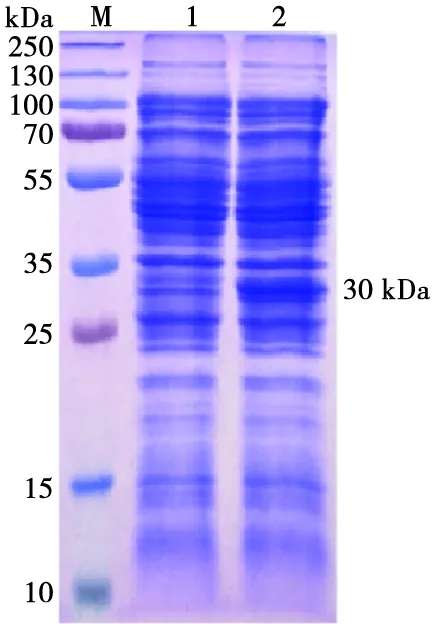
M. 蛋白分子量Marker;1. 诱导前的大肠杆菌BL21(DE3)/pET28a-SUMO-p11.5菌体破碎液上清;2. 诱导后的大肠杆菌BL21(DE3)/pET28a-SUMO-p11.5菌体破碎液上清
2.3 单克隆抗体制备及效价检测
经过筛选获得4株能稳定性分泌抗p11.5蛋白单克隆抗体的杂交瘤细胞,分别命名为1G6、3D2、5F2、5E12,将这4株杂交瘤细胞制备了小鼠腹水,并进行ELISA效价检测,结果显示,制备的腹水ELISA效价均不低于1∶102.4×104。
2.4 单克隆抗体亚类鉴定
对制备的单克隆抗体进行亚类鉴定,3株单克隆抗体重链亚类为IgG1,1株重链为IgG2a,轻链亚类均为κ。
2.5 单克隆抗体特异性鉴定
取CSFV、PRV、PRRSV、PCV2、PEDV 96孔抗原板分别检测4株单克隆抗体,结果阳性对照孔均可见明显的荧光,阴性对照孔和单克隆抗体检测孔均无可见荧光,结果表明4株单克隆抗体均不与CSFV、PRV、PRRSV、PCV2、PEDV发生反应,以单克隆抗体1G6示例(图5)。
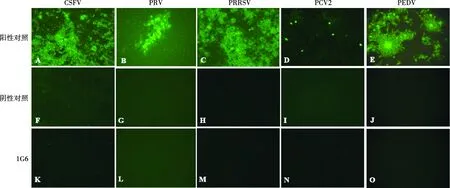
A,B,C,D,E. 相应病毒抗体检测阳性对照;F,G,H,I,J. PBS处理阴性对照;K,L,M,N,O. 单克隆抗体1G6与不同病毒反应结果
2.6 单克隆抗体与ASFV反应性鉴定
利用商品化ASFV 96孔抗原板,对获得的4株单克隆抗体进行IFA鉴定,同时将非ASFV源单克隆抗体作为阴性对照。结果显示4株单克隆抗体均能在荧光显微镜下观察到特异性的绿色荧光,阴性对照孔无绿色荧光,以单克隆抗体1G6示例(图6)。
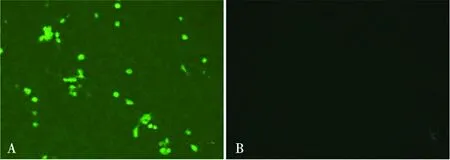
A. 单克隆抗体1G6;B. 阴性对照
3 讨论
目前非洲猪瘟已在30多个国家发生流行,并有继续扩大蔓延的趋势,该病传染性强,患猪出现高热、食欲废绝、皮肤发绀、内脏器官严重出血等临床症状,具有发病病程短、病死率高等特征[17-18]。鉴于该病的严重危害性,OIE将其列为法定报告的烈性传染病之一,我国将其列为一类动物疫病。由于ASFV的复杂性和特殊性,目前尚无有效的治疗药物和商品化疫苗,一旦发病,只能依靠隔离、扑杀、限制流通来防止疫情蔓延。因此,建立快速而有效的检测方法是防止非洲猪瘟发生大范围暴发的有效手段[19-20]。
非洲猪瘟常采用如红细胞吸附试验、直接免疫荧光试验、核酸检测试验、IFA、ELISA等方法进行诊断[21],国际上缺乏相关特异性试剂,对非洲猪瘟的防控带来许多困难。ASFV病毒复制是调控病毒基因转录的开关,极早期和早期基因在病毒复制前进行转录表达,而中期和晚期基因在病毒复制开始后进行转录表达。p11.5基因比较稳定,在病毒DNA合成开始后被翻译,因此属于晚期病毒基因类别。该蛋白在感染细胞中定位于病毒工厂,并组装进入病毒颗粒,是病毒的结构组成部分,在感染细胞中非常丰富,因此,p11.5具有作为诊断抗原的潜质[22]。本研究利用大肠杆菌表达系统成功表达出ASFV p11.5蛋白,且为胞质内可溶性表达。经过Western blot分析,重组蛋白可以和ASFV标准阳性血清发生反应,有良好的反应原性。以重组蛋白p11.5蛋白免疫小鼠制备了4株针对该蛋白的单克隆抗体,间接ELISA方法检测获得的单克隆抗体效价均不低于1∶102.4×104。经单克隆抗体亚类鉴定,3株单克隆抗体重链亚类为IgG1,1株重链亚类为IgG2a,轻链亚类均为κ。间接免疫荧光试验结果显示,4株单克隆抗体均不与CSFV、PRRSV、PRV、PCV2、PEDV反应,但均能与ASFV反应,表明制备的单克隆抗体具有良好的特异性与反应性。
本研究成功表达了可溶性的ASFV p11.5蛋白并制备了针对p11.5的单克隆抗体,经鉴定具有较高的效价且特异性良好,为p11.5蛋白的结构功能等基础研究,以及ASFV免疫类诊断试剂产品的开发提供了重要的生物材料。
