亚抑菌浓度苯唑西林诱导金黄色葡萄球菌临床株Lpl脂蛋白表达的作用*
2021-10-09蒋荩芳杨宇勤朱娇三王明珊
蒋荩芳,杨宇勤,王 恒,朱娇三,王明珊,成 鑫
(遵义医科大学附属航天医院检验科,贵州 遵义 563000)
作为社区获得性感染及医院感染的重要病原菌之一,金黄色葡萄球菌,特别是耐甲氧西林金黄色葡萄球菌(MRSA)可引起肺炎、支气管炎、皮肤软组织感染、脓毒症、脑脓肿等疾病[1-2]。流行病学研究表明,MRSA感染主要以克隆群播散为主,不同地区流行的金黄色葡萄球菌克隆群不尽相同。如克隆群8(CC8)主要流行于美洲,CC22和CC30主要流行于欧洲,而CC239(ST239)主要流行于亚洲。在我国,携带Ⅲ型SCCmec的CC239占临床MRSA分离株的50%以上,包括2个主要的亚群,ST239-MRSA-Ⅲ-t037和ST239-MRSA-Ⅲ-t030[3]。
金黄色葡萄球菌可产生如脂蛋白(Lpp)、溶血素、血浆凝固酶等致病因子[4]。在金黄色葡萄球菌的基因组中,Lpp的编码基因有55~70种,主要参与生物信号传递、物质转运和细胞膜的稳定等[5]。金黄色葡萄球菌中约30% Lpp的作用目前尚还不清楚,研究发现,这些功能不明的Lpp序列,与已知的Lpp存在一定差异,它们缺乏典型的脂盒结构,故又被称之为脂蛋白样蛋白(Lpl)[5]。金黄色葡萄球菌产生的Lpl可分泌到细胞外,具有激活TLR2依赖的信号途径,诱导宿主产生过度的炎性反应,这可能是金黄色葡萄球菌引起脓毒症的机制之一[6]。
β-内酰胺类抗菌药物常用于预防感染[7],低剂量的抗菌药物可产生信号诱导作用,导致细菌胞外释放DNA、生物膜形成、产生毒力因子,从而加重细菌感染[8-9]。除具有抗菌作用外,亚抑菌浓度的β-内酰胺类抗菌药物还诱导金黄色葡萄球菌分泌肠毒素、α-溶血素、葡萄球菌A蛋白、杀白细胞毒素等,促进细菌的致病性[8,10]。由此可见,经验性使用β-内酰胺类抗菌药物,在一定程度上不但不能抑制或杀灭MRSA,而且可能促进该菌的致病作用,加重感染。探讨亚抑菌浓度β-内酰胺类抗菌药物在诱导MRSA毒力基因表达中的作用,对深入了解MRSA致病性增强的原因和指导临床合理使用抗菌药物具有重要意义。
1 材料与方法
1.1实验菌株、质粒与试剂 MRSA菌株由陆军军医大学饶贤才教授课题组惠赠[11]。大肠埃希菌DH5α,BL21和表达质粒pET28a(+)从北京天根(Tiangen)生物技术有限公司购买。质粒提取试剂盒购自Promega公司。细菌培养基LB、BHI和TSB均购自Oxoid公司。
1.2方法
1.2.1MRSA对不同抗菌药物的敏感性测定 挑取待测的MRSA菌株单菌落,在BHI液体培养基中培养过夜,次日1∶100接种于BHI液体培养基,37 ℃,200 r/min,至OD600约2.0左右(约6 h),用无菌的磷酸盐缓冲液(PBS溶液)或生理盐水稀释到0.5麦氏浓度,约1×108~2×108cfu/mL,再用BHI液体培养基稀释为100倍的菌悬液备用;将选用的抗菌药物(利奈唑胺、万古霉素、苯唑西林、替考拉宁、克林霉素、利福平、复方新诺明)配制成2 048 μg/mL。取11支无菌试管,每管加入BHI液体培养基1 mL。在第1管中加入1 mL 浓度为2 048 μg/mL的药物溶液,混匀后,再取1 mL到第2管,依次倍比稀释至第10管,最后一管不加药物,从而使各管中抗菌药物的浓度依次为1 024、512、256、128、64、32、16、8、4、2、0 μg/mL。每管加入制备好的菌悬液1 mL,使每管含有约0.5×106~1.0×106cfu/mL,经37 ℃ 培养24 h后观察记录。无细菌生长的药物浓度,即为该菌株对该药物的最低抑菌浓度(MIC),依据临床和实验室标准协会(CLSI)标准来判定该菌株对抗菌药物是敏感、中介还是耐药[12]。
1.2.2十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析 用亚抑菌浓度的苯唑西林(2 μg/mL)诱导处理遴选出的MRSA菌株,并与未经处理的菌株一起,电泳分析细菌的总蛋白。具体方法如下:经药物处理的MRSA,培养结束后,用10 000 r/min离心2 min,弃上清。菌体用1 mL PBS重悬,加入1 mmol/L 蛋白酶抑制剂(PMSF),再移到2 mL细菌破碎管中,加入2 g 0.1 mm氧化锆研磨珠,冰浴10 min;用MiniBeadbeater-16研磨器研磨5 min,冰浴10 min,重复3次;把研磨液用20 000 r/min,4 ℃离心10 min,吸取上清,用蛋白质定量(BCA法)定量后,取30 ng总蛋白样品,加入60 μL PBS和15 μL 5×SDS上样Buffer重悬,采用分子克隆中描述的方法,进行SDS-PAGE电泳和考马斯亮蓝染色分析。
1.2.3pET28a-lpl/BL21重组表达工程菌的构建 根据MRSA菌株N315基因组中lpl基因序列,设计引物F:5′-aacggatcctgcggaatgaaaaaggaag-3′(含BamHⅠ位点)和引物R:5′-agcgtcgacctattcagtaggtttgaaatt-3′(含SalⅠ位点)。以N315的基因组DNA为模板,扩增lpl目标基因片段,用BamHⅠ和SalⅠ双酶切后,与pET28a(+)载体连接,再转化至大肠埃希菌DH5α。挑选卡那霉素抗性的菌落,培养后提取质粒用PCR扩增,酶切及DNA测序鉴定,含正确编码序列的质粒命名为pET28a-lpl,再将质粒转化到大肠埃希菌BL21感受态细胞中,获得pET28a-lpl/BL21重组表达工程菌。
1.2.4Lpl-his重组蛋白的表达与纯化 复苏pET28a-lpl/BL21工程菌,次日按1∶100比例接种于300 mL LB液体培养基中(含KAN 50 μg/mL),37 ℃,150 r/min振荡培养至OD600 达0.5左右,加入终浓度为0.2 mmol/L的IPTG,22 ℃,150 r/min诱导表达12 h。收集菌液4 ℃,5 000 r/min离心15 min,弃上清。菌体经PBS重悬,5 000 r/min离心15 min,弃上清。用大肠埃希菌破碎缓冲液20 mL重悬菌体,再用ATS高压均质机高压破碎菌液,10 000 r/min,4 ℃离心30 min,收集上清,经0.45 μm的针式滤器过滤。用GE公司的Ni层析柱纯化,收集各洗脱峰蛋白样品后,进行SDS-PAGE电泳分析,获得的重组蛋白用BCA法定量后,置-80 ℃冰箱保存。
1.2.5制备Lpl-his重组蛋白小鼠多克隆抗体 取纯化的Lpl-his蛋白40 μg,与等体积的Freund′s佐剂混匀,经肌肉、腹腔、皮下多点免疫小鼠,并分别于14 d,28 d后进行加强免疫,35 d后眼球取血制备血清,经0.22 μm滤器过滤,命名为anti-Lpl,-20 ℃冻存。
1.2.6苯唑西林诱导LPI表达的Western blot鉴定 各MRSA菌株经亚抑菌浓度的苯唑西林诱导后,进行SDS-PAGE电泳,至溴酚蓝泳动到凝胶底部;小心取出凝胶,浸入到1×半干转膜缓冲液中平衡10 min。依次按照厚滤纸、PVDF膜、凝胶、厚滤纸的顺序,叠放到Trans-blot半干转膜仪内,驱逐气泡后,在15 V条件下转膜30 min;转膜结束,将聚偏二氟乙烯膜(PVDF膜)用磷酸盐吐温缓冲液(PBST溶液)漂洗1 min后,置于5%脱脂奶粉封闭液中,室温摇荡封闭1 h;向封闭液中加入制备的anti-lpl多克隆抗体(1∶5 000)4 ℃孵育过夜;次日,用PBST将PVDF膜洗膜5次,每次5 min;将PVDF膜放入用封闭液稀释(1∶5 000)的羊抗小鼠 IgG中,室温孵育1 h;PBST洗膜5次,配置好ECL发光液,化学发光成像仪成像后,保存。Western blot的印迹条带采用Image J软件进行处理并根据条带灰度进行数字化,计算每一条带相对于Loading control的相对灰度值,将未用OXA处理菌株的蛋白相对灰度值调整为1,计算诱导后或不同剂量诱导后的蛋白相对灰度值并作图。
2 结 果
2.1临床菌株的药敏检测结果 利奈唑胺、万古霉素和替考拉宁对所有菌株都敏感;克林霉素和苯唑西林对所有菌株都耐药;而t030菌株和t037菌株对利福平和复方新诺明的敏感性相反,体现ST239-MRSA-Ⅲ-t030和ST239-MRSA-Ⅲ-t037克隆亚群的进化存在差异。见表1。

表1 临床分离MRSA菌株的药物敏感性
2.2亚抑菌浓度的苯唑西林作用前后金黄色葡萄球菌菌体蛋白的电泳观察 6株ST239-MRSA-Ⅲ型金黄色葡萄球菌临床菌株,全部对苯唑西林(OXA)耐药,选用亚抑菌浓度的OXA(2 μg/mL)处理金黄色葡萄球菌,然后进行SDS-PAGE电泳,见图1。与未处理的菌株相比,OXA处理后的细菌在约30 kDa处出现一条明显的条带(图中黑色三角所示)金黄色葡萄球菌。

图1 亚抑菌浓度OXA诱导ST239-MRSA-Ⅲ金黄色葡萄球菌总蛋白的SDS-PAGE电泳分析
2.3OXA处理后蛋白条带的鉴定 为明确亚抑菌浓度OXA处理ST239-MRSA-Ⅲ金黄色葡萄球菌后出现的蛋白条带是否为Lpp Lpl,作者构建了金黄色葡萄球菌脂蛋白Lpl的重组表达质粒pET28a-lp1,转化大肠埃希菌BL21,并用0.5 mM的IPTG重组蛋白的诱导表达,见图2A。含有重组质粒的工程菌,在IPTG诱导后,在约33 kDa处出现一明显的蛋白条带,其大小与Lpl-His重组蛋白的理论相对分子质量相一致。利用重组蛋白N-端带有6个组氨酸标签的特性,用Ni层析柱纯化Lpl-His蛋白,洗脱峰经透析、浓缩、蛋白定量后,用SDS-PAGE电泳分析。见图2B。用前述的重组蛋白免疫Balb/c小鼠,制备抗血清。利用Lpl抗血清,对OXA诱导的金黄色葡萄球菌ST239-MRSA-Ⅲ产生的蛋白,经Western blot鉴定,见图3。亚抑菌浓度OXA诱导后,6株ST239-MRSA-Ⅲ金黄色葡萄球菌均出现Lpl蛋白(图3A),但不同菌株的表达量不完全一致(图3B)。
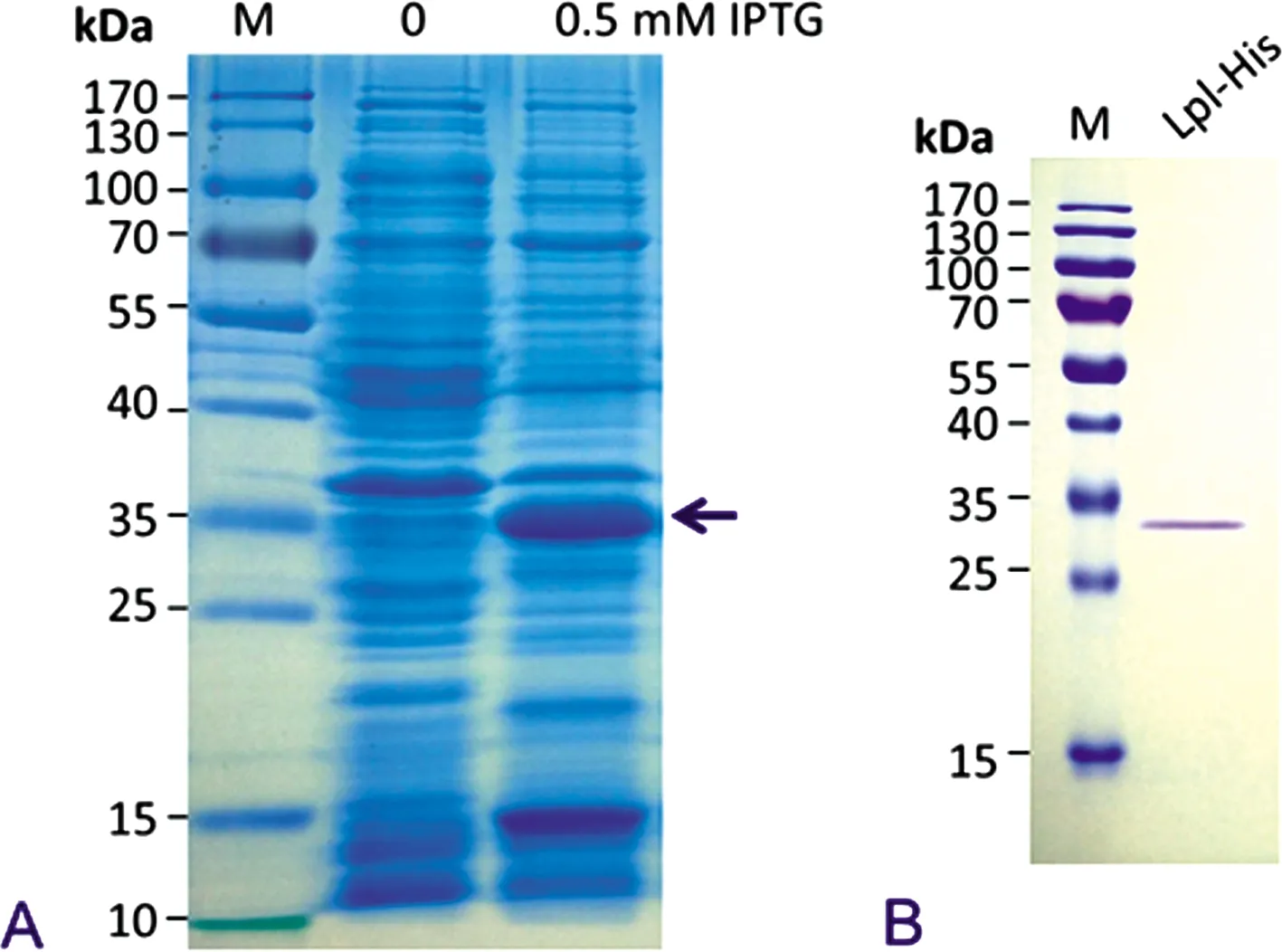
A.pET28a-lp1/BL21工程菌经IPTG诱导出现一明显蛋白条带(黑色箭头所示),相对分子质量大小与Lpl-His重组蛋白的理论相对分子质量一致;B.Ni柱纯化Lpl-His蛋白的SDS-PAGE电泳分析。

A.不同临床菌株用亚抑菌浓度OXA诱导前后的Western blot结果。未诱导菌株未出现或出现极弱的印迹条带,OXA诱导后出现明显的印迹条带,LC(Loading control)为蛋白上样对照;B.Western blot印迹条带的相对灰度分析。
2.4亚抑菌浓度诱导ST239-MRSA-Ⅲ金黄色葡萄球菌LpI具有剂量依赖效应 为观察ST239-MRSA-Ⅲ金黄色葡萄球菌Lpl受OXA诱导的特异性,任意选取CQ29菌株,用不同剂量的亚抑菌浓度OXA进行处理,Western blot分析结果显示,随OXA浓度的升高,Lpl的量也逐渐升高,且出现2个主要条带(图4)金黄色葡萄球菌。

A.不同剂量OXA诱导金黄色葡萄球菌CQ29的Western blot结果。OXA的浓度如图中标示,LC为上样对照。B.Western blot印迹条带的相对灰度分析。
3 讨 论
Lpl,是金黄色葡萄球菌重要的毒力因子,为DUF576家族脂蛋白成员[13-14]。该家族的脂蛋白编码基因,在基因组上通常为成簇排列,因其结构域的功能未知(DUF)而得名,也是金黄色葡萄球菌的保守抗原[15]。NGUYEN等[16]对MRSA菌株USA300基因组vSaα基因组岛进行分析发现,该基因组岛可编码多个同源串联排列的DUF576家族脂蛋白,即Lpl,敲除该基因簇,发现巨噬细胞经敲除菌株刺激后,表达炎症因子的水平和入侵角朊细胞的能力都显著减弱,在小鼠肾脏中的定植能力也显著降低。MRSA菌株N315中含有12个推定的lpl基因,分属于4个基因簇,多数位于vSaα基因组岛上[15]。SHANG等[6]的研究表明,金黄色葡萄球菌中存在lpl基因,该基因受β-内酰胺类抗生素诱导,在MRSA致病性中,这些基因的编码产物发挥重要作用。但该研究主要基于标准金黄色葡萄球菌N315进行,至于β-内酰胺类抗生素能否诱导临床分离的金黄色葡萄球菌株产生Lpl尚需实验证实。
本研究选取了在我国主要的金黄色葡萄球菌流行克隆群ST239中的2个亚群(t030和t037)菌株各3株,采用稀释法来测定这些菌株对临床常用的抗菌药物的敏感性,经亚抑菌浓度的苯唑西林(2 μg/mL)处理,用SDS-PAGE分析发现,受OXA处理的菌株存在一条约30 kDa的蛋白条带,与SHANG等[6]报道的结果一致。为证实这一诱导出的蛋白为Lpl脂蛋白,我们对金黄色葡萄球菌lpl基因进行了克隆表达,获得了Lpl-His重组蛋白,制备了特异性的小鼠抗血清。Western blot鉴定研究表明,在临床分离的MRSA菌株中,亚抑菌浓度苯唑西林能够诱导Lpl的表达,且未经到的菌株几乎不表达Lpl,这提示在临床金黄色葡萄球菌MRSA感染时,经验性使用β-内酰胺类抗菌药物,很可能会通过诱导脂蛋白Lpl表达,而增强菌株的致病性,需要谨慎用药。
此外,Western blot 分析还证实,MRSA脂蛋白Lpl的表达受亚抑菌浓度OXA诱导有剂量依赖效应。Western blot检测结果中出现了两条大小相近的蛋白质条带,这可能由于受OXA诱导的lpl基因组中有3个串联的编码基因,分别编码推定分子量为30.8、30.1、30.2 kDa的蛋白质[6],相对分子质量大小相近,蛋白序列相似度高,由第一个编码基因制备的Lpl-his重组蛋白多克隆抗体可能除可识别第一个Lpl蛋白外,对另外2个Lpl蛋白也会有交叉反应,故Western blot检测出现2个条带,这可能是Lpl基因在金黄色葡萄球菌临床株CQ29中存在多个拷贝组成,表达的Lpls蛋白同源性较高,而相对分子质量略有差异所致[5-6]。
综上所述,本研究发现亚抑菌浓度OXA处理后金黄色葡萄球菌MRSA临床分离株呈现剂量依赖性脂蛋白Lpl表达上调,提示该Lpl的表达增强,在MRSA致病性中可能发挥重要作用。至于在β-内酰胺类抗生素治疗时,体内感染的MRSA受抗生素诱导表达的程度及其对致病性的影响值得下一步进行深入探讨。
