原发性肝癌患者肝切除术后肠道菌群变化与复发的相关性
2021-10-09王宪红高志峰
王宪红 高志峰
手术是原发性肝癌(hepatocellular carcinoma,HCC)的主要治疗手段,但部分HCC患者术后仍有复发风险,复发后将增加治疗难度,提高病死率[1]。因此,早期、准确预测HCC患者肝切除术后复发风险,并尽早干预,对减少术后复发,促进良性预后较重要。近年来,越来越多的研究探讨分析HCC的微环境与肠道菌群在肝肠循环中的作用,以期为HCC的治疗提供新思路、新想法[2]。肠道菌群是指寄居于人体肠道内的所有微生物。目前,已有研究证实,肠道菌群失调不仅与肠道疾病密切相关,也可影响肝、心、造血等多个系统功能[3]。另有研究指出,肠道菌群可利用调节宿主代谢和免疫功能等方面参与疾病、肿瘤的发生、发展,尤其在肝脏疾病、肝脏肿瘤中可见肠道菌群存在明显变化[4]。本研究主要观察HCC患者肝切除术后肠道菌群变化与复发的关系,旨在分析肠道菌群变化能否作为HCC患者术后复发的预测指标。现报告如下。
1 资料与方法
1.1 一般资料
研究的实施获得医院伦理委员会批准同意,前瞻选取2017年1月至2018年1月医院收治符合条件的92例HCC患者作为研究对象,患者及家属对研究知情,并自愿参加研究,签署研究知情同意书。92例患者中男性61例,女性31例;年龄40~58岁,平均年龄(49.13±1.63)岁;恶性肿瘤国际临床病期分期(TNM)[5]:Ⅰ期33例、Ⅱ期59例。
1.2 入选标准
纳入标准:①符合《原发性肝癌诊疗规范(2017版)》[6]中HCC相关诊断标准,且经病理学、影像学等检查确诊;②符合肝切除术手术指征,并接受手术治疗;③预计生存时间>3个月;④首次接受手术治疗。排除标准:①合并肝内或向其他远处转移的患者;②伴菌血症、感染性休克的患者;③合并其他肿瘤的患者;④因自身问题难以耐受手术的患者;⑤合并其他胃肠道疾病可能影响肠道菌群水平的患者。
1.3 方法
1.3.1 复发判定及分组方法 全部患者术后均随访2年,术后每个月定期回院复查肝功能并接受胸部X片检查,观察有无复发病灶,且可依据患者主诉进行特殊检查。随访结束时,将全部复发患者纳入复发组,剩余患者纳入未复发组。
1.3.2 基线资料调查方法 自制基线资料调查问卷,详细询问并记录患者一般情况,内容包括:①年龄;②性别;③吸烟史:一生连续或累计吸烟6个月或以上;④饮酒史:一般超过5年,男性饮酒量≥40克、女性饮酒量≥20克;⑤术中出血量。
1.3.3 实验室指标检测方法 肠道菌群:分别于患者术后1、3个月来院随访时收集其新鲜大便(收集前1 d电话告知患者需要禁酒及用药),取0.5 g标本后进行稀释。稀释完毕后,选用乳酸杆菌、双歧杆菌、肠球菌及大肠埃希菌等各个菌群的培养基,培养2~3 d后,采用法国梅里埃公司的自动微生物鉴定仪及软件鉴定,并计算每克粪便湿重中菌落形成单位对数值。
1.4 统计学方法
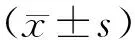
2 结果
2.1 复发情况
随访结束时,本研究纳入的92例接受肝切除术治疗的HCC患者中,有24例患者复发,复发率为26.09%(24/92)。
2.2 2组基线资料对比
2组的基线资料对比,差异无统计学意义(P>0.05)。见表1。
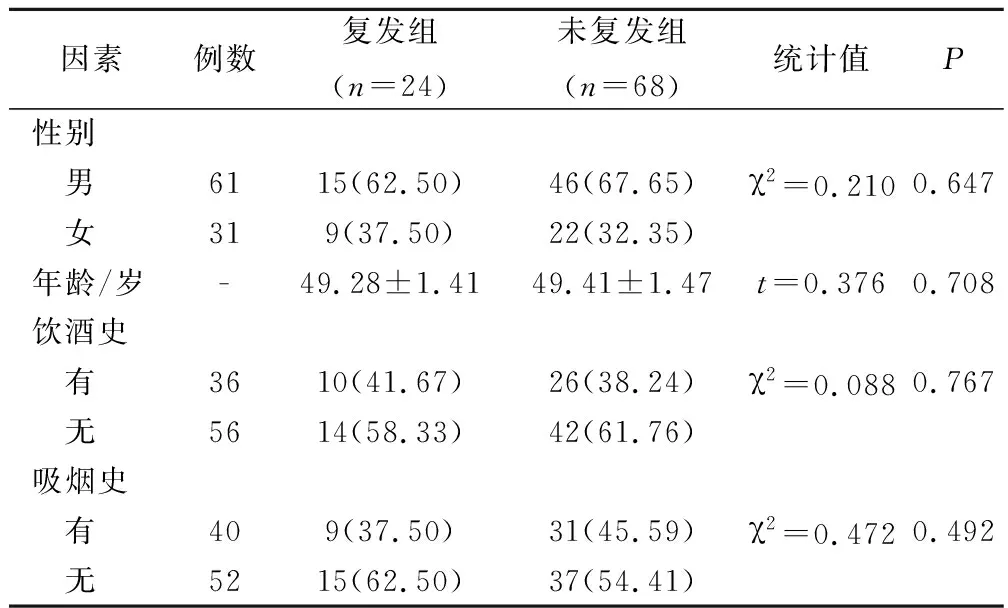
表1 2组的基线资对比(例,%)
2.3 复发组与未复发组的肠道菌群变化情况
术后3个月时,2组的双歧杆菌、乳酸杆菌数量均较术后1个月时降低,肠球菌和大肠埃希菌数量均较术后1个月时升高,且复发组术后3个月时的双歧杆菌、乳酸杆菌数量低于未复发组,肠球菌和大肠埃希菌数量高于未复发组,术后1个月与3个月时的各肠道菌群数量差值高于未复发组,差异有统计学意义(P<0.05)。见表2。
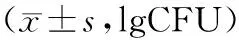
表2 复发组与未复发组的肠道菌群变化情况
2.4 术后1个月与3个月时的肠道各菌群数量差值与HCC患者肝切除术后复发关系的回归分析
将组间基线资料比较结果显示差异有统计学意义的变量作为自变量纳入,均为连续变量,将HCC患者肝切除术后复发情况作为因变量(1=复发,0=未复发),经二元Logistic回归分析,后将其他全部基线资料纳入,建立多元回归模型,结果显示,术后1个月与3个月时肠道各菌群数量变化幅度与HCC患者肝切除术后复发有关,变化幅度大可能是HCC患者肝切除术后复发的风险因子(OR>1,P<0.05)。见表3。

表3 术后1个月与3个月时的肠道各菌群数量变化与HCC患者肝切除术后复发关系的回归分析结果
2.5 HCC患者肠道各菌群数量变化预测肝切除术后复发的效能分析
将术后1个月与3个月时的肠道各菌群数量差值作为检验变量,肝切除术后复发情况作为状态变量(1=复发,0=未复发),经ROC曲线分析结果显示,术后1个月与3个月时肠道各菌群数量变化差值预测HCC患者肝切除术后复发的AUC分别为0.804、0.768、0.835、0.790,预测价值均理想。见图1。肠道各菌群数量变化对应最佳阈值、特异度、敏感度及约登指数见表4。

表4 HCC患者肠道各菌群数量变化预测肝切除术后复发的效能分析
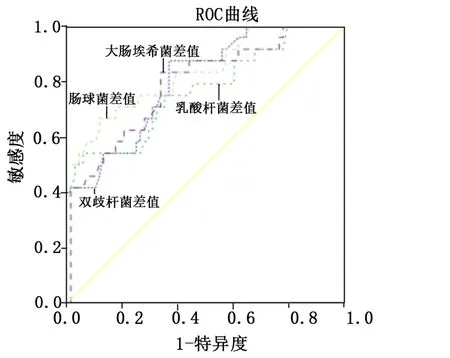
图1 HCC患者肠道各菌群数量变化预测肝切除术后复发的ROC曲线图
3 讨论
HCC患者治疗方案较多,包括局部消融治疗、放射治疗、肝切除术等,其中肝切除术是首选术式,对于符合手术适应证的患者,该治疗方案效果确切,但HCC具有高复发率,部分患者即便是接受理想的手术治疗,术后仍存在复发风险,长期预后仍较差[7]。因此,探寻与HCC患者肝切除术后复发有关的标志物尤为重要。
文献指出,HCC术后5年复发率高达60%,且主要集中在术后2年左右[8]。而本研究结果显示,全部92例HCC患者经肝切除术治疗后,随访2年期间有24例复发,复发率为26.09%,虽远低于上述研究结果,但并不能提示患者复发风险降低,且得到该结果也可能与未纳入晚期HCC患者、样本量少有关。肝脏是重要代谢器官之一,具有一定的免疫调节功能。人体肠道在长期进化过程中已形成约有10万亿个的稳定肠道菌群,主要分为以双歧杆菌为代表的优势菌群和以大肠埃希菌为代表的次要菌群,上述菌群的代谢产物主要由肝脏门脉系统完成分解及排放,与肝脏关系密切,共同承担调节代谢、免疫的作用[9-10]。近年来,有大量研究指出,肠道菌群不仅与营养不良、糖尿病等疾病密切相关,且内分泌、饮食习惯等也与肠道菌群的平衡性存在关联[11-12]。另有研究结果表明,癌症与肠道菌群也存在一定的关系,癌症的预防、发生、发展及治疗全周期中,均可见肠道微生物参与其中[13]。
因术后复发涉及肿瘤的增殖与转移,结合肠道菌群与肿瘤的关系,推测肠道菌群变化与HCC患者肝切除术后复发有关。本研究结果显示,复发组术后1个月与3个月时的双歧杆菌、乳酸杆菌、肠球菌、大肠埃希菌数量差值高于未复发组,初步提示肠道各菌群数量变化可能与HCC患者肝切除术后复发有关。进一步回归分析结果显示,肠道菌群与HCC患者肝切除术后复发有关,术后肠道各菌群数量变化幅度大可能是HCC患者肝切除术后复发的风险因子,证实猜测。简单分析可能的原因:HCC患者肝切除术后,代谢解毒能力有所下降,将导致肠道菌群多样性发生变化,优势菌群减少,而有害菌群数量及代谢产物增加,继而加重肝脏的炎症反应,加重损伤,从而为肿瘤细胞的生长提供有利条件,增加复发风险[14-15]。并且,肝癌患者因肝脏不同程度受损,受损肝脏难以有效清除肠道腐败菌产生的有害物质,将导致肠道菌群发生变化,继而通过免疫系统、血液循环等途径进一步加重肝脏受损程度,促进肿瘤细胞生长,进而增加复发风险[16-17]。最后,本研究绘制ROC曲线分析肠道菌群变化预测HCC患者肝切除术后复发的价值结果显示,术后1个月与3个月时肠道各菌群数量变化差值预测HCC患者肝切除术后复发的AUC分别为0.804、0.768、0.835、0.790,表明肠道菌群变化不仅可能是HCC患者肝切除术后复发的风险因子,也可作为HCC患者肝切除术后复发预测标志物。上述结果也表明,早期可动态检测HCC患者肝切除术的肠道菌群,若发现异常变化,建议可以为患者实施抗炎、补充维生素C等干预,以帮助肠道菌群平衡状态恢复,对减少肝切除术后复发可能有一定价值。
综上所述,HCC患者肝切除术后复发可能与肠道菌群异常变化有关,临床可考虑通过早期监测HCC患者的肠道菌群变化情况,预测复发风险并指导干预,积极控制肠道菌群变化,可能对减少复发、促进良性预后有积极意义。
