木犀草素抑制有氧糖酵解对胃癌AGS细胞凋亡的影响
2021-10-09曾树宏陆为民
曾树宏,陆为民
(南京中医药大学附属医院,江苏 南京 210029)
胃癌是常见的恶性肿瘤之一,严重危害着人类健康。随着社会发展、医学进步以及早癌筛查的推广,胃癌的发病率有所下降,但其总体发病率仍高居全球第三位,病死率居第四位[1-2]。目前胃癌的主要治疗手段仍以早期根治性手术、晚期全身化疗为主。有氧糖酵解,即Warburg 效应,是肿瘤细胞的特征性代谢方式,与三羧酸循环相比,糖酵解步骤少,产生ATP 效率低速率高,可以迅速满足肿瘤细胞疯狂增殖的能量需求;通过将大部分碳流由供能转变为合成生物大分子,可以维持肿瘤细胞持续增殖生长所需的物质储备,这使肿瘤细胞摄取葡萄糖和谷氨酰胺的速率是正常细胞的200 倍以上[3-5]。
木犀草素(Luteolin)是一种天然黄酮类化合物,木犀草素及其衍生物抗肿瘤研究主要聚焦于诱导凋亡、阻滞细胞,周期、抗血管生成等[6]。近期PALOMBO R等研究发现,木犀草素衍生物LUT-7-G 对HKⅡ有特异性抑制作用,导致有氧糖酵解作用下调,显示木犀草素衍生物在肿瘤能量代谢方面具有治疗潜力[7]。本研究拟通过体外实验研究木犀草素对胃癌AGS 细胞的凋亡诱导作用,通过有氧糖酵解途径探讨其可能作用机制,为木犀草素应用于胃癌治疗或协同增效提供依据。
1 材料
1.1 细胞
胃癌AGS 细胞系为江苏省中医院中心实验室常规培养。来源于中国科学院细胞库(上海),为中分化原位胃腺癌细胞。
1.2 木犀草素
木犀草素(纯度>99%)购自南京道斯夫生物,采用二甲基亚砜(DMSO)作为溶剂,配制为160 mol/L溶液。
1.3 试剂
乳酸(LD)试剂盒(南京建成生物工程研究所有限公司);葡萄糖测定试剂盒(北京普利莱基因技术有限公司);CCK-8(APExBio);二甲基亚砜(APExBio);Annexin V-FITC/PI 凋亡检测试剂盒(南京诺唯赞生物科技股份有限公司);β-肌动蛋白(β-actin);己糖激酶Ⅱ(HKⅡ);丙酮酸激酶同工酶M2(PKM2);葡萄糖转运蛋白1(GLUT1);半胱氨酸蛋白酶3(Caspase-3);半胱氨酸蛋白酶3 剪切体(Cleaved Caspase-3);鼠、兔二抗(武汉塞维尔生物科技)。
1.4 仪器
CO2培养箱(HERA cell 1501 型);生物安全柜(1300A2 型);倒置相差显微镜(CKX51 型);多功能酶标仪(ELx800 型);电泳仪及转膜仪(北京六一);凝胶成像仪(CHEMIDOC XRS+)。
2 方法
2.1 细胞培养
胃癌AGS 细胞复苏后,使用含10%小牛血清的RPMI-1640 培养基培养。培养于37 ℃、5%CO2及完全饱和湿度的细胞培养箱中。当细胞在培养皿中逐渐长至致密单层时,将细胞进行传代。
2.2 IC50测定
取对数生长期细胞,细胞计数调整浓度为(2~3)×104/mL,轻轻混匀,96 孔板每孔加入180 μL,待测细胞密度约为3 600~5 400/孔(边缘孔用无菌PBS 填充);将接种好的细胞培养96 孔板放入CO2细胞培养箱,至细胞单层铺满孔底(通常过夜)。将20 μL不同浓度木犀草素培养基溶液加入孔内(稀释倍率以DMSO含量1/1 000 以下为标准)。5%CO2、37 ℃继续培养细胞,观察镜下药物作用效果。弃含药培养基,每孔加入100 μL CCK8 工作液,继续培养1~2 h。在酶标仪OD 490 nm 处检测各孔的吸光值,收集数据,进行分析,绘制量效曲线。
2.3 葡萄糖浓度测定
取对数生长期细胞培养基,1 000 rpm 离心5 min后,取上清待测;加入测定试剂,在酶标仪OD 570 nm处检测各孔的吸光值,用空白管调零,测定各管的吸光光度值(标准品理论浓度为5.55 mmol/L);葡萄糖消耗量及消耗率按照公式计算。

2.4 乳酸浓度测定
配置酶工作液:试剂一(酶稀释液)和试剂二(酶储备液)按100∶1 体积比混合,现配现用(2~8 ℃,24 h 内有效)。配置显色剂:试剂四粉末1 支倒入1 瓶试剂三液体中,待粉末全部溶解,移入离心管中充分颠倒混匀,再重新移入瓶中,反复2~3 次,使二者充分混合(2~8 ℃避光保存,2 周有效),按照下面的次序依次配入。
①空白管:双蒸水20 μL + 酶工作液1 mL + 显色剂200 μL;②标准管:不同浓度的标准品20 μL(依次稀释为1、2、3、4、5、6 mmol/L)+酶工作液1 mL+显色剂200 μL;③测定管:待测样品20 μL + 酶工作液1 mL+显色剂200 μL。
混匀,37 ℃水浴精准反应10 min 后,每管加入终止液2 mL。在酶标仪OD 570 nm 处检测各孔的吸光值,用空白管调零,测定各管的吸光光度值。计算各管乳酸浓度。
2.5 蛋白免疫印迹法(Western Blot)检测相关蛋白表达
取对数生长期的胃癌AGS 细胞,调整细胞密度为1 × 105/mL,接种于6 孔板中,组别设置及加药情况同上,培养48 h,弃旧培养基,PBS 清洗,每皿加RIPA 裂解液100 μL,充分混匀裂解,吸取总蛋白匀浆,超声裂解后,4 ℃,12 000 rpm 离心20 min,收集上清,BCA 法测定总蛋白浓度,计算上样量。将提取的蛋白样品与5 × SDS 蛋白上样缓冲液按4∶1 体积比混匀,99 ℃煮蛋白10 min,按计算的上样量,加入合适浓度的SDS-PAGE 胶中进行电泳分离。电泳完毕后切胶转膜,转膜完成后,5%奶粉封闭1 h,分别加 入 相 应 一 抗(β-actin、HK Ⅱ、PKM2、GLUT1、Caspase-3、Cleaved Caspase-3),4 ℃孵 育 过 夜,TBST 洗膜4 次,每次10 min,加入相应种属来源的二抗中,常温缓慢摇床60 min。二抗取出后,TBST 洗膜4 次,每次10 min,ECL 特超敏液显影曝光检测蛋白表达情况。
2.6 统计学处理
Western Blot 采用Image Lab 软件分析灰度值,数据采用SPSS22.0 软件分析;数据采用均数± 标准差(±s)表示,满足正态分布和方差齐性的多组之间均数比较采用单因素方差分析,进一步两两比较采用LSD 法;方差不齐者采用Dunnetts'T3 检验。P≤0.05表示差异有统计学意义。
3 结果
3.1 木犀草素对胃癌AGS细胞系的体外抑制作用
观察木犀草素对胃癌AGS 细胞体外抑制作用并进行检测分析,计算木犀草素对胃癌AGS 细胞的IC50值为55.64 μmol/L,因此确定后续实验木犀草素低、中、高浓度分别为20、40、80 μmol/L。结果表明,木犀草素对胃癌AGS 细胞的增殖具有明显抑制效果。见表1和图1。
表1 木犀草素干预后各浓度胃癌AGS细胞存活率(±s)
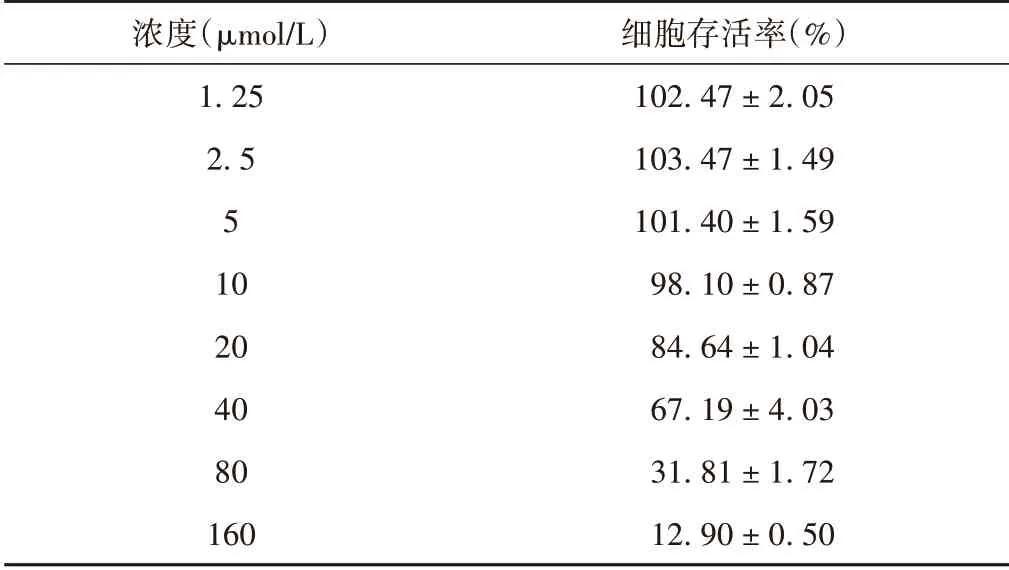
表1 木犀草素干预后各浓度胃癌AGS细胞存活率(±s)
浓度(μmol/L)1.25 2.5 5 10 20 40 80 160细胞存活率(%)102.47±2.05 103.47±1.49 101.40±1.59 98.10±0.87 84.64±1.04 67.19±4.03 31.81±1.72 12.90±0.50
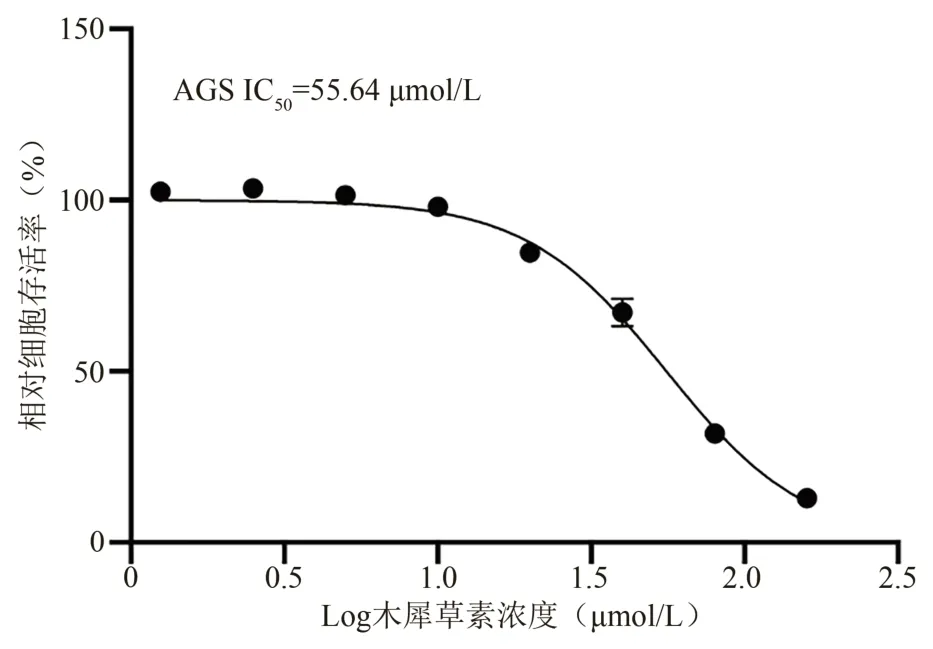
图1 木犀草素干预后胃癌AGS细胞存活率
3.2 木犀草素诱导胃癌AGS细胞凋亡
流式细胞术检测结果显示,在AGS 细胞系中,20、40 μmol/L 与空白对照组相比,无明显统计学意义,剂量升至80 μmol/L 时,凋亡率为(49.74±3.09)%,具有统计学意义(P <0.05)。见表2和图2。
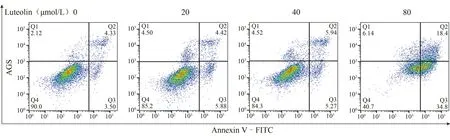
图2 木犀草素干预后各组胃癌AGS细胞的流式细胞双参数散点图
表2 木犀草素干预后各组胃癌AGS细胞凋亡率(±s)
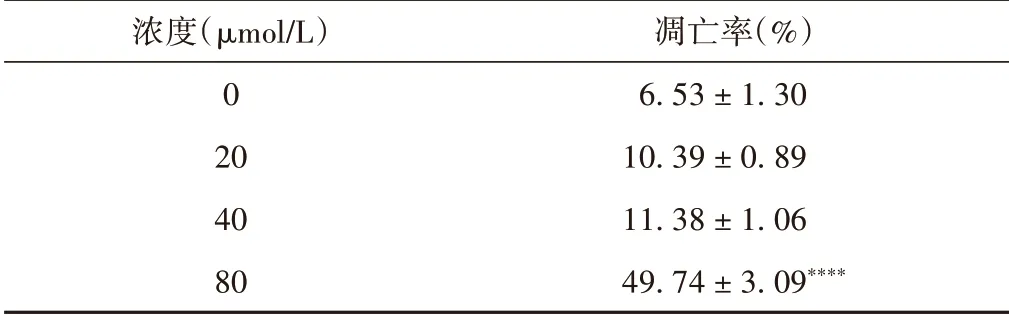
表2 木犀草素干预后各组胃癌AGS细胞凋亡率(±s)
注:与0 μmol/L比较,****P <0.000 1。
浓度(μmol/L)0 20 40 80凋亡率(%)6.53±1.30 10.39±0.89 11.38±1.06 49.74±3.09****
3.3 木犀草素对胃癌AGS 细胞有氧糖酵解水平的影响
通过对培养基中葡萄糖、乳酸浓度进行测定,计算葡萄糖消耗率及乳酸产量,对木犀草素对胃癌AGS 细胞的有氧糖酵解水平进行评估。结果显示,随着木犀草素浓度增大,葡萄糖消耗率不断减少,乳酸产量也不断减少(P<0.01)。见表3。

表3 木犀草素干预后各组细胞葡萄糖消耗率及乳酸产量(%)
3.4 木犀草素对各组细胞相关蛋白表达量的影响
为进一步揭示木犀草素对胃癌细胞的促凋亡影响,本研究对凋亡相关蛋白Caspase-3,Cleaved Caspase-3进行检测,结果表明,随着木犀草素浓度增大,Caspase-3 表达越来越低,Cleaved Caspase-3 表达越来越高,其促凋亡作用越明显(P<0.05)。随着木犀草素浓度升高,HKⅡ、PKM2、GLUT1 表达越来越低,呈现浓度依赖性(P<0.01,P<0.001,P<0.000 1)。结果见图3和表4。
表4 木犀草素干预后各组细胞相关蛋白相对表达量(±s)

表4 木犀草素干预后各组细胞相关蛋白相对表达量(±s)
注:与0 μmol/L比较,**P <0.01,***P <0.001,****P <0.000 1。
浓度(μmol/L)0 20 40 80 Caspase-3/Cleaved Caspase-3 1.00±0.01 0.73±0.08***0.43±0.04****0.06±0.02****HKⅡ/β-actin 1.00±0.02 0.96±0.03 0.93±0.02 0.78±0.05**PKM2/β-actin 1.00±0.04 0.93±0.05 0.65±0.09***0.34±0.05****GLUT1/β-actin 1.00±0.03 0.82±0.06***0.41±0.07****0.21±0.04****
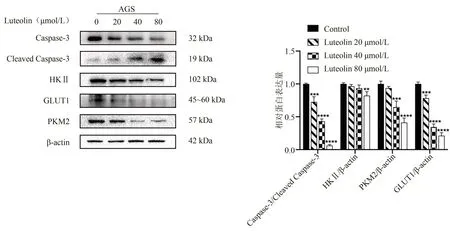
图3 木犀草素干预后各组细胞相关蛋白表达量
4 讨论
细胞代谢是一切生命体生存的基础,细胞从环境获取营养物质,通过一系列的反应,将营养物质转化为支持细胞各种功能的代谢产物。在正常氧条件下,正常细胞主要通过线粒体氧化磷酸化(OXPHOS)的三羧酸循环(TCA cycle)产生ATP;而肿瘤细胞即使氧气充足的情况下,也依赖糖酵解产生ATP来提供能量,大部分的碳链用于合成生物大分子,以维持肿瘤细胞高速增殖速率[8]。
肿瘤细胞特征性的有氧糖酵解现象,即为“Warburg现象”,由Otto Warburg首次提出[9]。动物细胞在正常情况下,对血液中葡萄糖的摄取受到严格的控制。各类生长因子,比如胰岛素(Insulin)、血管内皮生长因子(VEGF)和表皮生长因子(EGF),是指导细胞摄取葡萄糖的主要信号;与受生长因子调控的增殖的正常细胞不同的是,大多数肿瘤细胞为了补偿糖酵解这种低效的产能方式,通过基因的突变激活自主摄取葡萄糖的能力,从而使获得的葡萄糖比它们自身氧化代谢所需的葡萄糖多得多,因此肿瘤是一种消耗性疾病[10-12]。本研究中,实验证实木犀草素可诱导胃癌AGS 细胞凋亡,其凋亡机制可能与木犀草素下调有氧糖酵解途径有关。
