1例慢性肾脏病伴钙化防御及骨密度降低患者的药学服务*
2021-10-09张雪亓志刚
张雪,亓志刚
(1.江苏省无锡市惠山区人民医院药剂科,无锡 214187;2 .南京医科大学附属无锡市人民医院药学部,无锡 214023)
钙化防御是一种罕见的、危及生命的血管性综合征,以皮下组织钙化、组织缺血坏死和血管内血栓形成为主要特征,钙化部位常常伴有顽固性疼痛,可进展为溃疡和周围组织缺血性坏死,高发于终末期肾病(end-stage renal disease,ESRD)透析患者,确诊患者预后通常较差[1]。骨密度减少/骨质疏松是慢性肾脏病(chronic kidney disease,CKD)患者最常见的伴发疾病,诸多因素,如使用糖皮质激素、活性维生素D合成不足和继发性甲状旁腺功能亢进等,都会引起矿物质与骨代谢异常(chronic kidney disease-mineral and bone disorder,CKD-MBD)。对于钙化防御的治疗目前尚无统一的规范,而当该类患者同时伴有骨密度减少/骨质疏松时,治疗难度更大。笔者在本文介绍1例临床药师参与钙化防御伴骨密度减少的ESRD患者治疗方案调整及药学监护全过程,分析该病例中存在的治疗矛盾,并阐述个体化用药方案的制定,为临床对此类患者的处置和药学监护提供参考。
1 病例资料
患者,男,36岁。因“维持性血透6年余,左下肢疼痛2周”,于2019年11月27日入院。患者2006年开始反复咳嗽、咯血,伴尿泡沫增多,诊断为韦格纳肉芽肿,先后行血浆置换、糖皮质激素联合环磷酰胺、免疫抑制剂治疗。2012年8月因病情进展,诊断为韦格纳肉芽肿、CKD5期、类固醇糖尿病,开始维持性血液透析、降压、降糖、纠正CKD-MBD以及纠正贫血等治疗,并予甲泼尼龙片(剂量≥4 mg·d-1)联合吗替麦考酚治疗原发病,艾司奥美拉唑镁肠溶片预防胃黏膜损伤。2017年因恶心、呕吐、发热、乏力等反复住院,胃镜检查显示贲门炎慢性浅表性胃炎伴糜烂;2017年1月—2019年8月,患者进行3次骨密度检查均显示骨密度降低。
患者入院后,体检发现左下肢可触及皮下结节(图1),大小约1.5 cm×1 cm,表面光滑,活动度欠佳,无明显触痛。继续予维持性血液透析,甲泼尼龙联合吗替麦考酚酯控制原发病,艾司奥美拉唑抑酸护胃,骨化三醇、醋酸钙、阿仑膦酸钠预防骨质疏松,其余降压、纠正贫血等治疗(相关药物治疗方案调整见表1)。2019年11月27日查胸部CT显示主动脉壁钙化,冠脉走行区高密度,腹腔内部分血管壁钙化,肝脏钙化灶;复查骨密度依旧显示骨密度降低。2019年11月28日查血钙 2.20 mmol·L-1,血磷1.71 mmol·L-1,全段甲状旁腺素(immunoreactive parathyroid hormone,iPTH)660.6 pg·mL-1,血肌酐645.4 μmol·L-1,25-羟维生素D 5.98 ng·mL-1。2019年12月3日ECT骨显像显示双下肢皮下多发异位钙化(图2)。结合辅助检查结果,高度怀疑钙化防御,临床药师与医师讨论后予停用骨化三醇、醋酸钙,并加用碳酸镧、西那卡塞治疗CKD-MBD。另外,临床药师经与患者沟通得知患者近3年持续服用艾司奥美拉唑,目前并无胃部不适等胃炎表现,文献报道长期使用质子泵抑制药(proton pump inhibitor,PPI)增加骨质疏松风险,并与医师沟通后停用。临床药师指导患者新增药品用法及低磷饮食执行要点并发放用药指导单,患者于2019年12月6日带药出院。患者出院后无明显诱因下出现左下肢疼痛,症状持续不缓解,于2019年12月20日再次入院。

图1 钙化防御初期表现——下肢皮下结节
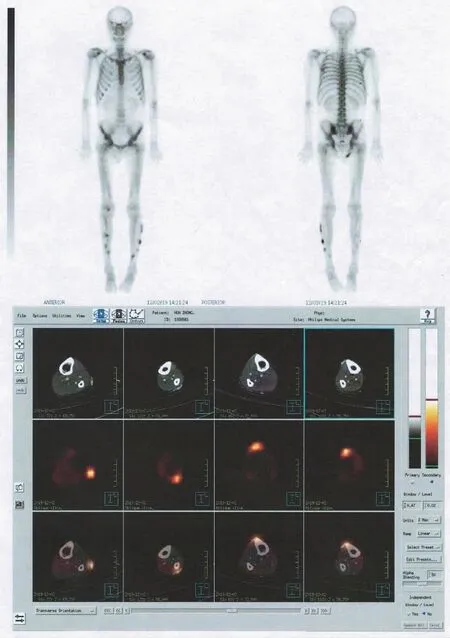
图2 双下肢皮下多发异位钙化(ECT骨显像)
2019年12月21日查血钙2.10 mmol·L-1、血磷1.48 mmol·L-1、血肌酐588.0 μmol·L-1,iPTH 88.10 pg·mL-1。2019年12月23日查25-羟维生素D 7.09 ng·mL-1。2019年12月24日复查iPTH 417.20 pg·mL-1急剧上升,血磷1.66 mmol·L-1、血钙1.95 mmol·L-1、离子钙0.98 mmol·L-1,考虑血钙、25-羟维生素D低,临床药师建议保留阿伦磷酸钠抑制骨吸收、预防骨质疏松。而对于骨化三醇是否恢复使用,存在治疗矛盾。医生考虑到骨折对预后的影响,最终恢复骨化三醇治疗(相关药物治疗方案调整见表1)。拟尝试加用硫代硫酸钠(sodium thiosulfate,STS)治疗钙化防御。经查阅文献,结合患者情况,最终确定用法用量,于2019年12月28日开始尝试予STS 64 g,每周3次,血透后静脉滴注。2019年12月30日患者诉有咽痛,稍有咳嗽,并出现腹泻,无腹痛,无畏寒、发热,予小檗碱止泻,查体考虑急性扁桃体炎予抗感染治疗。2019年12月31日患者左下肢疼痛较前好转,继续予STS治疗。患者在2019年12月28日—2020年1月23日期间共使用STS 64 g,治疗10次。2020年1月23日复查iPTH 182.70 pg·mL-1;血钙 2.13 mmol·L-1,血磷1.52 mmol·L-1,血肌酐 547.1 μmol·L-1。患者左下肢疼痛较前明显好转,皮下结节缩小,病情稳定出院。

表1 相关药物治疗方案调整
2 讨论
2.1钙化防御的治疗 钙化防御临床特点为皮下脂肪组织和真皮内微血管闭塞,导致剧烈疼痛、缺血性皮肤坏死。皮肤活检是钙化防御的标准诊断方法,但因其可引起新发皮损,导致溃疡难以愈合,在临床实践中有争议。该患者左下肢皮下结节、疼痛无皮肤破溃,结合ECT骨显像评估其处于钙化防御早期阶段。钙化防御的危险因素包括高磷血症、高钙磷沉积、甲状旁腺功能亢进、自身免疫病、长期透析、服用铁剂、体质量下降过快以及药物使用(华法令、含钙的磷结合剂、维生素D类似物、糖皮质激素等)等[2-4]。钙化防御的治疗仍在探索中,由于涉及多个器官系统,往往需要多个学科共同协作,目前尚无指南或共识可供参考。近年来研究报道钙化防御的治疗包括去除诱因(如华法林、糖皮质激素、钙剂、活性维生素D等),以及疼痛管理、皮肤损伤处理、高压氧疗法以及大剂量STS为主的药物疗法治疗[5-6]。该患者存在的钙化防御诱因包括糖皮质激素、钙剂、活性维生素D的使用,糖皮质激素用来控制韦格纳肉芽肿原发病,无法停用,故临床药师建议停用醋酸钙及骨化三醇。另外,根据患者2019年11月28日血磷1.71 mmol·L-1,iPTH 660.6 pg·mL-1,建议加用非含钙磷结合剂(碳酸镧)、拟钙剂(西那卡塞)积极治疗高磷血症和甲状旁腺功能亢进,并先后10次予大剂量STS治疗。
STS是一种氰化物中毒的解毒剂,早在2004年即有STS成功治疗钙化防御的报道[7],但目前仍属于超说明书用药。STS治疗钙化防御的机制尚不清楚,有研究表明,STS是一种还原剂,易溶于水,可与多种金属离子螯合形成化合物[8],其中就可能通过螯合诱导钙清除。另外,STS还具有抗氧化、血管舒张和抑制脂肪细胞钙化的作用[5]。一项涉及60例钙化防御透析患者(对照组与治疗组各30例)的研究,对照组患者给予常规治疗,治疗组患者给予STS 25 g在透析结束0.5 h前进行静脉注射。结果表明,与对照组比较,经STS治疗后患者病情缓解率显著提高,不良反应发生率低,患者各项生活质量评分提升显著[9]。对于钙化防御的治疗,文献报道STS的常用单次剂量为5~25 g,平均每周给药3次,给药方式主要为静脉给药[10]。诸多文献中多个病例均采用一个典型的剂量,即为STS 25 g溶于0.9%氯化钠注射液100 mL,在血液透析的最后30~60 min内,每周静脉注射3次[11-12],安全性较好,少数患者会出现恶心、呕吐、低钙血症、QT间期延长、低血压、代谢性酸中毒等[5-6]。有研究表明为了减轻不良反应,对于体质量<60 kg的患者可调整STS剂量为12.5 g[13]。也有小剂量STS治疗严重钙化防御的案例,每次给予患者STS 6.4 g,每周3次,连续治疗1个月,患者疼痛完全缓解,皮损基本愈合,并未出现任何不良反应[14]。但尚无指南推荐STS的最佳治疗剂量,现阶段只能根据患者的病情、用药后病情的改善程度以及患者的耐受程度来确定或调整STS的用法。该患者体质量为48.9 kg(<60 kg),处于钙化防御早期阶段,且患者骨密度减少、25-羟维生素D低、血钙低,予STS 6.4 g溶于0.9%氯化钠注射液250 mL在血液透析后静脉滴注,患者在使用STS过程中没有出现明显不适症状,经过10次治疗后病情好转,提示有效。
有文献报道对于钙化防御合并高磷血症、甲状旁腺功能亢进患者,使用非含钙磷结合剂(如碳酸镧)优于含钙的磷结合剂[15],碳酸镧在降低血磷水平的同时不增加钙负荷,可降低患者血管钙化的风险。同时,该患者在钙化防御的基础上,同时存在高磷及iPTH升高,建议给予钙敏感受体激动剂西那卡塞治疗,不仅可以抑制iPTH水平、降磷、减轻异位钙化,也可减少骨折风险[16]。CKD-MBD的治疗药物调整为碳酸镧和西那卡塞后,患者相关指标逐步改善,2020年1月23日复查iPTH 182.70 pg·mL-1;血钙 2.13 mmol·L-1,血磷1.52 mmol·L-1,故暂不考虑甲状旁腺切除术。2017 KDIGO指南推荐:CKD G5D 期患者,建议将iPTH水平维持在正常值上限的2~9倍[17]。然而对于亚洲人群,合适的iPTH范围有待进一步研究。
2.2骨质疏松的防治 患者为ESRD,长期使用糖皮质激素治疗原发病(韦格纳肉芽肿),合并维生素D缺乏、继发性甲状旁腺功能亢进,这些因素均会导致患者骨密度下降,甚至最终导致骨折、致残致死。根据《糖皮质激素性骨质疏松症预防与治疗指南(2017)》,接受泼尼松治疗剂量≥2.5 mg·d-1且疗程≥3个月的成人患者,推荐优化钙剂(1000~1200 mg·d-1)和维生素D的摄入(600~800 U·d-1)及生活方式的改变[18]。另外,患者多次检测25-羟维生素D浓度<10 ng·mL-1,专家共识建议至少将血清25-羟维生素D浓度调整至>20 ng·mL-1,以防止维生素D缺乏引发的继发性甲状旁腺功能亢进症和骨密度的降低[19]。该患者似乎是有明确使用维生素D类及钙剂的指征。由于肾衰竭患者对维生素D的1α羟化能力减弱,需使用已经过1α羟化的阿法骨化醇或骨化三醇补充维生素D。患者既往长期使用醋酸钙、骨化三醇补钙治疗,阿仑膦酸钠抗骨质疏松,然而2019年11月复查依然存在骨密度降低。指南推荐对于骨密度降低患者( BMD:-2.5 2.3艾司奥美拉唑的使用 PPIs是目前临床胃酸相关疾病治疗中应用广泛、抑酸疗效最突出的药物。肾功能不全患者因其长期使用糖皮质激素、常使用PPIs预防胃黏膜损伤。另外,该患者曾有慢性胃炎史、贲门撕裂史,故持续使用艾司奥美拉唑镁肠溶片>3年。长期使用PPIs,胃内pH值会发生改变,从而抑制肠道对钙的吸收,增加骨折风险[21]。有调查显示预防应用PPIs的住院患者中超过50%为无指征用药。通过与患者沟通,临床药师了解到该患者在目前并无胃部不适等胃炎表现,既往贲门撕裂史可能与阿仑膦酸钠的服用方法错误有关。目前服用甲泼尼龙剂量为6 mg·d-1,根据《质子泵抑制剂预防性应用专家共识(2018)》,患者无明确预防性使用PPIs指征[22],与医生沟通后予停用。 通过参与该患者的药物治疗及药学监护,总结如下:①钙化防御特异性治疗方案仍需要进一步摸索,以STS为主的综合性治疗需要结合患者病情及耐受性调整,获得最佳的治疗剂量和疗程;②患者钙化防御伴骨密度降低,治疗钙化防御需避免外源钙质的补充,而防治骨质疏松需要补钙,二者之间存在治疗矛盾。③长期使用PPIs会增加患者骨折的风险,患者无明确的PPI使用指征时建议停用。3 结束语
