《2020 ERS声明:慢性血栓栓塞性肺动脉高压》解读*
2021-10-09尹琪楠韩丽珠边原黄雪飞雷洋宋玉洁童荣生
尹琪楠,韩丽珠,边原,黄雪飞,雷洋,宋玉洁,童荣生
(四川省医学科学院·四川省人民医院/电子科技大学附属医院药学部·个体化药物治疗四川省重点实验室,成都 610072)
慢性血栓栓塞性肺动脉高压(chronic thromboembolic pulmonary hypertension,CTEPH)是一种罕见的急性肺栓塞并发症,无论有无症状,近端肺动脉发生血栓以及<500 μm的次微血管病变,导致肺血管阻力增加并进展为右心力衰竭。在肺动脉高压患者中,当肺通气灌注扫描显示不匹配的灌注缺损并通过右心导管和血管成像证实时,即怀疑为CTEPH。目前除了终身抗凝,治疗方式还包括手术,血管成形术和根据病灶的位置和特点进行治疗。2020年12月,欧洲呼吸学会(European Respiratory Society,ERS)发布《ERS声明:慢性血栓栓塞性肺动脉高压》[1],该声明内容涵盖CTEPH的定义、诊断、流行病学、随访、病理生理学、肺动脉内膜切除治疗、球囊肺血管成形术、药物以及联合治疗、康复管理等,笔者对该声明进行解读。
1 CTEPH的定义
2015年,欧洲心脏病学会(European Society of Cardiology,ESC)/ERS肺高血压诊断和治疗指南[2]中,说明CTEPH的诊断是基于至少3个月有效抗凝治疗后,表现为平均肺动脉压(mean pulmonary arterial pressure,mPAP)≥25 mmHg(1 mmHg=0.133 kPa)与肺动脉楔压(pulmonary artery wedge pressure,PAWP)≤15 mmHg,经肺动脉CT血管造影(computed tomography pulmonary angiography,CTPA)、磁共振成像(MRI)可见CTEPH的特定诊断迹象,如环形狭窄、网/缝和慢性全闭塞(袋状病变或锥形病变)。
根据静息时是否存在肺动脉高压,目前有两个术语用于描述有症状的慢性血栓栓塞性肺动脉闭塞患者:CTEPH和慢性血栓栓塞性疾病(chronic thromboembolic disease,CTED)。降低的mPAP、肺血管阻力(pulmonary vascular resistance,PVR)阈值可能影响CTED患者被认定为CTEPH患者[3-7]。对于慢性血栓栓塞性肺疾病(chronic thromboembolic pulmonary disease,CTEPD)患者,肺动脉高压(pulmonary hypertension,PH)的存在不仅是有血栓阻塞近端血管的结果,还可能与继发性微血管病变以及潜在的肺部疾病或左心疾病有关。心肺功能运动试验(cardiopulmonary exercise test,CPET)和运动状态下右心导管检查(exercise right heart catheterisation,ex-RHC)有助于定义CTEPD。CPET的应用包括每分钟通气量/每分钟二氧化碳产生量(VE/VCO2)斜率和呼气末二氧化碳分压(PETCO2),CPET不仅用于预后,还用于疑似肺血管疾病患者呼吸困难的鉴别诊断。在许多CTEPH患者中,mPAP通过手术或多种药物治疗得以恢复,患者虽感觉无明显异常,但所有肺血管难以恢复至发病前的状态。此外,预期寿命可能在一定程度上受到终身抗凝相关的潜在治疗风险影响。
2 CTEPH的诊断
对于PH患者,V/Q扫描显示不匹配的灌注缺损,怀疑CTEPH时,诊断流程见图1。V/Q扫描仍然是排除CTEPD的最有效筛选工具。VQ单光子发射计算机断层扫描(single photon emission computed tomography,SPECT)已被证明优于平面成像,是首选方法。
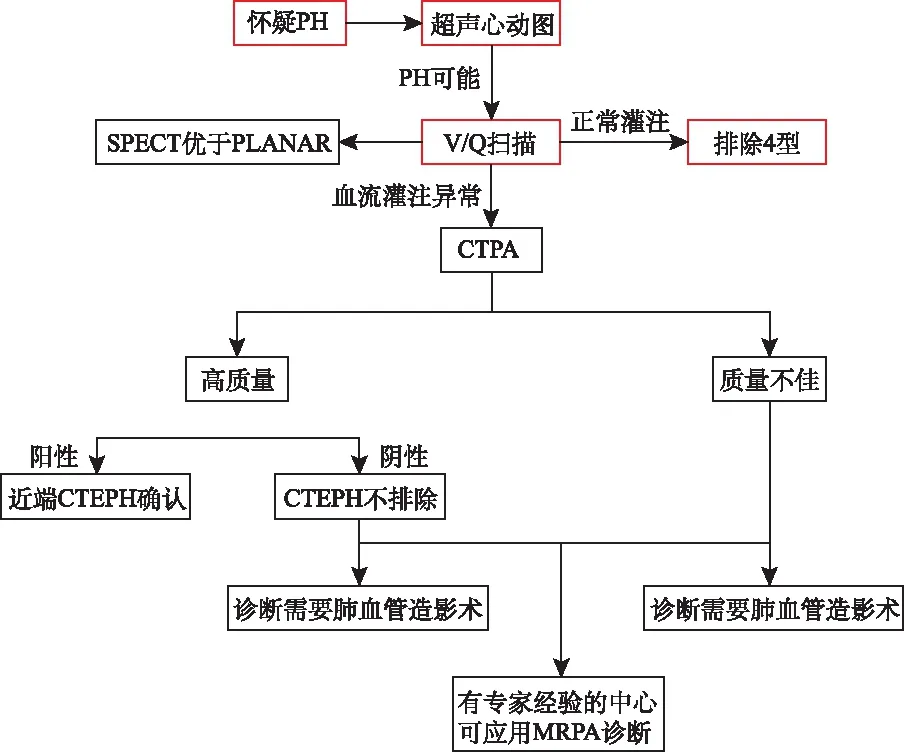
图1 CTEPH诊断流程
3 CTEPH的流行病学
CTEPH是一种罕见且不易诊断的肺栓塞并发症,首次出现时可能被误诊为急性肺栓塞。根据不同国家CTEPH的流行病学分析估计,日本患病率为19‰,美国和欧洲患病率30‰~50‰[8]。目前文献尚不能证明静脉血栓栓塞(venous thromboembolism,VTE)患者使用维生素K拮抗剂(vitamin K antagonist,VKAs)和非维生素K拮抗剂口服抗凝剂(non-vitamin K antagonist oral anticoagulant,NOACs)治疗时CTEPH发病率的差异。但在某些特定情况下,如《ESC急性肺栓塞诊断和治疗指南》(2019版)推荐使用NOACs而不是VKA,因为NOACs使用方便,耐受性更好[9-10]。在其他特殊临床情况下,如肥胖患者体质量指数>40 kg·(m2)-1或体质量>120 kg,伴随质子泵抑制剂或可减少达比加群胃肠道吸收的H2拮抗剂等,药动学必须仔细考虑优化这些药物的风险/效益,以预防血栓栓塞事件和CTEPD复发[11-12]。临床上永久性血管内装置(起搏器、输液室、VA分流器)、炎症性肠病和原发性血小板血症已被确定为CTEPH的危险因素[13-14]。
4 CTEPH的病理生理学
解剖学角度,大弹性肺动脉近端栓塞和<500 μm肺血管继发性微血管病变参与CTEPH患者PVR的增加。在近端,这些病变似乎是组织学上与血管成像上所知的缝隙、网、狭窄或囊袋相对应的病变。此外,大而有弹性的肺动脉长期受到肺动脉压升高的影响,导致动脉瘤样病变,血管壁厚度增加。不同的是,典型的阻塞性慢性血栓栓塞性病变表现为血管闭塞,偶尔还会出现多发性继发性腔,称为碎屑状病变。微血管病变的特点是在毛细血管前动脉、毛细血管(严重者为肺血管瘤样病变)和肺小静脉(肺小静脉闭塞样病变)的水平上重塑。
5 手术治疗CTEPH
肺动脉内膜切除术(pulmonary endarterrectomy,PEA)是可手术患者的首选治疗方法,可使血流动力学和临床改善,降低早期死亡率。PEA是否成功没有明确标准,PEA术后残余肺动脉高压(pulmonary hypertension,PH)亦无标准,复发的PH更为罕见,在英国的系列研究中,356例患者中只有6例在PEA后出现新的肺栓塞[17]。PEA术后早期对严重残余PH的处理具有挑战性,是最常见的院内死亡原因。体外膜肺氧合(extra corporeal membrane oxygenation,ECMO)可成功帮助挽救严重残余PH和血流动力学衰竭的患者,并允许桥接肺移植,但经验有限[18]。药物治疗在早期阶段尚未证明有益。PEA后患者长期预后也受到残余PH的影响,数据显示,重新评估时mPAP≥38 mmHg和PVR≥425 dynes·s-1·cm-5可预测与CTEPH相关的死亡[15]。开始药物治疗的建议阈值为mPAP>30 mmHg[16]。对于术后PVR>300 dynes·s-1·cm-5的患者,有证据表明在CHEST-1研究中使用利奥西呱可降低PVR并改善6 min步行距离(6MWD)[19]。2018WSPH治疗算法建议对PEA后持续症状性PH的患者使用药物治疗并考虑使用肺血管球囊扩张成形术(balloon pulmonary angioplasty,BPA)或重做PEA[20]。
BPA不能替代PEA或CTEPH的药物靶向治疗,BPA填补CTEPH患者不符合PEA条件的干预空白,可以考虑将BPA与任何一种疗法结合作为一种补充治疗方式[21-23]。BPA通过改善肺循环的血流,改善肺功能、右心室功能、肺血流动力学、6MWD、功能分级和生活质量。目前普遍认为BPA相关的肺损伤是由钢丝操作或球囊过度扩张期间的机械性血管损伤引起的[24]。结果表明,不同人群BPA后并发症发生率与BPA时PH的严重程度密切相关。BPA的治疗仍有致死风险。在较短的时间,BPA已经从一种实验性治疗方式发展成为不能手术的CTEPH的既定治疗方案。
6 CTEPH的治疗
6.1药物治疗 除了终身抗凝外,CTEPH的基础治疗还包括右心力衰竭时给予的利尿剂和低氧血症患者氧气。传统上,VKAs是PAH和CTEPH抗凝治疗的主要药物,但NOACs的应用越来越多。关于NOACs在CTEPH中的有效性和安全性,目前还没有强有力的数据。此外,在CTEPH中NOACs和肺血管扩张剂之间的药物相互作用还需要了解。在BPA治疗的情况下,大多数专家似乎都在进行不间断的持续VKA治疗。VKAs(INR靶点2.5)也在血栓性抗磷脂综合征(狼疮抗凝剂、抗心磷脂抗体和同一同种型抗-β2-糖蛋白I抗体呈三重阳性)的高危患者中具有比NOACs更多的益处和更少的风险[25]。
鸟苷酸环化酶刺激剂利奥西呱显著增加6MWD,并降低PVR[19]。利奥西呱被批准用于不能手术的CTEPH或PEA后持续性/复发性PH的患者。此外,在不能手术的CTEPH患者中使用内皮素抑制剂联合磷酸二酯酶-5抑制剂或利奥西呱进行初始口服联合治疗[26]与单药治疗相比,首次口服联合治疗导致PVR更明显的降低。西地那非是一种磷酸二酯酶5型抑制剂,未被批准用于CTEPH。双重内皮素受体拮抗剂(endothelin receptor antagonist,ERA)波生坦不被批准用于CTEPH。对于不能手术的CTEPH或PEA后持续性/复发性PH患者,曲前列尼尔的上市许可是有效的,6MWD、PVR、功能分级和NT-proBNP均有改善。
大多数CTEPH患者在BPA和(或)PEA治疗后临床和血流动力学都有明显改善。即使PEA和(或)BPA在休息时肺血流动力学正常,终身抗凝也是强制性的,而通常不再需要利尿剂和氧气。同样,在成功的BPA和(或)PEA后,可以考虑停止或减少PH药物。
6.2综合治疗 目前的治疗模式已经演变为包括多模式综合应用。这种方法包括采用PEA、BPA和药物治疗的组合,分别针对近端病变、远端病变和微血管病变。肺移植很少被考虑其中。在可手术的CTEPH患者中,对术前PVR较高患者采用PH靶向治疗可改善术前肺血流动力学,并有可能降低PEA的发病率和死亡率。目前还不能根据结果确定可手术性CTEPH患者术前PH靶向治疗是否能提高生存率。根据PH的严重程度,具有混合性解剖病变的低风险患者可在术后随访期间进行PEA,必要时进行BPA,高危患者(术前PVR高)可能受益于联合治疗,采用BPA(术前或术中同时)和PEA降低手术风险,提高最终疗效。然而,到目前为止,关于该策略对术后结果影响的数据非常有限,需要进一步的研究来证实其临床相关性。
7 康复
尽管康复的有益效果尚未完全了解,但在肺动脉高压和CTEPH的动物模型中,骨骼肌毛细血管的增加以及康复后右心室功能的改善都能测量。尽管与PAH相比,CTEPH的运动生理学略有不同,但有理由相信,两种情况下康复的积极作用是相似的。大多数关于CTEPH和PAH康复的关键试验都是基于三级转诊机构的住院培训。PH的运动训练应该由PH专家和在严重受损患者的康复方面有经验的物理医师单独调整和密切监督。患者在执行有监督的康复计划之前,应接受优化的目标治疗,并处于稳定的临床状态[1]。康复的另一个潜在作用是在PEA和BPA后的恢复阶段。
本文虽对PH的药物进行介绍,但是未对其每一类药物进行具体的用法用量说明以及其可能的不良反应,也没有进行推荐级别的分级。《中国肺动脉高压诊断与治疗指南(2021版)》[27]及《2020 加拿大心血管学会/加拿大胸科学会立场声明:肺动脉高压》[28]进行治疗PH药物的总结以及比较,见表1。
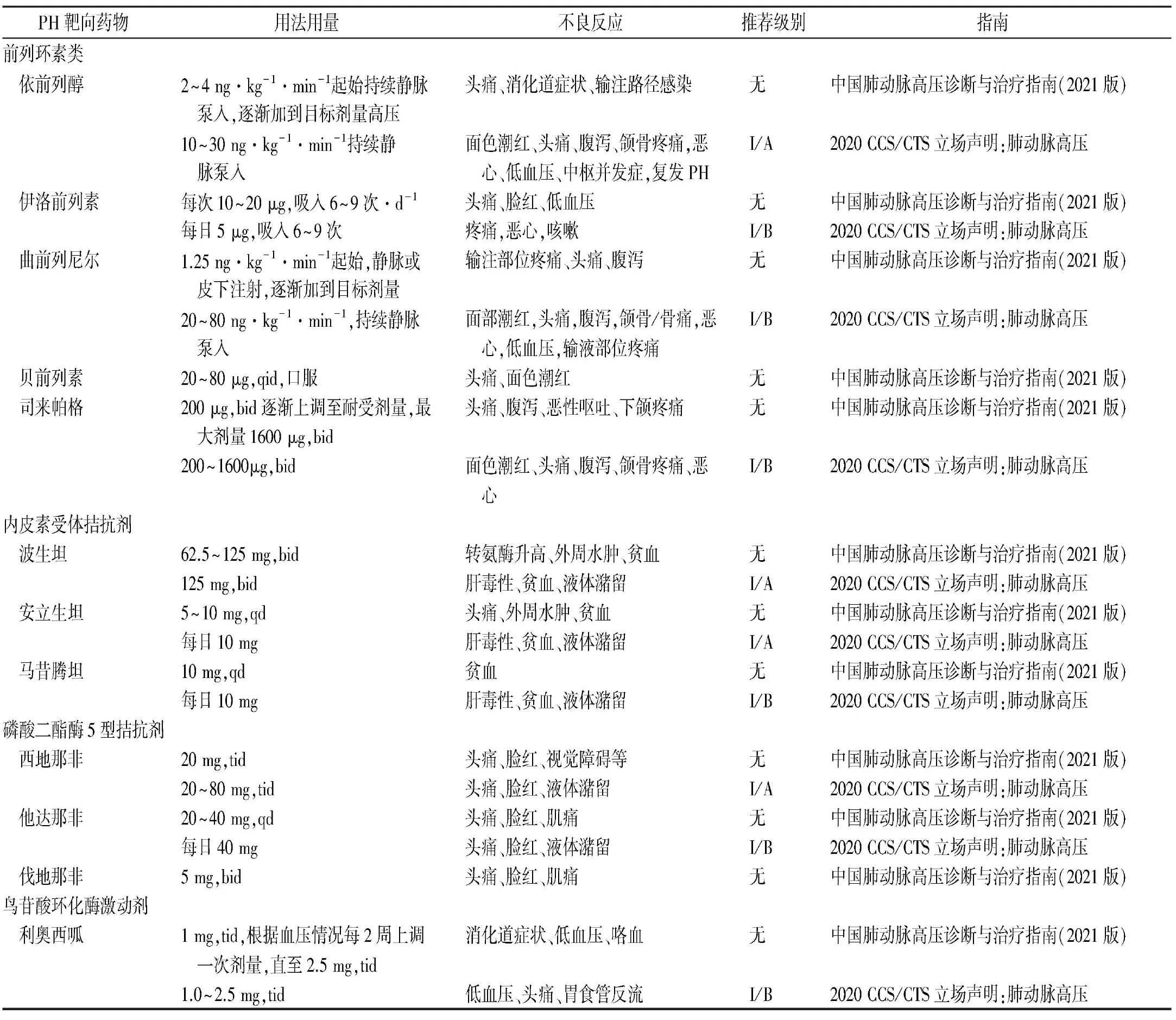
表1 PH靶向药物在不同指南间的比较
总之,本声明概述了有关诊断的文献和当前实践的回顾,以及CTEPH的管理。声明总结目前的知识,并且对于未来进一步的研究给出了建议,为CTEPH的规范化管理提供了参考。
