福田红树林生态公园浮游植物群落结构季节变化特征
2021-10-08陈叶花李俊杰谢恺琪黄淑燕郭青青雷安平
陈叶花 李俊杰 谢恺琪 黄淑燕 郭青青 雷安平 张 华,4*
(1 深圳大学生命与海洋科学学院,深圳市海洋生物资源与生态环境重点实验室,广东 深圳 518071;2 深圳市红树林湿地保护基金,广东 深圳 518040;3 深圳湾实验室, 广东 深圳 518132;4 深圳市环境科学研究院,广东 深圳 518022)
浮游植物是指分布于淡水、半咸水或咸水等水域上层进行浮游生活的微小植物,个体极其微小,需要借助各种显微镜才能观察到其大小和形态特征。一般来说浮游植物就是指浮游藻类,具有高生命力、高繁殖力、对外界环境变化很敏感等特征(严如玉等, 2020)。其种群结构会随空间和时间发生变化,种类组成也因水体有机质和营养盐类含量的不同而有显著差别(严如玉等, 2020; 王艳等,2020)。
城市公园水体是城市生态系统的重要组成部分,在构建城市景观、调节城市气候、创造适合城区居民生活和工作环境方面的作用尤为突出。近年来很多生态公园景观水体富营养化加剧,其关注度逐年增加。浮游藻类调查常被用作其水体营养状态判断和公园水质管控的重要依据(朱明明等, 2020; 张平等, 2017; 朱为菊等, 2014)。本研究调查了深圳福田红树林生态公园的浮游藻类种类多样性,掌握该公园水体浮游藻类种类组成、空间分布及季节变化情况,以期为福田红树林的保护和管理提供基础数据和参考。
1 研究区概况与研究方法
1.1 研究区概况
深圳福田红树林生态公园(113°56′~114°3′ E,22°30′~22°32′ N)位于福田红树林国家级自然保护区东侧,南面为深圳湾海域,与香港米埔自然保护区隔河相望,面积约38 hm2,是深圳湾湿地的重要组成部分(石婷等, 2015)。深圳福田红树林生态公园由福田区人民政府等5家政府机构共同建设,于2015年12月正式向公众开放,是一个集生态修复、科普教育、休闲游憩等功能为一体的城市公园。
根据该生态公园的水体分布特征,共设置了5个采样点:大湖(1#)、小湖(2#)、老河口(3#)、监测站(4#)和修复带(5#)(图1)。本次研究分别于2019年1月、4月、7月和10月进行4次样品采集,其中监测站和修复带于2019年4月开始采样调查。

图1 福田红树林生态公园水质采样点位置图Fig.1 Location of sampling sites in Futian mangrove ecological park
以上5个采样点生境差别较大:小湖周边水生高等植物丰茂,水体封闭,丰水期最深超过4 m;大湖水面开阔,深度较浅,清澈见底,有时从河口抽水来补充;修复带位于海域内湾处,周围水生植物较多;老河口水体与海水相连,水体流动性强,泥沙含量较高;监测站周围有滩涂,经常有来自深圳湾的活水补充,水体泥沙含量很高。
1.2 样品采集与分析
用25#的浮游生物网采集样品,沉淀浓缩固定后用于浮游藻类鉴定。用有机玻璃采水器采集表层水样2 L,用15‰Lugol’ s试剂固定后静沉24~36 h,转入定量标本瓶中定容并标记。观察时将浓缩样摇匀,取0.1 mL于血球计数板中,置于10×40倍显微镜下对各种藻类进行个体计数。一般每样计数2片(如果2片的数值与其平均值之差>±15%,需进行第3片计数),换算出1 L水样中所含藻类的个体数量(赵先富等, 2005;胡方凡等,2011)。
1.3 水质状况
从水体盐度来看,小湖为淡水湖泊,盐度最低,其盐度为0.21‰~0.35‰;大湖为半咸水,水体盐度范围为0.43‰~5.48‰;修复带、监测站、老河口的盐度最高,因为水体与海水相连,均为半咸水,水体盐度分别为1.30‰~11.61‰、0.67‰~14.10‰、1.21‰~11.61‰。5个样点均在冬季盐度最高,春夏季由于降水充沛而盐度较低,秋季盐度较春夏季高。
水体营养盐的含量和季节方面,大湖、小湖的氮含量远比其它几个点低,水体氮含量为1.09 ~2.33 mg/L、1.34~2.35 mg/L,修 复 带、监测站、老河口的水体氮含量为3.59~6.69 mg/L、3.43~6.55 mg/L、2.67 ~8.10 mg/L,但季节变化不明显;大湖和老河口磷含量很低,为0~0.37 mg/L、0.07~0.36 mg/L,其次是小湖,为0~0.44 mg/L,修复带、监测站的水体磷含量分 别 为0.03~1.02 mg/L、0.11 ~0.56 mg/L。
1.4 多样性分析
多样性指数可用来表示物种的数量和物种分布的均匀性,多样性指数越高,说明群落越稳定,抵抗外界干扰的能力就越强。群落的物种数量越多,多样性指数值就越大,多样性指数与种群个体数量也相关(王江源等, 2011)。本研究主要计算Shannon-Weiner多样性指数(H′)、Margalef物种丰富度指数(H)和Simpson优势度指数(D)(沈韫芬等, 1994)。
2 结果与分析
2.1 浮游植物组成
本研究共鉴定出浮游植物7门55属69种,各门藻类种属数依次为:硅藻(Diatom)15属22种,绿藻(Chlorophyta)20属26种,蓝藻(Cyanophyta)9属9种,甲藻(Dinoflagellate)4属5种,隐藻(Cryptophyta)1属1种,裸藻(Euglena)3属3种,金藻(Chrysophyta)3属3种。各采样点浮游植物物种数季节变化见图2。

图2 浮游植物种类组成Fig.2 Species composition of phytoplankton
硅藻中以小环藻属(Cyclotella)、舟形藻属(Navicula)、菱形藻属(Nitzschia)为主;绿藻以栅藻属(Scenedesmus)、十字藻属(Crucigenia)、卵囊藻(Oocystis)、小球藻(Chlorella vulgaris)的种类为主;蓝藻中以伪鱼腥藻属(Pseudanabaena)、平裂藻属(Merismopedia)的种类为主;甲藻以裸甲藻属(Gymnodinium)、多甲藻属(Peridinium)、拟多甲藻属(Peridiniopsis)的种类为主;裸藻中以囊裸藻属(Trachelomonas)为主;金藻中以金杯藻属(Kephyrion)和锥囊藻属(Dinobryon)为主。
2.2 浮游植物密度与优势类群
浮游植物的密度变化见图3,5个采样点的藻类密度差异很大,而且随着季节变化。老河口的年均藻密度最高(3.47×103个/mL),其次为监测站(2.92×103个/mL)、修复带(1.84×103个/mL)、小湖(1.00×103个/mL),大湖的藻密度最低(0.09×103个/mL)。
在季节变化方面,大湖的藻密度在1月最高,为0.19×103个/mL,小湖、修复带的藻密度在7月最高,分别为1.73×103个/mL、2.6×103个/mL,监测站和老河口藻密度保持逐月增加的趋势,在10月最高,分别为7.06×103个/mL、10.18×103个/mL。
5个采样点浮游植物的种类组成与优势类群差异较大(图3)。大湖的种类较少,无明显优势门。小湖的优势门变化情况为:1月为甲藻,4月为蓝藻,7月和10月主要以绿藻为优势。修复带的优势种变化情况为:4月为硅藻,7月为蓝藻,10月为硅藻。监测站与老河口相似,全年以硅藻为优势种。
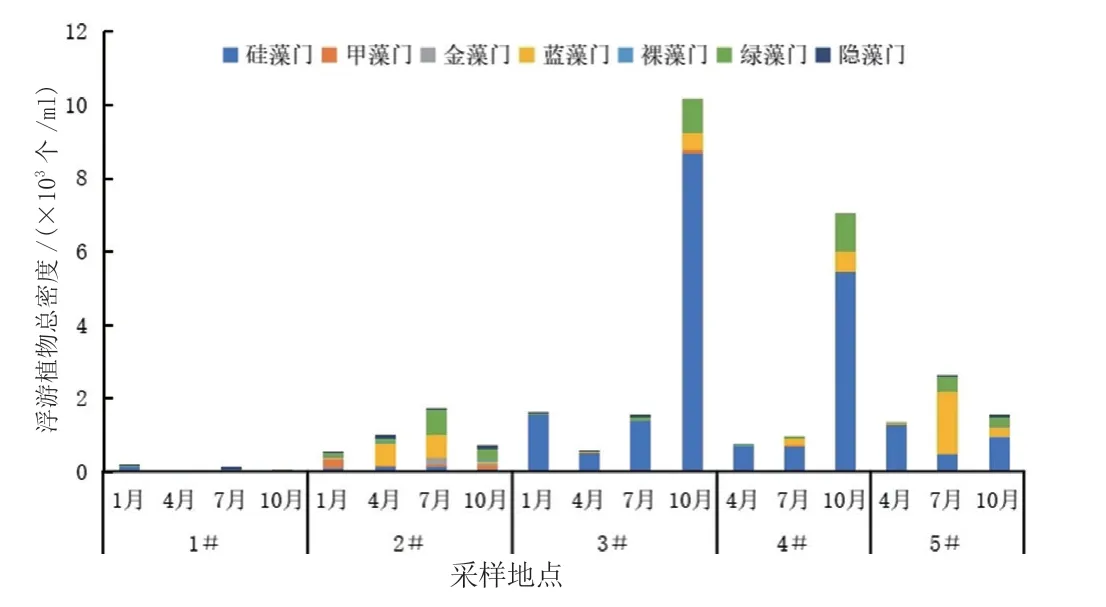
图3 不同月份浮游植物总密度Fig.3 The total density of phytoplankton in different months
2.3 多样性指数
多样性指数表示群落结构的复杂程度,反映两方面的内容:(1)群落内种的数量;(2)各种内个体数的均等性,即种数越多,而且各个种的个体数相等,多样性就越大(刘书宇等, 2007)。分析了5个采样点在4个季度的H′、H和D指数,结果显示:福田红树林生态公园的浮游藻类多样性指数存在较大的时空差异,H′变化范围为0~2.94,平均值1.29;H变化范围为0~3.8,平均值为1.67;D变化范围为0~0.92,平均值0.60(表1)。
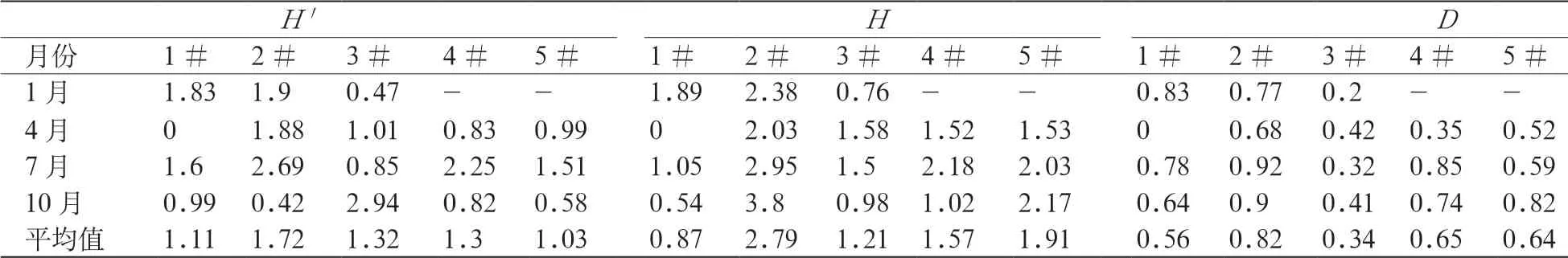
表1 浮游植物群落结构多样性指数Table 1 Diversity index of phytoplankton community structure
水体越干净,多样性指数越高;水体如果被污染,多样性指数会降低(刘忱等, 2015)。但也有学者提出质疑,用多样性指数表示浮游生物的群落特征虽应用广泛,但受多种因素的影响,如样品大小、鉴定程度以及水质状况等,而且用多样性指数表征水体污染程度时对水质的要求也有一定范围。例如,在极清洁的水体中,由于水体的寡营养而导致浮游植物的种类和数量都不多,这时多样性指数也很低。也有学者在计算重污染水体的多样性指数时,得到重污染水体的多样性指数高,而与其它指标相关性不好的结果(董立新等, 2017; 张景平等, 2010)。
本研究中,大湖浮游藻类的种类和数量较少,多样性指数很低,但大湖的水质状况很好。因此,用多样性指数表示水体污染程度时,需结合水质参数进行综合评价。
3 讨论
3.1 浮游植物群落季节变化
浮游植物群落结构的季节变化主要受水温和营养盐影响。大湖营养盐的含量极低,浮游植物种类一直很少。小湖为淡水湖泊,与天然湖泊类似,气温较低时适合硅甲藻类生长,气温较高时适合蓝绿藻生长(王国涛等, 2021);修复带位于海域内湾处,但其周围水草丰茂,水体在夏季营养盐的含量较高,因此出现了与小湖类似的夏季蓝绿藻优势现象。而老河口、监测站位于河口处,不同于淡水湖泊,全年均以硅藻为绝对优势。
3.2 水质评价
以浮游植物种类和数量为依据,结合水质参数,可以对水体进行水质判断,从而提出合理的水体管理建议。对于淡水水体,提出了用藻类群落组成和优势种群的变化来评价水体污染的方法(表2)(金相灿等, 1990),故小湖适用,其它几个监测点属于半咸水水体,不适用于该方法。1月小湖的优势种是甲藻门的裸甲藻,4月优势种是蓝藻门的伪鱼腥藻;7月优势种是蓝藻门的平裂藻,金藻数量也较多;10月绿藻门的小球藻为优势种。由优势种群来判断,小湖处于贫营养或中营养水平。结合小湖的水质参数,小湖的总N、P含量在调查期间均比较低,pH值介于微酸性到微碱性间,也说明小湖目前处于较低的营养水平阶段。
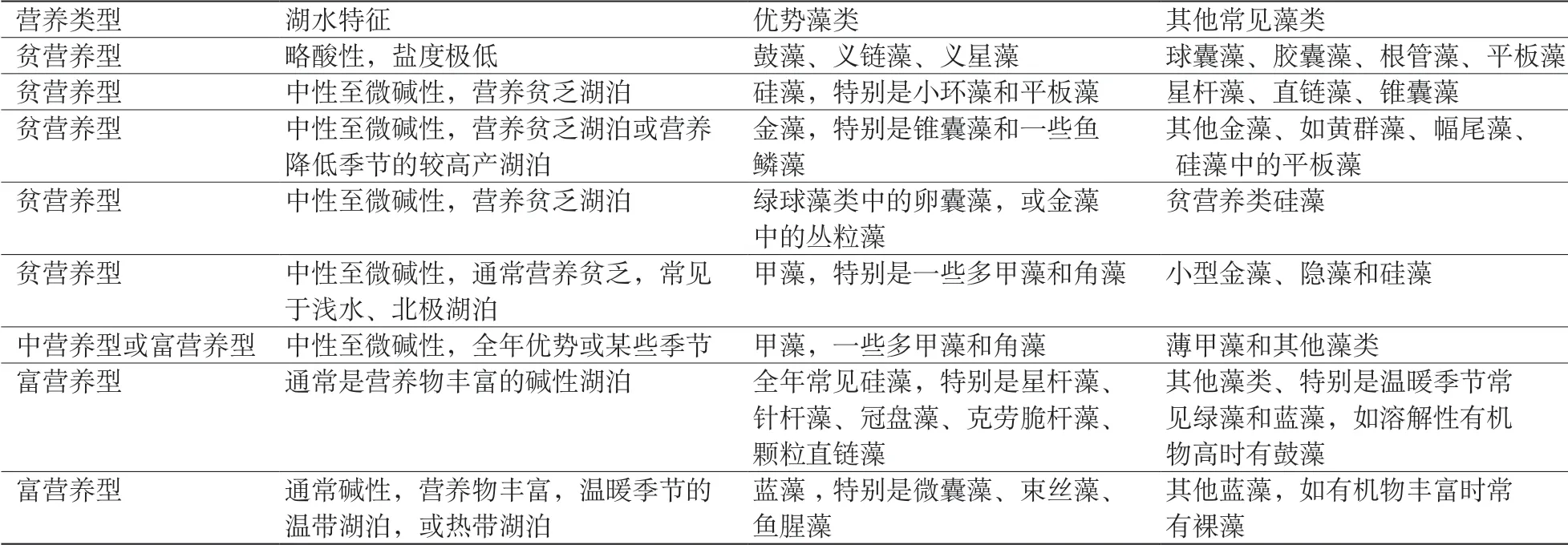
表2 不同营养类型湖泊中常见主要浮游植物群落特征Table 2 Main phytoplankton community characteristics in lakes with different trophic types
从优势种来看,老河口、监测站和修复带3个样点大部分季节的优势种是硅藻类,主要有舟形藻、小环藻、菱形藻,小环藻和菱形藻为可引发水华或赤潮的藻类。修复带在调查期间菱形藻数量较多,并且不同月份先后发现了不少的骨条藻、根管藻、海链藻,这几种藻是常见的赤潮藻,容易造成水质恶劣,对渔业及其它水产动物带来严重危害。监测站和老河口中硅藻占绝大多数,但菱形藻和小环藻有上升的趋势,并且在10月密度较高,虽然调查期间没有发生赤潮,但有潜在的威胁,值得注意。建议以浮游植物多样性指数和水质参数进行水体污染程度评价。除水体中的N、P等营养盐外,浮游藻类的群落结构还受外界条件的影响,而且藻类的生活史很短,在短期之内能急剧繁殖,也能快速消亡,群落结构变化较快。应加大监测频次,准确地反映浮游藻类群落结构的变化,利用浮游藻类评价水质必须结合水质的其它指标。
4 结论
福田红树林生态公园共观察到浮游植物55属69种,主要由绿藻门(20属26种)、硅藻门(15属22种)和蓝藻门(9属9种)组成,同时还有少量的裸藻、隐藻、甲藻、金藻等其他藻类(合计11属12种)。浮游植物密度在5个采样点差异大,而且随季节变化大。大湖的藻密度在各个季度均较低,小湖和修复带藻密度相对较高,7月有明显的夏季高峰,分别为1.73×103个/mL、2.6×103个/mL,监测站和老河口藻密度在秋季达到最高峰,分别为7.06×103个/mL、10.18×103个/mL,主要归因于舟形藻和小环藻等硅藻的大量增殖。5个样点H′、H和D指数均较低,且季节变化大。
