HGG与PCNSL患者1H-MRS、ADC的变化及临床意义
2021-10-08罗一博权建平
罗一博,权建平
宝鸡市人民医院医学影像科,陕西 宝鸡 721000
胶质瘤为发生率最高的原发性中枢神经系统肿瘤,其中高级别胶质瘤(HGG)的恶性程度高,其治疗以手术为主,但晚期HGG 的手术难度和危险性高,短期内易复发[1]。原发性中枢神经系统淋巴瘤(PCNSL)是临床少见的颅内肿瘤,但其侵袭性强,预后较差,单纯手术不能改善PCNSL患者预后及生存率,临床主张放化疗联合皮质激素的综合疗法[2]。HGG 和PCNSL 均呈侵袭性生长,但两者的治疗手段有明显差异,准确诊断有重要作用[3]。目前磁共振检查技术(MRI)在颅内肿瘤定性及定位诊断上有一定价值,但常规MRI对两者的诊断及鉴别诊断价值有限。近年来多种功能磁共振成像技术在临床开展,氢质子磁共振波谱(1H-MRS)可通过化学位移作用和核磁共振成像反映不同组织的代谢状态。表观扩散系数(ADC)可评价组织内水分子的微观扩散运动情况,反映脑组织微结构改变。本研究主要分析HGG 与PCNSL 患者1H-MRS、ADC的变化及临床意义,为两者的诊治提供参考依据。
1 资料与方法
1.1 一般资料收集宝鸡市人民医院2018 年1月至2020 年1 月收治的55 例HGG 及21 例PCNSL 患者的临床资料。入选标准:①伴中枢神经系统肿瘤表现;②HGG 及PCNSL 均经活检和术后病理检查结果证实;③检查前未接受相关治疗;④均接受常规MRI检查、1H-MRS及DWI检查;⑤影像学资料完整。排除标准:①系统性淋巴瘤;②遗传性免疫缺陷;③免疫抑制剂治疗史;④MRI 检查禁忌证。HGG 患者中男性35 例,女性20 例;年龄15~72 岁,平均(58.03±3.91)岁。PCNSL患者中男性14例,女性7例;年龄19~70岁,平均(51.01±6.57)岁。
1.2 检查方法采用3.0T 超导型磁共振仪进行扫描,用头部8通道正交线圈,去除患者佩戴的所有金属器物。头部取正中仰卧位,调整头部位于线圈中央,取听眦线为定位线,每次检查定位一致。自旋回波T1加权成像:回波时间(TE) 9~14 s,重复时间(TR) 400~600 ms;快速自旋回波T2加权成像:TE 90~120 ms,TR 3 600~4 200 ms。扫描层厚5 mm,层间距1 mm,视野17 cm×17 cm~24 cm×24 cm,矩阵256×192 或256×256。扩散加权成像(DWI),选择单次激发自旋回波平面成像序列,进行横断面成像,TE为101.6 ms,TR为6 265 ms,视野为24 cm×24 cm,矩阵为100×100,扫描层厚5 mm,层间距1 mm。于x、y、z方向上加以弥散梯度,弥散敏感系数b 为0 s/mm2、1 000 s/mm2,DWI 成像时间37 s。将DWI原始图像上传至工作站,用软件包进行图像分析和重建,自动重组得到表观弥散系数(ADC)图。于ADC 图像上在肿瘤实质、镜面正常脑组织区域选择5个感兴趣区域,面积均取0.16 cm2,分别统计ADC 值,最终结果取平均值。1H-MRS 选择单体素分辨波,TE为144 ms,TR 为1 000 ms,激励次数为80 次,抑水率大于96%,体素大小参照肿瘤大小进行调整,扫描翻转角为90°,线宽小于11 Hz,扫描时间194 s。利用配套工作站和软件进行波谱图像后处理,查看肿瘤瘤体及肿瘤附近区域[(N-乙酸天门冬氨酸(NAA)、肌酸(Cr)、胆碱(Cho)]等代谢产物的波谱图像。选择肿瘤瘤体及镜面正常脑组织的感兴趣区域,软件自动识别、测量对应感兴趣区的NAA、Cr 及Cho 浓度,并统计NAA/Cr、Cho/Cr及Cho/NAA比值。
1.3 观察指标(1)比较HGG患者镜面正常脑组织与肿瘤瘤体1H-MRS 代谢物比值及ADC 值。(2)比较PCNSL 患者镜面正常脑组织与肿瘤瘤体1H-MRS代谢物比值及ADC值。(3)比较HGG、PCNSL患者肿瘤瘤体1H-MRS 代谢物比值及ADC 值。(4)分析肿瘤瘤体1H-MRS 代谢物比值及ADC 值对HGG、PCNSL的鉴别诊断价值。
1.4 统计学方法应用SPSS20.0 统计软件进行数据分析,计量资料以均数±标准差(±s)表示,两两比较采用t 检验;计数资料比较采用χ2检验;制作受试者工作特征曲线(ROC)分析相关指标对HGG、PCNSL的鉴别价值,以P<0.05为差异有统计学意义。
2 结果
2.1 HGG 患者镜面正常脑组织与肿瘤瘤体1H-MRS 代谢物比值及ADC 值比较HGG 患者肿瘤瘤体Cho/Cr、Cho/NAA 明显高于镜面正常脑组织,NAA/Cr、ADC明显低于镜面正常脑组织,差异均有统计学意义(P<0.05),见表1。
表1 HGG 患者镜面正常脑组织与肿瘤瘤体1H-MRS 代谢物比值及ADC值比较(±s)

表1 HGG 患者镜面正常脑组织与肿瘤瘤体1H-MRS 代谢物比值及ADC值比较(±s)
组别镜面正常脑组织肿瘤瘤体t值P值例数55 55 NAA/Cr 1.56±0.28 0.59±0.08 24.703 0.001 Cho/Cr 1.02±0.11 2.29±0.21 39.730 0.001 Cho/NAA 0.67±0.09 7.47±1.29 38.998 0.001 ADC (×10-3 mm2/s)0.85±0.12 0.80±0.09 2.472 0.015
2.2 PCNSL 患者镜面正常脑组织与肿瘤瘤体1H-MRS 代谢物比值及ADC 值比较PCNSL 患者肿瘤瘤体Cho/Cr、Cho/NAA 明显高于镜面正常脑组织,NAA/Cr、ADC明显低于镜面正常脑组织,差异均有统计学意义(P<0.05),见表2。
表2 PCNSL 患者镜面正常脑组织与肿瘤瘤体1H-MRS 代谢物比值及ADC值比较(±s)

表2 PCNSL 患者镜面正常脑组织与肿瘤瘤体1H-MRS 代谢物比值及ADC值比较(±s)
组别镜面正常脑组织肿瘤瘤体t值P值例数21 21 NAA/Cr 1.58±0.23 1.04±0.13 9.367 0.001 Cho/Cr 1.27±0.12 3.29±0.43 20.735 0.001 Cho/NAA 0.79±0.09 5.31±0.59 34.706 0.001 ADC (×10-3mm2/s)0.84±0.12 0.62±0.08 6.990 0.001
2.3 HGG、PCNSL患者肿瘤瘤体1H-MRS代谢物比值及ADC值比较PCNSL患者肿瘤瘤体NAA/Cr、Cho/Cr明显高于HGG患者,Cho/NAA、ADC明显低于HGG患者,差异均有统计学意义(P<0.05),见表3。
表3 HGG、PCNSL 患者肿瘤瘤体1H-MRS 代谢物比值及ADC 值比较(±s)

表3 HGG、PCNSL 患者肿瘤瘤体1H-MRS 代谢物比值及ADC 值比较(±s)
组别HGG PCNSL t值P值例数55 21 NAA/Cr 0.59±0.08 1.04±0.13 13.510 0.001 Cho/Cr 2.29±0.21 3.29±0.43 9.576 0.001 Cho/NAA 7.47±1.29 5.31±0.59 6.978 0.001 ADC (×10-3mm2/s)0.80±0.09 0.62±0.08 6.850 0.001
2.4 肿瘤瘤体1H-MRS 代谢物比值及ADC 值对HGG、PCNSL 的鉴别诊断价值ROC 曲线显示,NAA/Cr 对HGG、PCNSL 鉴别诊断的曲线下面积为0.706,灵敏度为66.70%,特异度为69.09%;Cho/Cr 的曲线下面积为0.766,灵敏度为61.90%,特异度为92.73%;Cho/NAA 的曲线下面积为0.764,灵敏度为90.50%,特异度为56.36%;ADC 的曲线下面积为0.831,灵敏度为81.00%,特异度为81.82%;4个指标联合的曲线下面积为0.939,灵敏度为95.20%,特异度为89.09%,见表4和图1。
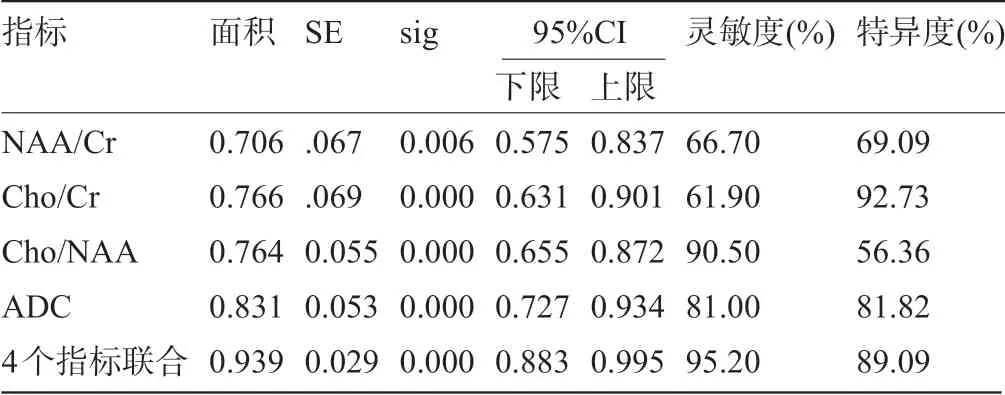
表4 肿瘤瘤体1H-MRS 代谢物比值及ADC 值对HGG、PCNSL 的鉴别诊断价值

图1 1H-MRS代谢物比值及ADC值对HGG、PCNSL鉴别诊断的ROC曲线
3 讨论
颅内肿瘤是严重危害机体生命安全的疾病,其肿瘤类型较多,不同类别、级别的肿瘤治疗方案可能有一定差异,及时准确地判断肿瘤类别、性质对于临床治疗和预后有重要作用。HGG 为颅内肿瘤的主要类型,患者预后较差,手术是其首选疗法。PCNSL 在颅内肿瘤中较少见,但其呈弥漫性浸润生长,存在高度恶性特点,其治疗以手术联合放化疗等综合疗法为主。HGG 与PCNSL 均为浸润性生长肿瘤,肿瘤大小不受到瘤体限制,常规MRI 仅初步判断病变大小、形态及位置,对HGG 与PCNSL 的诊断及鉴别诊断作用有限[4]。有研究发现,MRS 能够早于常规MRI 检出颅内肿瘤细胞浸润范围内代谢物的变化情况,反映病理及正常组织代谢情况,判断组织性质[5]。1H 的含量最丰富,磁比率最大,形成的MRS 信号也最强,因此1H-MRS在临床最常用[6]。
Cr为能量储存及利用的重要物质,可反映脑细胞能量代谢情况,肿瘤病变时其浓度可出现程度不一的降低,Cr降低程度和肿瘤细胞快速增殖引起的缺血和能量消耗有关[7]。Cho能够参与细胞膜的合成及分解,细胞密度、增生细胞数量等变化均可影响Cho水平,是细胞密度增加或者膜转归的标志。NAA 为神经元标志物,可反映神经元发育和功能情况,神经元功能损伤、破坏时其浓度降低。临床研究报道,颅内肿瘤1H-MRS 波谱以Cr 下降,NAA 缺失或降低,Cho 上升,代谢物比值NAA/Cr降低,Cho/Cr及Cho/NAA上升为主要表现[8]。本研究结果显示,HGG及PCNSL患者经1H-MRS检查显示肿瘤组织NAA/Cr低于正常脑组织,Cho/Cr及Cho/NAA则明显高于正常脑组织,表明两者的1H-MRS 波谱表现相似。 但进一步分析发现,PCNSL 患者NAA/Cr、Cho/Cr 高于HGG 患者,而Cho/NAA则低于HGG患者,考虑与PCNSL患者细胞能量代谢需求明显增加,加上PCNSL 患者瘤体缺血,进一步降低Cr,HGG的瘤体血供较丰富,因此PCNSL患者Cr较HGG下降更明显,与相关文献报道相符[9]。另外PCNSL 肿瘤细胞排列较密集,淋巴细胞增长较快,细胞膜磷脂可快速转换,加上瘤体中囊变及坏死较少,Cho 可快速上升。HGG 内部多伴坏死,Cho 的上升幅度有限,因此HGG 患者Cho/Cr 低于PCNSL 患者。HGG 对神经元的破坏较严重,NAA 峰缺失或下降。PCNSL1H-MRS 波谱中NAA 也呈缺失或下降改变。尽管两者NAA峰呈类似改变,但PCNSL患者Cr下降更明显,导致PCNSL 患者NAA/Cr 较HGG 大。同时PCNSL 患者Cho/NAA 低于HGG 患者的原因考虑为HGG 多伴一定程度的囊变及坏死,NAA 降低或者缺失明显,引起Cho/NAA 显著上升[10]。有研究发现,多体素MRS 成像中不均匀场强可导致测量误差,对HGG、PCNSL的鉴别诊断方面的作用有限[11]。
另有研究报道[12],水扩散速率对肿瘤疾病的诊断有较高的参考价值。ADC 值能够反映水分子弥散能力,其值越小,提示水扩散受限程度越明显。林月等[13]研究发现,颅内肿瘤病灶中肿瘤细胞的增殖较活跃,肿瘤浸润生长、核浆比例增加可致细胞外空间分数降低,使组织中水扩散受限,导致肿瘤病灶中ADC 值下降。本研究中,HGG 及PCNSL 患者肿瘤组织ADC 值均低于正常脑实质,证实肿瘤组织中水扩散受限的特性。 且HGG 患者肿瘤组织ADC 值又明显高于PCNSL 患者,考虑与HGG 的高度血管增生特性引起肿瘤发生囊壁、坏死,降低水扩散受限程度,导致ADC值高于PCNSL。另外PCNSL 的细胞紧密排列,核浆比例上升,减少细胞外基质含量,使水分子扩散受到限制,降低ADC值。
但1H-MRS 及ADC 的成像原理不同,两者在颅内肿瘤诊断和鉴别中各有优势和不足。1H-MRS的数据采集和信号量化分析难度大,容易受到技术方面的影响。ADC的准确性可受到肿瘤病灶出血、钙化和纤维化的影响。本研究进行ROC 分析显示,1H-MRS 各代谢物参数及ADC 值对HGG、PCNSL 鉴别诊断的ROC曲线面积均大于0.5,提示1H-MRS及ADC对两者均有鉴别诊断作用,1H-MRS及ADC联合可增加ROC曲线面积,更有利于HGG 及PCNSL 的鉴别诊断。相关研究报道,1H-MRS、ADC 在肿瘤放化疗效果、随访中有重要作用[14-15]。本研究观察时间较短,有关1H-MRS、ADC 在HGG、PCNSL 治疗及预后中的效果有待进一步观察。
综上所述,1H-MRS 的NAA/Cr、Cho/Cr、Cho/NAA及ADC 值在HGG 及PCNSL 鉴别诊断中均有重要价值,能够指导临床治疗。
