护肝解毒方调控NAFLD大鼠机制的网络药理学及实验研究
2021-10-08庄敏之周菲单良郭兆玮冯华郑昕
庄敏之,周菲,单良,郭兆玮,冯华,郑昕
同济大学附属上海市第四人民医院中医科,上海 200081
我国近几年的非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)人口增长迅速,全国范围内的NAFLD 患病率达到了29.2%,并且在亚洲,中国的NAFLD 患病率、发病率和年死亡率最高[1]。目前NAFLD的有效治疗药物很少,护肝解毒方是根据“痰瘀伏毒损伤肝络”理论研制的特色中药制剂,有修复肝损伤、保护肝细胞等多种作用[2],但护肝解毒方治疗NAFLD的关键成分、作用靶点、效应通路及分子机制尚不明确。本研究应用各类中草药数据库、疾病靶点数据库、R语言及相关生物信息软件和数据库,预测护肝解毒方治疗NAFLD的关键成分、作用靶点、相关作用机制,继而通过动物实验进行验证,为寻找中药复方治疗疾病的主要作用成分、关键靶点和相关机制提供新的思路和方法。
1 材料与方法
1.1 护肝解毒方治疗NAFLD网络药理学预测
1.1.1 护肝解毒方主要作用成分筛选护肝解毒方主要由垂盆草、龙胆草、人参叶组成,在中药系统药理学数据库和分析平台(TCMSP,https://lsp.nwu.edu.cn/)检索了护肝解毒方的化合物成分,根据药物动力学对检索到成分进行筛选,采用的药物筛选标准为口服生物利用度(OB)≥30%;药物相似性(DL)≥0.18[3]。
1.1.2 护肝解毒方主要作用靶点及NAFLD相关靶点收集将上述查询得到的护肝解毒方主要作用成分通过PharmMapper 数据库(http://lilab.ecust.edu.cn/pharmmapper/index.php)进行潜在药物靶标识别,设定最大生成构象为300,并选择Fit Score>3.0的靶点建立护肝解毒方主要成分潜在作用靶点数据集。在国内外主要的疾病靶点数据库,如Gene (https://www.ncbi.nlm.nih.gov/gene)、GeneCards (http://www.genecards.org)、Polysearch (http://polysearch.cs.ualberta.ca) 以 及DigSee (http://210.107.182.61) 等数据库中,输入NAFLD、NASH等关键词,收集NAFLD的主要作用靶点。将PharmMapper 药效团寻靶得到的护肝解毒方主要作用靶点与NAFLD 相关靶点进行匹配,找到护肝解毒方治疗NAFLD的主要作用靶点。
1.1.3 基因功能富集分析基因功能分析主要有通路分析和GO富集分析。通过护肝解毒方主要作用靶点通路富集分析,可以定位护肝解毒方作用的关键通路,有助于通过实验找到显著差异变化的生物学调控通路。护肝解毒方主要作用靶点的GO富集分析可以指示基因集合具有的功能偏好,进而据此判断相应的生物学意义。 将筛选出的护肝解毒方调控NAFLD 主要靶点通过R3.61 及相关R 包进行计算分析,得到相关的GO富集分析和通路富集分析。
1.2 护肝解毒方治疗NAFLD动物实验研究
1.2.1 实验动物健康清洁级Wistar 雄性大鼠30只,5~6周龄,体质量(140±20) g,由上海斯莱克实验动物有限公司提供,实验动物许可证号:SCXK (沪)2016-0002,本实验依照国家实验动物相关法律法规实施,并已获得医院实验动物伦理委员会批准。实验大鼠先予适应性饲养一周,喂养颗粒饲料,自由饮水。
1.2.2 主要实验药物护肝解毒方垂盆草(Sedi Herba) 30 g、龙胆草(Gentianae Radix Et Rhozima) 10 g、人参叶(Ginseng Folium) 15 g,以上药物由上海雷允上中药饮片厂提供,统一水煎后大鼠中药汤剂灌胃生药量9.1 g/kg。
1.2.3 主要实验仪器正置显微镜(OLYMPUS公司,型号:CX41),石蜡切片机(徕克公司,型号:SQ2125),Real-time 检 测 仪(ABI 公 司,型 号:ABI-7300),酶标仪(芬兰雷勃公司,型号:MK3),电泳仪(BIO-RAD公司,型号:Mini Protean 3 Cell)。
1.2.4 主要试剂Trizol 试剂(Invitrogen 公司,货号:1596-026),SYBR Green PCR试剂盒(赛默飞公司,货号:K0223),逆转录试剂盒(Fermentas 公司,货号:K1622),SREBP1 抗 体(Santa 公 司,货 号:Sc-366),SIRT1 抗体(Abcam 公司,货号:Ab104833),谷丙转氨酶(ALT/GPT)测试盒(南京建成生物工程研究所,货号:C009-1),谷草转氨酶(AST/GOT)测试盒(南京建成生物工程研究所,货号:C010-1),γ-谷氨酰转肽酶(γ-GT)测试盒(南京建成生物工程研究所,货号:C017),ROS 测试盒(南京建成生物工程研究所,货号:E004,化学荧光法)。
1.2.5 实验分组、造模及给药将Wistar 雄性大鼠随机分为三组,分别为正常组、模型组、护肝解毒方组,每组10 只。模型组和护肝解毒方组采用高脂饲料造模,给予88%普通饲料+10%猪油+2%胆固醇14 周,护肝解毒方组每日予9.1 g/kg 生药量的煎剂进行灌胃14 周,正常组予普通饲料喂养,并灌服和中药汤剂等体积的生理盐水。
1.3 检测指标
1.3.1 血清生化指标检测末次给药后各组大鼠禁食24 h,称重后用戊巴比妥钠麻醉,经腹主动脉采血,分离血清,测定血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、γ-谷氨酰转肽酶(γ-GT)、总胆固醇(TC)、甘油三酯(TG)、空腹血糖(FBG)等血清生化指标。
1.3.2 大鼠肝脏组织ROS (活性氧)测定采血完成后,迅速完成摘取大鼠肝脏,准确称取组织重量,按体质量(g)∶体积(mL)=1∶20的比例加入匀浆介质,冰水浴条件下机械匀浆,1 000×g 离心10 min,取上清液待测;取部分上清用于蛋白的测定。
1.3.3 大鼠肝组织病理检测取肝脏右叶10 mm×10 mm×2 mm 组织两块,福尔马林固定,石蜡包埋、切片,HE染色,显微镜下观察大鼠肝组织病理情况。
1.3.4 Real-Time PCR 检测大鼠肝脏组织mRNA表达采用Real-Time PCR法,以GAPDH作为参照基因,检测大鼠肝脏中相关蛋白表达情况(表1),使用Trizol 提取大鼠肝脏组织总RNA,逆转录为cDNA,将制备好的cDNA 进行PCR 扩增,扩增反应条件为:95℃预变性10 min,95℃变性15 s,60℃退火45 s,循环40 次。数据采用仪器自带软件分析ABI Prism 7300 SDS Software进行分析。

表1 Real-time PCR扩增引物表
1.4 统计学方法采用SPSS23.0进行统计学分析,计量资料以均数±标准差(±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 护肝解毒方主要作用成分的收集和靶点预测在中药系统药理学数据库分析平台(https://lsp.nwu.edu.cn/)检索护肝解毒方的主要成分,共获得289 个成分,按照药物动力学(ADME) 性质参数筛选活性分子,设定口服利用度(OB)≥30,药物相似性(DL)≥0.18,结合以上原则及本课题组既往研究,共筛选到9个作用成分,见表2。

表2 护肝解毒方主要作用成分表
2.2 护肝解毒方主要成分-NAFLD 相关靶点预测和网络构建通过Pharmmapper 数据库共获得了406 个护肝解毒方主要成分作用靶点,在Gene、GeneCards、Polysearch、DigSee等数据库中查询条目中输入NHFLD、NASH等关键词,去除重复选项,共得到95个NAFLD相关靶点。将护肝解毒方主要成分作用靶点和NAFLD相关靶点进行整合,通过线文恩图网站(http://bioinfogp.cnb.csic.es/tools.html)进行绘制(图1),共得到12 个护肝解毒方主要作用成分和非酒精性脂肪肝病交集靶点(表3)。在STRING 数据库(https://string-db.org/)进行蛋白互作关系查询,得到了护肝解毒方-NAFLD相关作用靶点蛋白互作关系图(图2),从图中可以看出,护肝解毒方主要成分-NAFLD 相关作用靶点构成了紧密的蛋白相互作用关系,其中SIRT1、SREBF1、UCP2、PPARA、INSR 等与其他靶点蛋白关系较紧密,是其中的核心蛋白。

图1 护肝解毒方主要作成分靶点-NAFLD相关靶点文恩图

图2 护肝解毒方NAFLD相关靶点PPI网络图

表3 护肝解毒方主要作用成分-NAFLD作用靶点
2.3 通路富集分析将护肝解毒方主要成分作用靶点Symbol 用R 3.61 软件转换为entrezID,运用clusterProfiler 包进行KEGG 通路信息注释,选取具有统计学意义(P<0.05)的通路进行富集分析(图3),在KEGG 数据库中输入上述靶点,进行通路可视化作图。从图中可以看出护肝解毒方主要作用靶点与AMPK、NAFLD、胰岛素抵抗、胰高血糖素、胰岛素通路、细胞衰老等NAFLD相关性信号通路密切相关。

图3 护肝解毒方主要效应靶点通路富集图
2.4 GO 富集分析在DAVID 数据库(https://david.ncifcrf.gov/)进行GO 富集分析,设定阈值P<0.05,筛选前10 位,用R3.61 软件进行作图(图4)。通过GO 富集分析结果可知,护肝解毒方主要作用靶点涉及的生物过程、细胞组分、分子功能与NAFLD的病理和生物过程密切相关。

图4 护肝解毒方主要作用靶点GO富集图
2.5 护肝解毒方改善NAFLD动物实验验证
2.5.1 护肝解毒方对NAFLD 大鼠ALT、AST、γ-GT、TC、TG、FBG 等指标影响实验结果表明,喂食高脂饮食14 周后模型组大鼠的ALT、AST、γ-GT以及TC、TG、FBG 水平明显高于正常组;护肝解毒方组大鼠的ALT、AST、γ-GT 以及TC、TG、FBG 水平显著低于模型组,差异均有显著统计学意义(P<0.01),见图5。
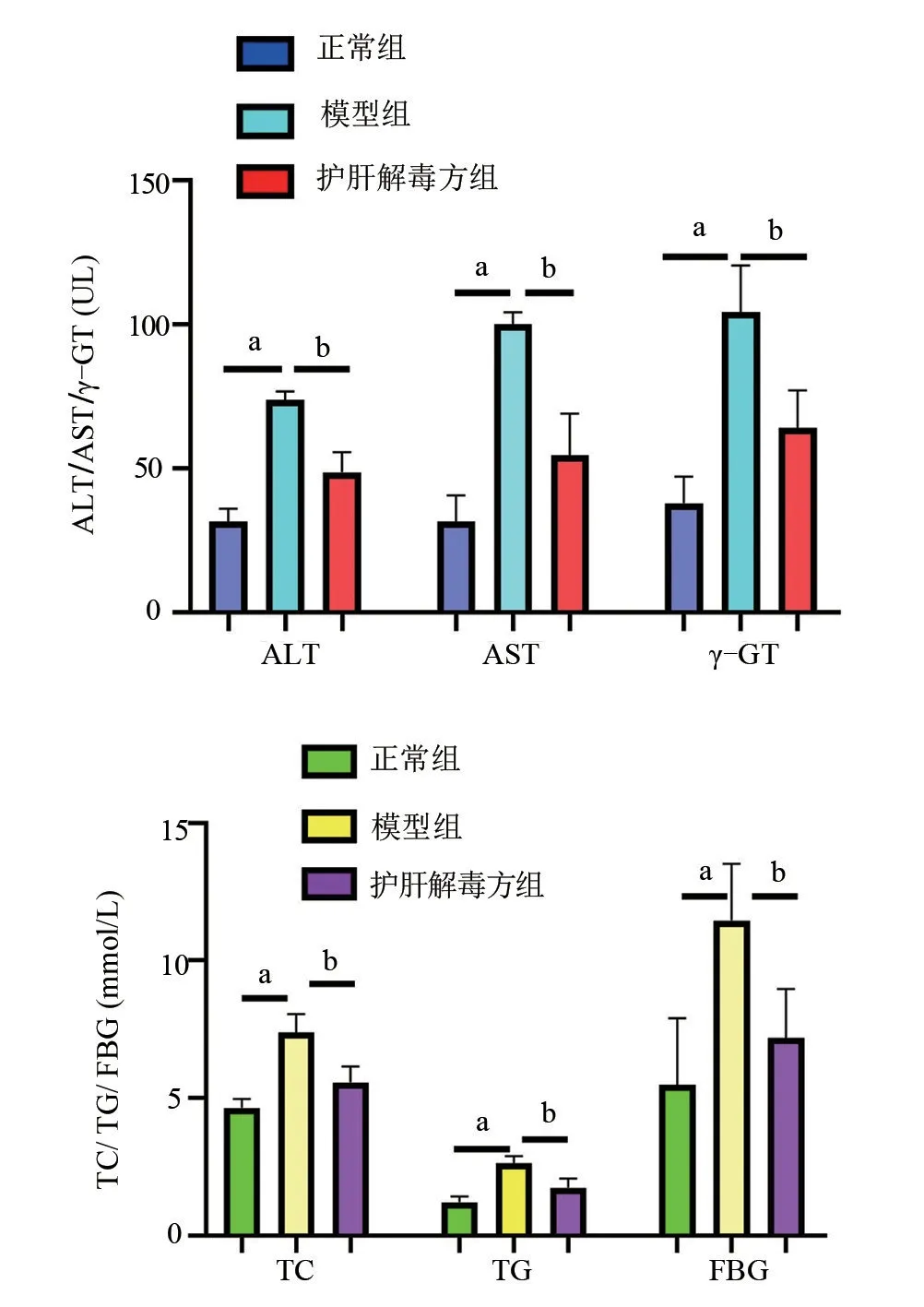
图5 三组实验大鼠血清ALT、AST、γ-GT、TC、TG、FBG指标变化图
2.5.2 护肝解毒方对NAFLD大鼠肝脏ROS指标的影响大鼠肝脏组织的ROS测定结果表明,模型组大鼠ROS值显著高于正常组,护肝解毒方组大鼠ROS值显著低于模型组,差异有显著统计学意义(P<0.01),见图6。

图6 三组实验大鼠肝脏组织ROS含量测定
2.5.3 各实验组大鼠肝脏组织病理改变实验大鼠肝脏组织病理改变见图7,正常组大鼠肝细胞排列正常,结构完整,未见明显肝细胞变性,模型大鼠出现明显肝细胞脂肪变性,伴有大量脂滴空泡及局灶性坏死。护肝解毒方组肝细胞变性、脂滴空泡明显减少,形态上与正常组无明显差别。
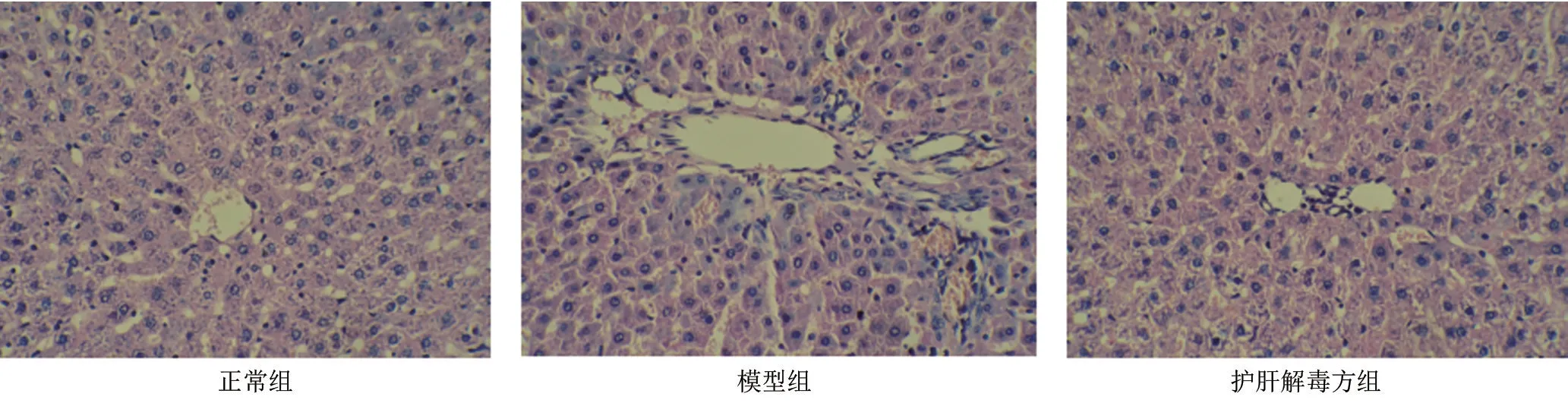
图7 三组实验大鼠肝脏组织HE染色图(×200)
2.5.4 护肝解毒方对NAFLD 大鼠肝脏Sirt1 mRNA、Srebp1 mRNA 表达水平的影响Real-Time PCR实验显示(图8),模型组大鼠肝脏Sirt1 mRNA表达水平显著低于正常组,Srebp1 mRNA表达水平显著高于正常组。而护肝解毒方组大鼠肝脏Sirt1 mRNA表达水平显著高于模型组,Srebp1 mRNA表达水平表达水平显著低于模型组,差异均有显著统计学意义(P<0.01)。

图8 三组实验大鼠肝脏组织Sirt1mRNA、Srebp1mRNA表达水平变化
3 讨论
非酒精性脂肪肝(NAFLD)目前已经是世界上最常见的慢性肝病,NAFLD 的流行正迅速成为一个严重的公共卫生问题,由此造成的终末期肝病(如肝硬化和肝癌)的患病率和发病率继续飙升[4]。NAFLD 是一种从单纯性脂肪变性到脂肪性肝炎、纤维化和肝硬化的肝病,非酒精性脂肪性肝炎(NASH)患者发生纤维化、肝硬化或肝细胞癌的风险增加[1]。
护肝解毒方是治疗肝损伤的中药复方,临床研究表明,其具有能显著改善肝损伤患者临床症状及肝酶学指标的作用[2]。但由于护肝解毒方成分较复杂,按照以往传统的研究方法,要发现其中主要的作用成分和效应靶点,需要进行大量的动物及临床实验,花费大量财力和时间。近年来整合运用中草药成分、疾病靶点、基因蛋白等数据库,以及蛋白-分子交互作用软件等生物信息学技术,已成为迅速发现中草药治疗疾病的主要作用成分、效应通路及靶点、分子机制的新思路。
本研究检索了TCMSP等中草药成分数据库,按照ADME参数中的OB、DL等参数,筛选出9个护肝解毒方主要作用成分。通过PharmMapper 数据库反向找靶,汇总交集Gene、Gencards,Polysearch、DigSee 等疾病靶点数据库,获得12个护肝解毒方-NAFLD主要作用靶点,通过蛋白相互作用分析,发现SIRT1、SREBF1、UCP2、PPARA、INSR 等与其他靶点蛋白关系较紧密,是主要的核心作用蛋白。通路富集及GO富集分析表明,护肝解毒方主要作用靶点效应通路及基因功能与脂质的储存、转运、代谢,胰岛素代谢、胰高血糖素等NAFLD相关的信号通路及基因功能密切相关。
为了验证生物信息技术对护肝解毒方调控NAFLD大鼠机制的预测,进一步进行了NAFLD大鼠的动物实验。动物实验结果显示,模型组大鼠的ALT、AST、γ-GT、TC、TG、FBG、ROS指标均较正常组升高,差异有显著统计学意义(P<0.01);护肝解毒方组大鼠ALT、AST、γ-GT、TC、TG、FBG、ROS指标与模型组相比明显下降,差异有显著统计学意义(P<0.01)。NAFLD 大鼠肝组织出现明显肝细胞脂肪变性,伴有大量脂滴空泡及局灶性坏死,提示NAFLD 大鼠造模成功。大鼠肝脏组织切片HE 染色显示,正常组大鼠肝细胞排列正常,结构完整,未见明显肝细胞变性,模型组大鼠出现明显肝细胞脂肪变性,伴有大量脂滴空泡及局灶性坏死。护肝解毒方组大鼠肝细胞变性、脂滴空泡明显减少,形态上与正常组无明显差别。Real-Time PCR 实验验证了护肝解毒方调控NAFLD的主要靶点的预测,实验结果显示,模型组大鼠肝脏Sirt1 mRNA表达水平显著低于正常组,Srebp1 mRNA表达水平显著高于正常组,差异均有显著统计学意义(P<0.01)。与模型组相比,护肝解毒方能够显著上调NAFLD 大鼠Sirt1 mRNA 表达,同时也能够显著下调Srebp1 mRNA表达,差异均有显著统计学意义(P<0.01)。
NAFLD 的产生是个体、环境和遗传等多种因素共同作用的结果,人体体内诸多基因参与了其发生、发展、变化的过程。研究表明,NAFLD的形成是由于肝细胞内甘油三酯(TG)以脂滴形式过度沉积,TG/FA摄取和清除之间的肝脏脂质平衡失调造成肝脏中异常的细胞质脂质积聚[5]。人体内众多基因和蛋白参与了NAFLD的形成和发展,其中SIRT1和SREBP1起了重要作用。SIRT1 属于沉默信息调节因子2 (Sir2)家族,SIRT1 通过去乙酰化一些转录调节因子来抑制脂肪性肝病的进展,从而在调节肝脏脂质代谢、控制肝脏氧化应激和介导肝脏炎症等方面发挥有益的作用。越来越多的证据表明SIRT1 是关键的代谢/能量传感器,一些实验也提供了直接的证据,即肝脏Sirt1缺乏小鼠即使没有高脂饮食也会诱发脂肪肝疾病[6]。SIRT1的作用与SREBP1密切相关,SIRT1激活后抑制SREBP1c 生成,阻断其下游的成脂基因,通过增加脂肪酸β-氧化,从而重新平衡肝脏的脂质代谢,显示出有益的作用[7-8]。而SREBP1的过度激活,可以增加脂肪酸的合成,从而加重肝脂肪变性、细胞应激和炎症[9]。
肝脏氧化应激是一个公认的影响NAFLD的发病机制的主要因素,氧化应激可导致脂质过氧化、线粒体功能障碍和肝细胞凋亡。肝脏中积累的大量脂滴也会引发线粒体氧化应激,通过影响多种机制来诱导氧化剂的过度产生,其特征是大量活性氧(ROS)的产生,与抗氧化系统的清除能力之间的不平衡,不同类型肝细胞能量代谢的副产物在细胞内持续产生,导致肝脏脂质过多[10]。在高浓度下,ROS 对细胞大分子(DNA、脂质、蛋白质等)造成氧化修饰,导致受损大分子积聚,诱发肝损伤[11]。氧化应激的程度通常是基于活性氧生成和抗氧化能力之间的不平衡水平造成的,而SIRT1通过对FOXOs和PGC-1α的去乙酰化来增加它们对抗氧化酶基因的转录活性,对氧化应激有调节作用[12]。
由于SIRT1 和SREBP1 在NAFLD 和其他代谢紊乱所涉及的各种代谢途径中起着重要的作用,许多研究已经测试了SIRT1的药理学激活可以作为在各个阶段预防脂肪肝疾病发展的有效治疗方法,如白藜芦醇和一些其他的天然多酚被证实通过激活SIRT1在控制脂质代谢、氧化应激和炎症以改善脂肪肝疾病方面具有广泛的有益作用[13-15]。
本研究运用网络药理学对护肝解毒方主要作用成分以及SIRT1、SREBF1等NAFLD关键靶点以及相关信号通路、基因功能进行了预测。通过实验研究验证了护肝解毒方能显著改善NAFLD 大鼠的肝功能、血脂、血糖、肝脏组织ROS 等多个指标,同时上调NAFLD 大鼠Sirt1 mRNA 表达,下调Srebp1 mRNA 表达,证实护肝解毒方能有效调控NAFLD大鼠肝脂代谢相关基因表达、改善糖脂代谢和肝脏氧化应激,减轻肝细胞脂肪变性。说明通过网络药理学预测以及动物实验验证的方法,可迅速有效地寻找中药复方治疗疾病的主要作用成分、主要作用靶点及相关作用机制。
