慢性萎缩性胃炎伴Hp感染患者血清GH、PGⅠ/PGⅡ、TGF-βRⅡ、IL-6和TNF-α水平的变化及临床意义
2021-10-08罗长琴肖翔申光富
罗长琴,肖翔,申光富
安康市中心医院消化病科内科1、消化病科内镜室2、呼吸内科3,陕西 安康 725000
慢性萎缩性胃炎(chronic atrophic gastritis)是消化内科较为常见的一种疾病,主要表现为胃黏膜上皮、腺体萎缩、黏膜基厚、胃黏膜变薄等,随着时间的延长,极易进展为胃癌,影响患者预后[1]。幽门螺杆菌(helicobacter pylori,Hp)感染是该病常见的致病因素之一,相关数据显示,约有50%以上的慢性萎缩性胃炎患者胃黏膜中可培养出Hp[2]。由于慢性萎缩性胃炎的早期临床特点缺乏特异性,诊断率较低,极易出现漏诊和延误诊断,影响治疗时机,寻找合适的血清学指标在早期评估病情、指导治疗中占据着重要地位。生长激素(growth hormone,GH)对胃动力的分泌具有促进作用,与胃黏膜萎缩程度具有密切关系;而胃蛋白酶原Ⅰ(PGⅠ)/PGⅡ是临床上反映胃黏膜细胞功能的重要指标[3-4]。近年来也有研究认为,机体遭受到Hp感染后,可导致淋巴细胞、中性粒细胞发生聚集,并刺激大量促炎因子释放,进一步损伤胃黏膜[5]。本研究旨在探讨慢性萎缩性胃炎伴Hp 感染血清GH、PGⅠ/PGⅡ、转化生长因子β受体Ⅱ(TGF-βRⅡ)、白细胞介素-6 (IL-6)和肿瘤坏死因子-α (TNF-α)水平的变化及临床意义,现报道如下:
1 资料与方法
1.1 一般资料选择2018 年2 月至2020 年2 月安康市中心医院收治的72 例慢性萎缩性胃炎患者作为观察组。纳入标准:①符合慢性萎缩性胃炎诊断标准[6],并通过胃镜下病理组织学检查确诊;②近期1 个月为未接受过相关抗Hp 治疗;③年龄18~70 岁,精神正常,可配合研究。排除标准:①合并其余消化系统疾病或者胃部肿瘤等;②近1周内服用过黏膜保护剂、质子泵抑制剂、抗生素等药物;③合并凝血功能障碍;④合并其余重要脏器功能障碍、恶性肿瘤等;⑤妊娠期哺乳期。并选择同期于本院接受体检的70 例健康者为对照组,该组受试者血尿常规检查、胃镜均正常,无Hp感染及消化系统疾病。所有受检者均签署研究知情同意书,且本研究已经本院伦理委员会批准。两组受检者的一般资料情况比较差异均无统计学意义(P>0.05),具有可比性,见表1。
表1 两组受检者的一般资料比较[±s,例(%)]
组别观察组对照组χ2/t值P值例数72 70男40 (55.56)35 (50.00)女32 (44.44)35 (50.00)0.440 0.507年龄(岁)51.02±8.40 50.62±9.11 0.272 0.786 BMI (kg/m2)22.94±3.02 22.79±3.16 0.289 0.773小学及以下21 (29.17)22 (31.43)中学41 (36.64)36 (51.43)中学以上10 (13.89)12 (17.14)0.287 0.592性别 文化程度
1.2 观察指标与检测方法(1)比较两组受检者的血清GH、PGⅠ、PGⅡ、PGⅠ/PGⅡ、TGF-βRⅡ、IL-6、TNF-α水平。采集所有受检者纳入研究后次日清晨空腹静脉血5 mL,进行离心处理,转速3 500 r/min,时间10 min,提取上层血清液储存于冷冻箱中。选择美国BIO RAD 公司生产的全自动免疫分析仪iMARK-Mode 型对血清GH 水平进行检测,采用微孔双抗体夹心法对PGⅠ、PGⅡ水平的表达进行检测,并计算PGⅠ/PGⅡ。血清TGF-βRⅡ、IL-6、TNF-α的检测均采用酶联免疫吸附法(ELISA),试剂盒均由上海优宁维生物科技有限公司予以提供。Hp检测采用14C尿素呼气试验进行,Hp 感染数值结果≥100 dpm/mmoL则判定为阳性,结果<100 dpm/mmoL 则判定为阴性。(2)比较观察组Hp 感染阳性和阴性患者、对照组血清GH、PG Ⅰ、PG Ⅱ、PG Ⅰ/PG Ⅱ、TGF-β R Ⅱ、IL-6、TNF-α水平。(3)分析血清GH、PGⅠ/PGⅡ与TGF-βRⅡ、IL-6、TNF-α的相关性。
1.3 统计学方法应用SPSS18.0 统计软件进行数据分析,计量资料以均数±标准差(±s)表示,三组比较采用方差分析,两两比较采用t检验,计数资料以率(%)表示,比较采用χ2检验,采用Pearson相关性分析法进行相关性分析,以P<0.05为差异有统计学意义。
2 结果
2.1 两组受检者的血清GH、PGⅠ、PGⅡ、PGⅠ/PGⅡ水平比较两组受检者的血清PGII 比较,差异无统计学意义(P>0.05);观察组患者的血清GH、PGⅠ、PGⅠ/PGⅡ、TGF-βRⅡ水平明显低于对照组,血清IL-6、TNF-α水平明显高于对照组,差异均有统计学意义(P<0.05),见表2。
表2 两组受检者的血清GH、PGⅠ、PGⅡ、PGⅠ/PGⅡ、TGF-βRⅡ、IL-6、TNF-α水平比较(±s)
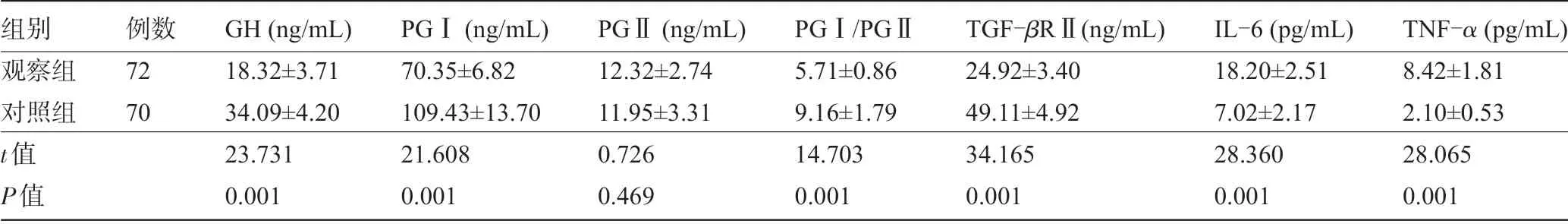
表2 两组受检者的血清GH、PGⅠ、PGⅡ、PGⅠ/PGⅡ、TGF-βRⅡ、IL-6、TNF-α水平比较(±s)
组别观察组对照组t值P值例数72 70 GH (ng/mL)18.32±3.71 34.09±4.20 23.731 0.001 PGⅠ(ng/mL)70.35±6.82 109.43±13.70 21.608 0.001 PGⅡ(ng/mL)12.32±2.74 11.95±3.31 0.726 0.469 PGⅠ/PGⅡ5.71±0.86 9.16±1.79 14.703 0.001 TGF-βRⅡ(ng/mL)24.92±3.40 49.11±4.92 34.165 0.001 IL-6 (pg/mL)18.20±2.51 7.02±2.17 28.360 0.001 TNF-α (pg/mL)8.42±1.81 2.10±0.53 28.065 0.001
2.2 Hp 感染阳性和阴性患者与对照组的血清GH、PGⅠ、PGⅡ、PGⅠ/PGⅡ、TGF-βRⅡ、IL-6、TNF-α水平比较根据14C尿素呼气试验检查显示,观察组有42例合并Hp感染,感染率为58.33%;三组受检者的血清PGⅡ比较差异无统计学意义(P>0.05);Hp感染阳性和阴性患者的血清GH、PGⅠ、PGⅠ/PGⅡ、TGF-βRⅡ明显低于对照组,血清IL-6、TNF-α明显高于对照组,差异均有统计学意义(P<0.05);且Hp感染阳性患者的血清GH、PGⅠ、PGⅡ、PGⅠ/PGⅡ、TGF-βRⅡ明显低于Hp 感染阴性者,血清IL-6、TNF-α明显高于Hp 感染阴性者,差异均有统计学意义(P<0.05),见表3。
表3 Hp感染阳性和阴性患者与对照组的血清GH、PGⅠ、PGⅡ、PGⅠ/PGⅡ、TGF-βRⅡ、IL-6、TNF-α水平比较(±s)

表3 Hp感染阳性和阴性患者与对照组的血清GH、PGⅠ、PGⅡ、PGⅠ/PGⅡ、TGF-βRⅡ、IL-6、TNF-α水平比较(±s)
注:与对照组比较,aP<0.05;与Hp感染阴性比较,bP<0.05。
组别Hp感染阳性Hp感染阴性对照组F值P值GH (ng/mL)14.27±3.60ab 23.18±3.21a 34.09±4.20 359.765 0.001 PGⅠ(ng/mL)59.34±6.50ab 85.02±7.49a 109.43±13.70 283.844 0.001 PGⅡ(ng/mL)12.28±2.35 12.69±2.17 11.95±3.31 0.736 0.481 PGⅠ/PGⅡ4.83±1.03ab 6.70±1.26a 9.16±1.79 113.821 0.001 TGF-βRⅡ(ng/mL)19.48±2.75ab 30.08±3.40a 49.11±4.92 736.245 0.001 IL-6 (pg/mL)25.62±3.74ab 10.74±2.26a 7.02±2.17 619.750 0.001 TNF-α (pg/mL)15.72±3.08ab 5.41±1.33a 2.10±0.53 747.881 0.001例数42 30 70
2.3 血清GH、PGⅠ/PGⅡ与TGF-βRⅡ、IL-6、TNF-α的相关性经Pearson相关性分析结果显示,血清GH、PGⅠ/PGⅡ与TGF-βRⅡ均呈正相关(P<0.05),与IL-6、TNF-α均呈负相关(P<0.05),见表4。
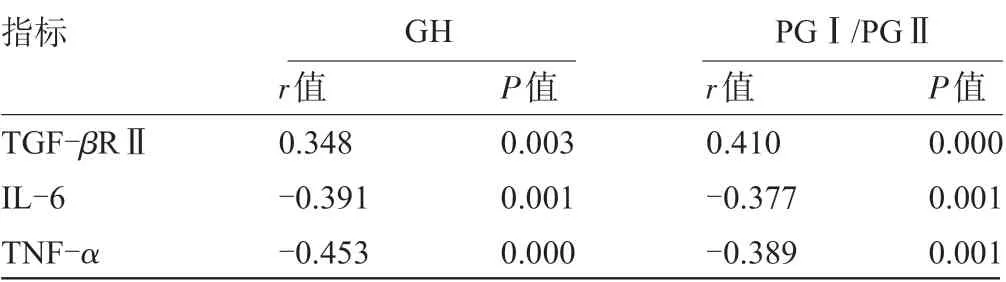
表4 血清GH、PGⅠ/PGⅡ与TGF-βRⅡ、IL-6、TNF-α的相关性
3 讨论
Hp是一种在胃中可存活的病原微生物,可对胃黏膜产生破坏作用,从而诱发慢性胃炎、胃溃疡等疾病的发生,目前的研究也已证实,Hp 感染是导致慢性萎缩性胃炎发病的重要危险因素之一[7-8]。
GH 的分泌主要来自于胃黏膜上皮细胞,其水平的升高的可刺激食欲增加、体质量上升,是维持胃动力学的重要指标。在本研究中显示,在慢性萎缩性胃炎及伴Hp 阳性感染的患者中学血清GH 的表达呈降低表达,主要由于患者胃肠动力异常所致,YAMADA 等[9]研究也显示,随着萎缩程度的加重,Hp感染的加剧,血清GH的分泌可呈逐步降低趋势。
PG是一种具有消化功能作用的蛋白酶,主要组成包括PGⅠ和PGⅡ,其中PGⅠ主要分泌来自于胃底、胃体的主细胞及黏液细胞,PGⅡ主要分泌来自于十二指肠的腺体,当机体上皮细胞出现病变后,则会导致PGⅠ/PGⅡ的分泌异常。已有较多研究指出,通过检测PGⅠ/PGⅡ的比值,有助于评估胃部疾病风险[10-11]。本研究结果显示,在慢性萎缩性胃炎患者中,血清PGⅠ、PGⅠ/PGⅡ的比值明显降低,且在Hp 阳性感染的患者中降低程度更明显,PGⅡ的比较差异无统计学意义,主要是PGⅡ的分泌主要来自成熟的腺细胞,不易受到其余因素的影响,然而随着胃黏膜的萎缩,可直接导致主细胞、黏液细胞分泌PGⅠ的能力降低,加上在Hp感染的刺激下,会进一步侵袭到胃黏膜,从而导致了PGⅠ/PGⅡ比值的降低。
另也有报道指出,慢性萎缩性胃炎疾病进展属于一种慢性炎症过程,各类炎症因子的作用在疾病的发生和发展中也具有作用[12]。TGF-β是种具有多功能的细胞因子,生物学效应可通过多种受体来完成,近年来也有研究指出,TGF-βRⅡ信号通路可通过对肿瘤途径产生抑制作用,从而阻碍胃癌的影响,而随着TG-βRⅡ的降低,可导致组织炎症反应的加重[13]。IL-6 在机体中具有促炎、抗炎的双重作用,在炎症反应的刺激下,IL-6可出现大量表达,促使单核细胞、中性粒细胞释放,并在炎症部位大量聚集;TNF-α也是炎症过程中的一类重要介质,主要产生于活化的单核细胞、巨噬细胞中,且其的大量表达还可促使其余炎症因子的大量释放[14-15]。本研究通过观察显示,在慢性萎缩性胃炎患者中,血清TGF-βRⅡ呈降低表达,IL-6、TNF-α呈升高表达,且在合并Hp 阳性感染的患者中变化程度更明显,分析是由于在慢性萎缩性胃炎及Hp 感染的刺激下,会影响到TGF-β对细胞增殖的抑制作用,导致TGF-βRⅡ分泌的减少,且Hp 感染后可刺激到免疫活性细胞释放大量的炎症因子,令机体处于持续性炎症状态下,造成血清IL-6、TNF-α的大量表达。
本研究通过进一步分析也显示,血清GH、PGⅠ/PGⅡ和TGF-βRⅡ均呈正相关,和IL-6、TNF-α均呈负相关,分析是由于在Hp感染之后,随着胃黏膜炎症反应的加剧,可导致大量单核细胞释放并浸润,降低机体免疫细胞活性,且Hp 可释放大量的空泡素和细胞毒素,对胃上皮细胞细胞产生刺激作用,诱导其生产大量炎症因子;此外,在炎症作用的刺激下,可进一步加重黏膜萎缩程度,并对胃黏膜产生侵袭,降低细胞内腺体分泌PG的能力,影响到胃肠动力学;由此可见血清GH、PGⅠ/PGⅡ和TGF-βRⅡ、IL-6、TNF-α之间具有相互协同相互促进的作用。
综上所述,在慢性萎缩性胃炎伴Hp感染患者中,血清GH、PGⅠ/PGⅡ、TGF-βRⅡ水平表达降低,IL-6、TNF-α水平升高,各指标具有密切联系,参与着疾病的发生和发展。
