新生儿凝血功能及出血性疾病的危险因素分析
2021-10-08吴雨蒙赵晓晨韩向飞
吴雨蒙,赵晓晨,韩向飞
北京市昌平区妇幼保健院检验科,北京 102200
胎儿的凝血系统随着母亲孕周的增长而逐渐发育成熟。大约在孕10周时,凝血因子开始在子宫内合成,随着妊娠的发展,其水平也逐渐增加[1]。新生儿的凝血系统处于一个动态发展的过程,且一般在出生6个月后才能完全成熟[2]。然而,临床上在评估新生儿凝血系统功能时,通常将成人凝血功能指标参考范围直接应用于新生儿凝血功能指标结果的判断。事实上,相较于成人,新生儿凝血功能存在相对低凝的状态,这可能是导致新生儿出血倾向增加的原因[3]。与婴儿和儿童相比,新生儿发生血栓形成的风险较高,这可能是由于败血症、炎症、低血压、缺氧以及在小直径血管和脐血管中使用血管内导管所引起的[4]。“新生儿出血性疾病”的概念对新生儿出血或血栓形成事件的诊断和处理均具有重要影响,一旦出现新生儿出血性疾病可能会危及新生儿的生命。对于新生儿凝血功能的评价,应使用适合其年龄的分析仪和试剂以及恰当的参考范围;对于患有出血性疾病的新生儿,应遵循针对特定年龄的指南。因此,了解凝血系统的生理年龄依赖性变化对于血栓形成或出血的准确诊断至关重要,尤其是针对新生儿。凝血功能检测对于可能患有脑、肺或胃肠道出血风险的新生儿或具有重要价值[5]。因此,认识并了解新生儿凝血系统的发展特征及新生儿出血性疾病的危险因素有助于对其进行迅速诊断和适当处理。基于此,本研究的目的是研究新生儿凝血系统发育情况,分析健康和患有出血性疾病新生儿的凝血功能差异及新生儿出血性疾病的危险因素。
1 资料与方法
1.1一般资料 选取2019年1月至2020年6月在本院分娩的新生儿作为研究对象,新生儿出生后均预防性肌肉注射维生素K。健康新生儿纳入标准包括:(1)一般情况尚可的足月儿(孕周37~<42周)及早产儿(孕周28~<37周);(2)新生儿出生0~14 d内(出生后2 h及1、2、3、4、5、7、14 d)在本院进行凝血功能指标[包括凝血酶原时间(PT)、凝血酶原时间-国际标准化比值(PT-INR)、活化部分凝血活酶时间(APTT)、APTT测定值比率(APTT-ratio)、凝血酶时间(TT)、纤维蛋白原(FIB)]检测;(3)新生儿临床基本资料(包括性别、出生后体质量、分娩方式、Apgar评分)充分,血常规和凝血功能指标结果正常;(4)新生儿母亲的基本资料(包括年龄,孕周,孕期吸烟史,孕期饮酒史,妊娠相关疾病如妊娠糖尿病、子痫前期/HELLP综合征、绒毛膜羊膜炎)充分。新生儿出血性疾病的纳入标准:新生儿出现血小板减少性紫癜(皮肤出血点、瘀斑)、弥散性血管内凝血、脐带残端出血、血尿、血便、体内出血(如消化道出血、肺出血、颅内出血等)等则认定其患有新生儿出血性疾病[6-7]。排除标准包括:(1)先天性畸形、先天性溶血性以及其他特殊疾病(如宫内病毒、寄生虫感染等)新生儿;(2)有子宫内输血史的新生儿;(3)新生儿窒息(1 min Apgar评分≤5分或脐动脉pH值≤7.0或碱剩余≥12 mmol/L)及胎龄未满28周的新生儿。收集新生儿上述相关临床基本资料及凝血功能指标检测结果,根据纳入和排除标准对所纳入的新生儿进行研究资格评估,最终确定符合标准的健康新生儿(A组)611例,出血性疾病新生儿(B组)124例。2组临床基本资料比较,B组母亲患有子痫前期/HELLP综合征、绒毛膜羊膜炎、采用剖宫产方式分娩的比例均高于A组,新生儿体质量和Apgar评分则低于A组,差异均有统计学意义(P<0.05);2组其他基本资料比较,差异无统计学意义(P>0.05),具有可比性,见表1。本研究所有程序均根据赫尔辛基宣言执行,且本研究已获得本院医学伦理委员会批准。
表1 2组新生儿基本资料比较或n(%)]

组别n性别男女体质量(g)分娩方式*阴道分娩剖宫产Apgar评分(分)A组611345(56.46)266(43.54)3 197.12±238.35399(65.30)212(34.70)8.63±2.08B组12469(55.65)55(44.35)2 880.34±302.4535(28.23)89(71.77)7.61±2.55t/χ20.1688.7957.6554.781P0.867<0.001<0.001<0.001
1.2凝血功能检测 为了检测结果的准确,必须正确采集血液标本,肝素的微小污染也可能产生不准确的结果。理想情况下,血液标本应从没有气泡或组织液污染的外周静脉抽取。对于早产儿或难以建立静脉通路的婴儿,建议从留置导管获取血液标本。由技术熟练的儿科护士进行新生儿静脉穿刺,采集后的血液立即放入含有3.2%枸橼酸钠抗凝剂(体积比为9∶1)的蓝头采血管中,置于-4 ℃下低温保存,2 d内使用希森美康凝血分析仪及其配套试剂检测PT、PT-INR、APTT、APTT-ratio、TT及FIB水平。

2 结 果
2.1A组2周内凝血功能指标的变化情况 A组出生后2周内PT-INR、APTT-ratio、TT逐渐下降,而FIB水平逐渐上升,大约在1周左右PT-INR、APTT-ratio、TT、FIB均达到一个较为稳定的水平。见图1。
2.22组新生儿出生2 h凝血功能比较 B组PT、APTT较A组延长,APTT-ratio低于A组,差异均有统计学意义(P<0.05),见表2。
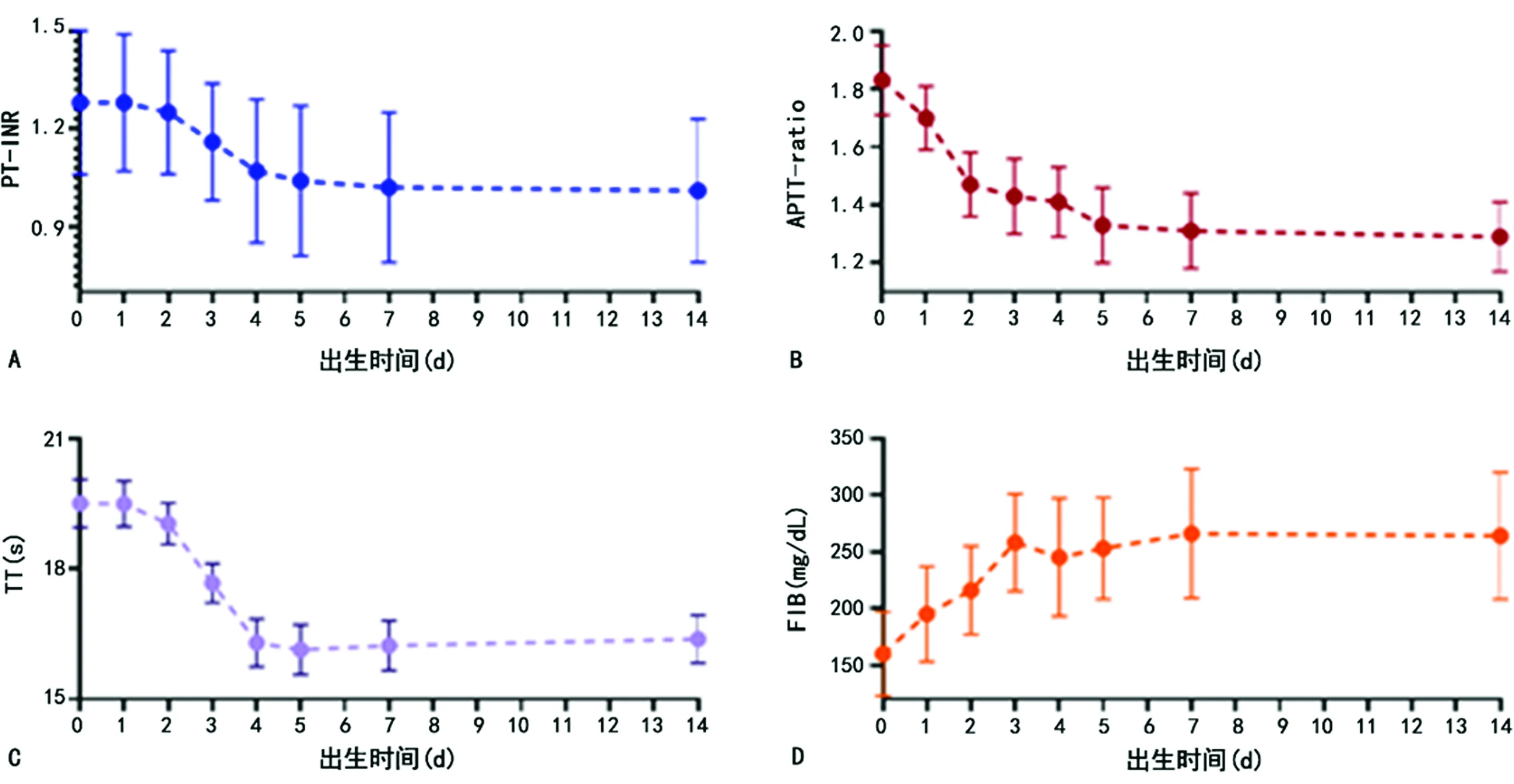
注:A、B、C、D分别表示PT-INR、APTT-ratio、TT及FIB水平变化情况。

表2 2组出生2 h凝血功能指标比较
2.3新生儿出血性疾病危险因素分析 采用多因素Logistic回归模型分析新生儿出血性疾病的危险因素,结果显示,早产儿(孕周<37周)、母亲患有子痫前期/HELLP综合征及低体质量儿(<2 500g)为新生儿出血性疾病的危险因素[OR=3.35(95%CI:1.62~5.79)、1.56(95%CI:1.14~3.23)、1.89(95%CI:1.28~6.33),P<0.05],见表3。
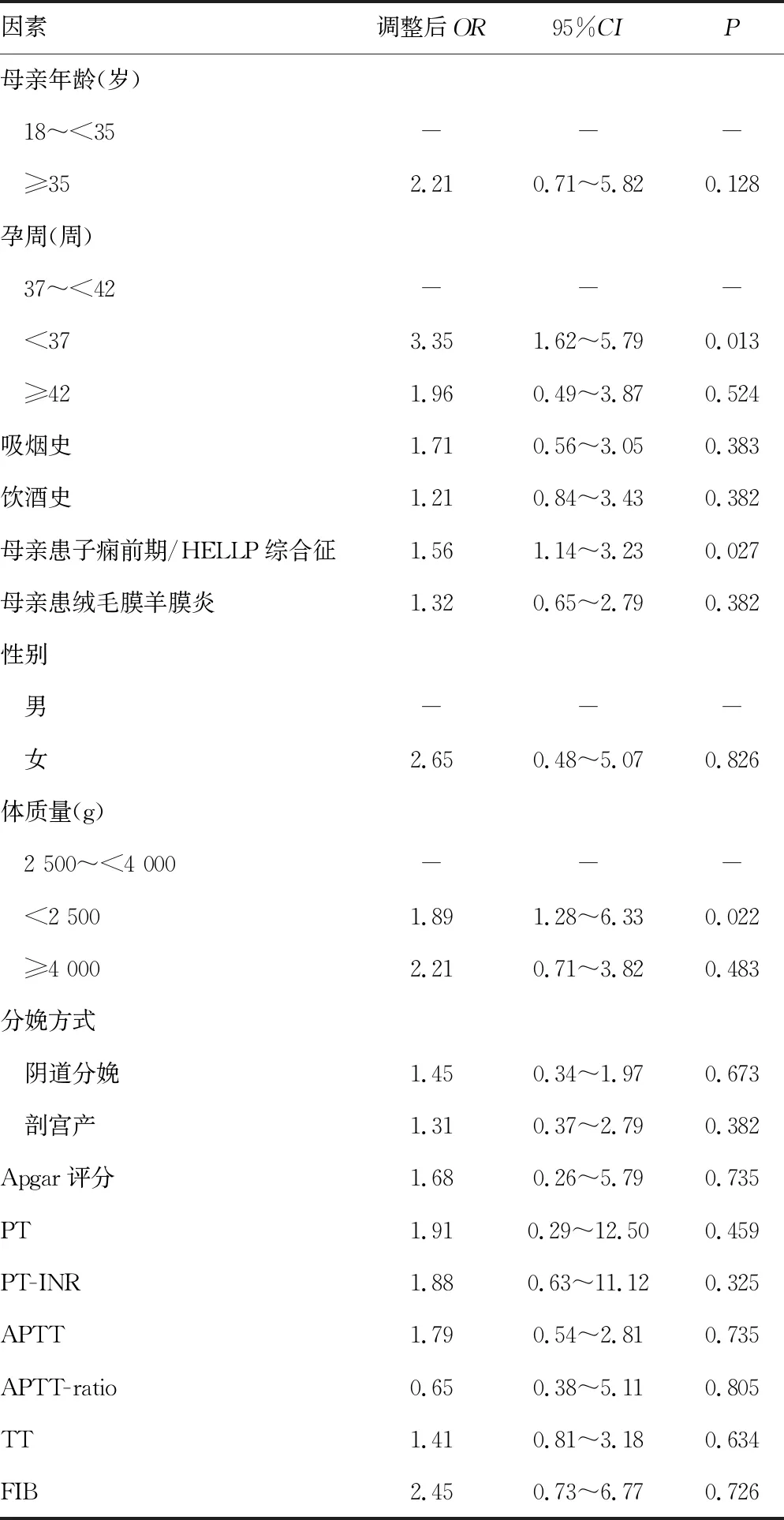
表3 新生儿出血性疾病多因素Logistic回归模型分析结果
3 讨 论
新生儿出血性疾病是一种罕见的疾病,通常是由于新生儿机体内凝血功能紊乱造成,一般发生在新生儿出生后的1周内[1]。在诊治患有出血性疾病的新生儿时,了解凝血系统早期特征是很重要的。本研究中,新生儿出生2 h时的凝血功能检测结果处于“正常成年人凝血功能检测结果参考范围”之外。随着时间的延长,新生儿的PT-INR、APTT-ratio、TT在出生后逐渐下降,而FIB水平逐渐上升,大约在1周左右PT-INR、APTT-ratio、TT、FIB可达到一个较为稳定的水平。本研究与先前的研究得到相似的结论,即新生儿凝血相关检验指标参考值范围采用成年人的标准,可能不利于筛选新生儿潜在的凝血障碍[7-12]。凝血系统的建立和发展受年龄的影响,许多凝血相关蛋白的水平取决于胎龄和产后年龄。一般来说,新生儿刚出生时,维生素K依赖性凝血因子(FⅡ、FⅦ、FⅨ、FⅩ)和接触因子(FⅪ、FⅫ)的水平常常只有成人正常值的50%左右[7]。同时,新生儿参与纤溶的蛋白质(纤溶酶原和组织纤溶酶原激活剂)和天然凝血抑制剂(如抗凝血酶、蛋白C和蛋白S)水平较低导致新生儿相对低纤溶状态。因此,新生儿存在相对低凝的一种状态,这可能是导致新生儿出血倾向增加的原因[3]。凝血系统在新生儿出生后的几周和几个月内逐渐发育成熟,大多数凝血相关蛋白的水平,无论是足月婴儿还是早产儿,到6个月大时都已非常接近成人的水平[7-8]。
尽管产科诊疗技术和新生儿保健有所进步,但早产儿和低体质量儿仍然不少。在本研究中,早产儿(孕周<37周)、母亲患有子痫前期/HELLP综合征以及低体质量儿(<2 500 g)为新生儿出血性疾病的危险因素[OR=3.35(95%CI:1.62~5.79)、1.56(95%CI:1.14~3.23)、1.89(95%CI:1.28~6.33),P<0.05]。与足月儿相比,早产儿血浆中促凝和抗凝维生素K依赖性凝血因子水平降低,血浆中FⅫ因子和接触因子在内的其他蛋白质的水平有所降低[9]。早产儿有出血并发症的风险,这些并发症中最危险的是脑室内出血,通常表现为严重的颅内出血,伴有较高的病死率和致残风险[9-11]。低出生体质量儿止血系统不成熟对出血发生的影响尚不清楚,有文献报道,由于循环系统发育不成熟,早产儿和低体质量儿的出血风险增加,尤其是在生后的第1周[12-13]。本研究还认为母亲患有子痫前期/HELLP综合征对新生儿凝血功能指标有影响,这与近期相关研究结论相似[14]。子痫前期/HELLP综合征是妊娠最常见的妊娠并发症之一,母体的这种病理状态可能会导致小动脉血管收缩和子宫胎盘血流量减少,从而导致母体胎儿交换区域的氧气供应不足,使胎儿处于缺氧状态,增加胎儿出血的风险[15-16]。针对新生儿凝血功能的评估和出血性疾病的诊断往往具有挑战性,这需要临床医生根据新生儿具体的年龄、临床症状(如瘀斑)、家族出血史、孕产妇疾病(包括感染或血小板减少症)、先前妊娠的结果、药物使用的详细记录(母亲和新生儿,尤其是新生儿出生时使用维生素K的相关记录),以及根据凝血功能参考范围对新生儿的凝血功能指标检测结果进行适当的解释[12]。
综上所述,认识到新生儿凝血系统的发展特征及新生儿出血性疾病的危险因素有助于对新生儿出血性疾病进行迅速诊断和适当处理。