急性主动脉综合征的影像学研究进展
2021-10-06王黛黛杜兰芳综述马青变审校
王黛黛、杜兰芳综述,马青变审校
急性主动脉综合征(acute aortic syndrome,AAS)是一组危及生命的血管急症,主要包括急性主动脉夹层、主动脉壁内血肿和穿透性主动脉溃疡,其共同的特点是主动脉壁的完整性受损。AAS 的死亡率很高,需要尽快早期诊断,并立即进行内科或外科治疗[1],研究表明,对于A 型主动脉夹层来讲,开始治疗的时间每延迟1 h,死亡率增加1%[2]。目前,AAS 的诊断主要依靠影像学检查,近年来,随着科学技术的发展,除CT 血管造影(CTA)、超声心动图等传统的影像学方式外,目前发展出了应用四维血流心血管磁共振(four-dimensional flow cardiovascular magnetic resonance,4D-Flow CMR)评估AAS 的血流动力学状态,正电子发射计算机断层显像(PET)-CT、基于纳米颗粒作为对比剂的血管CT 等检查用于评估血管壁的炎症反应,此外,越来越多的研究将机器学习用于主动脉夹层的诊断与预后评估中。
1 AAS 在影像学诊断方面的进展
1.1 AAS 影像学分类方法研究进展
近年来,随着CT 的空间和时间分辨率的提高,三维后处理技术的逐渐增大,AAS 的影像学分类方法逐步发展。目前临床最常用的分类方法为Stanford分型及DeBakey 分型。Qanadli 等[3]将主动脉弓作为一个独立整体,并结合脏器灌注不良综合征的类型,将急性主动脉夹层分为三型(A 型:至少累及升主动脉;B 型:仅累及降主动脉;C 型:累及主动脉弓伴或不伴降主动脉受累)及四个脏器灌注不良级别(0:无脏器灌注不良;1:动态脏器灌注不良;2:静态脏器灌注不良;3:静态和动态脏器灌注不良)。Sievers 等[4]对357例患者进行研究,在Stanford 分型的基础上,提出了TEM 分型方法,即包括夹层类型(T)、主要破口的位置(E)和脏器灌注不良(M),结果表明此种方法可以更好地指导治疗及判断预后。
1.2 AAS 影像学早期诊断研究进展
由于具有良好的敏感性和特异性等优点,主动脉CTA 是目前诊断AAS 首选的影像学检查手段,从20 世纪90年代中期到2010年初,CTA 作为初始诊断手段的比例从46%上升到73%,但应用CTA 检查时,由于心脏搏动的影响,在升主动脉可出现伪影,从而造成在A 型主动脉夹层诊断中出现假阳性,近年来,心电门控CTA(ECG-gated CTA)及大螺距CT(high-pitch CT)的发展可减少这种假阳性。心电门控技术通过心电图信号触发选择性地控制X 线管的曝光,从而减少每次扫描之间的少许重叠,有利于减少伪影,而大螺距CT 通过更快的扫描速度减少伪影形成。Yanagaki 等[5]研究表明,与非心电门控CTA和单舒张期心电门控CTA 相比,全心动周期心电门控CTA 可更准确地显示急性主动脉夹层中的内膜撕裂以及内膜撕裂中的溃疡样突起(ulcer-like projection,ULP)。也有研究大螺距CT 即使在无心电门控的情况下,也可以消除患者呼吸或心脏搏动造成的伪影,在主动脉病变评估方面优于普通多螺旋CT[6]。
与CTA 相比,超声心动图最大的优势在于方便获取,尤其是床旁用于血流动力学不稳定的患者,近年来,针对性心脏超声(focused cardiac ultrasound,FOCUS)在急诊中得到广泛的应用[7],其定义是医生在诊疗过程中,同时应用床旁超声对心血管系统进行有序的检查,从而达到快速床旁诊断的目的。FOCUS 可应用于疑诊AAS 患者的快速检诊中,Nazerian 等[8]共纳入五个不同研究中心839例疑诊AAS 患者,并将FOCUS 诊断AAS 的征象分为直接征象和间接征象,结果表明FOCUS 直接征象[包括发现内膜瓣、主动脉壁内血肿(主动脉壁出现圆形或新月体增厚>5 mm)以及穿透性主动脉溃疡(主动脉壁边缘参差不齐,呈火山口状突起)],是决定患者继续行CT 或经食道超声心动图检查的非常好的工具。另一项单中心研究纳入281例疑诊主动脉夹层的患者,结果也表明FOCUS 可作为一种快速分诊工具,帮助急诊医生识别疑似A 型主动脉夹层患者是否需要进一步行其他影像学检查,值得注意的是,FOCUS 阴性结果不能除外急性主动脉夹层[9]。
2 AAS 在影像学预后评估方面的进展
2.1 主动脉CTA 征象在预测预后中的作用
在急性主动脉夹层方面,院内死亡的患者更容易出现以下征象:心包积液、心包压塞、主动脉周围血肿、假腔未闭[10]。此外,CT 扫描横切面上真腔及假腔状态也有助于判断预后,如果真腔呈新月形或凹入假腔,则可能在真腔及其分支间存在压力差(pressure deficit),从而导致脏器缺血风险增加[11]。
2.2 AAS 中肾脏灌注不良的测量
在急性主动脉夹层中,20%~30%合并脏器灌注不良综合征,其中最常见的是肾缺血[12],其次为肠缺血、下肢缺血、脊髓缺血等[13-14]。急性主动脉夹层并发的肾功能不全会导致院内死亡率明显增高,无论是A 型主动脉夹层还是B 型主动脉夹层[10]。近年来,CT 灌注成像发展迅速,这是一种反映活体组织灌注情况的功能成像方法,其基本原理是在静脉注射对比剂的同时,对特定层面进行连续多次扫描,从而可以获得这个层面内各像素点的时间密度曲线(time density curve,TDC),再通过算法获得相关灌注参数(图1)[15]。Liu 等[15]通过对43例患者行320 排CT 肾灌注成像检查,并分析其与肾动脉受累情况、夹层类型等进行相关性分析,发现A 型主动脉夹层的肾血流灌注值显著低于B 型患者(P=0.004),肾动脉是否受累也与肾灌注量密切相关,来自真腔与假腔的肾血流灌注值差异有统计学意义(P=0.016)。这说明CT 灌注扫描可临床应用于急性主动脉夹层患者中,但该研究受试者例数有限,未来需进一步研究。
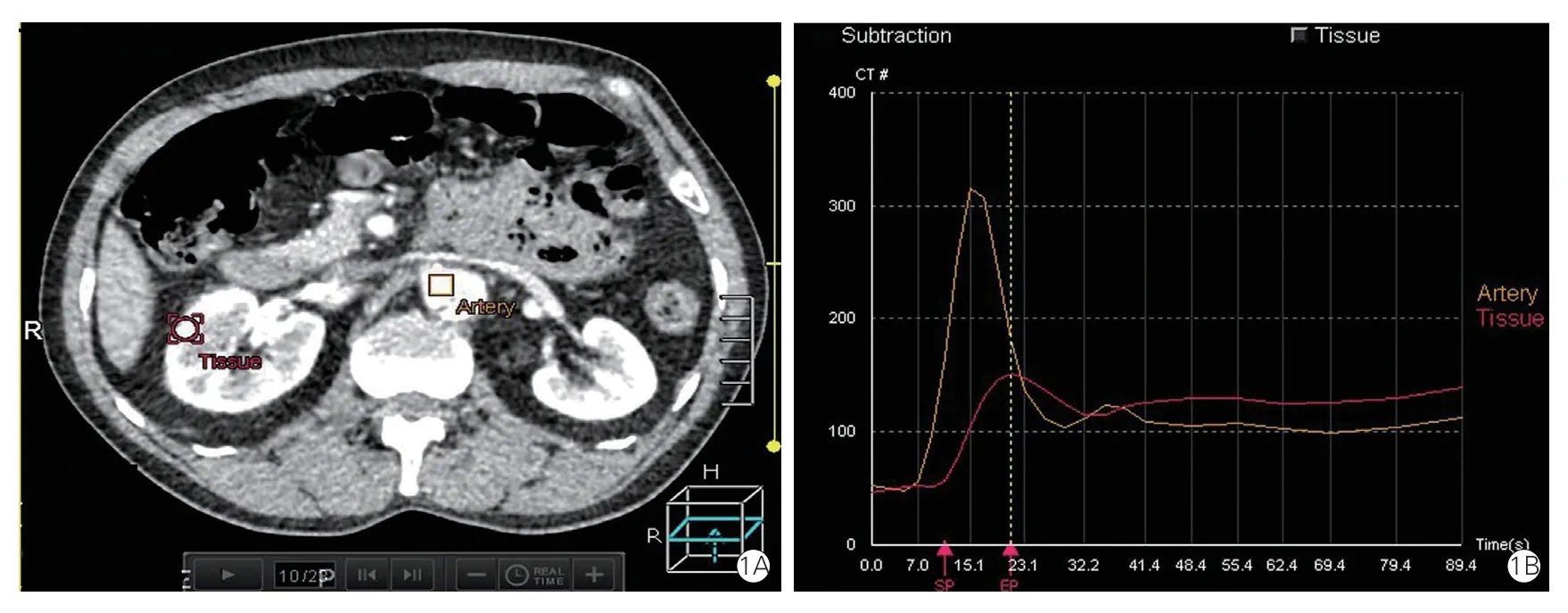
图1 320 排CT 肾灌注成像检查
2.3 AAS 的血流动力学测量
与主动脉CTA 相比,4D-Flow CMR 的优势在于可以很好地评估主动脉病变部位不同的血流动力学改变,且随着技术的发展,4D-Flow CMR 扫描采集时间缩短到7~12 min,为4D-Flow CMR 在急性疾病的临床应用奠定了基础[16]。在主动脉夹层方面,4D-Flow MRI 可对真腔及假腔进行定性和定量血流动力学分析,并通过分析二者的关系,同时结合双腔对各自管壁的压力分析,最终评估主动脉破裂的风 险[17]。François 等[18]应 用4D-Flow MRI 对12例胸主动脉夹层受试者的血流动力学变化进行了评估,结果发现真腔主要以层流为主,而假腔表现为复杂的非层流的血流模式,同时经常出现收缩期逆行血流。
2.4 AAS 血管壁炎症的检测
既往研究表明,AAS 的发生与血管壁的炎症密切相关,主动脉夹层患者血管壁存在巨噬细胞聚集的现象[19]。PET-CT 可以检测到血管壁的炎症活动,因为聚集在血管壁的白细胞需要葡萄糖来加速代谢过程,而PET-CT 的放射性示踪剂[最常见的18F 脱氧葡萄糖(18F-FDG)]为葡萄糖的类似物[20],因此通过PET-CT 检查可以区分血管壁炎症的严重程度。在动物实验中,有研究表明FDG 摄取强度与动脉血管壁的巨噬细胞含量呈正相关[20]。通过对血管壁炎症严重程度的区分可能能预测患者的预后,一项研究纳入34例急性B 型主动脉壁内血肿患者,在发病14 d 内接受PET-CT 检查,发现主动脉壁最大标准摄取值(SUVmax)高的患者更容易出现严重主动脉相关不良事件[包括3 个月内行胸主动脉腔内修复术、发生主动脉夹层、ULP 增大或新出现ULP、主动脉扩张(≥60 mm 或增加25%)][21],但相关研究数量较少,且都为小样本量研究,有必要对更大的患者队列进行前瞻性研究,以评估PET-CT 的实际临床价值。对于PET-CT 在主动脉壁内血肿及穿透性主动脉溃疡的应用相关研究较少,仅有几篇病例报告,研究显示对于主动脉壁内血肿和穿透性主动脉溃疡,病变部位的SUV 值在4~10,此外,对于穿透性主动脉溃疡患者,FDG 摄取量高的患者,更容易发生急性严重主动脉事件,病变部位FDG摄取量与基线水平相比,比值大于1.5 的患者为高风险患者。总之,PET-CT 对于AAS 的诊断及预后危险分层具有潜在的作用,但由于PET-CT 的扫描时间长,不适合用于疑诊主动脉综合征患者的鉴别诊断[22]。
此外,基于纳米颗粒的CT 对比剂由于其分子量大且在血液中半衰期长,可用于评价主动脉壁的病变情况。在内皮通透性增加的疾病中,纳米粒子可以被动地外渗出血管,此外也可以渗透到免疫细胞中,包括单核细胞和巨噬细胞。另外,纳米粒子还可以靶向定位于病变主动脉的分子或细胞成分。Ghaghada 等[23]构建小鼠主动脉夹层动物模型,并对行CTA 及纳米颗粒作为对比剂的CT(delayed nanoparticle contrast-enhanced computed tomography,CTD)检查,结果发现,与CTA 相比,CTD 可以更早发现主动脉夹层血管壁损伤,且可以发现主动脉壁退化及炎症反应。
3 人工智能在AAS 中的应用进展
随着人工智能和大数据时代的到来,机器深度学习的方法已应用到各个领域,尤其是在影像图像的阅读中[24]。目前,越来越多的研究将人工智能应用于主动脉夹层的影像学分析,主要集中在快速准确地进行主动脉CTA 图像分割、计算与识别,以便早期自动诊断AAS[25-26]。一项涉及170例主动脉夹层患者的研究,应用基于Xception 结构算法,开发了一种自动诊断急性主动脉夹层算法,该算法可以很好地识别CT 图像中的主动脉夹层表现(准确率为90.0%,敏感度为91.8%,特异度为88.2%),与放射科医生阅片结果相当[24]。此外,基于机器学习对主动脉夹层影像学进行参数测量,可以起到精确指导治疗及预测预后的作用。Hahn 等[27]通过对45例患者共153 张CTA 图像进行研究,应用卷积神经网络(CNN)分割算法的方法开发了一种机器自动分割方法,可以准确识别真假腔并计算相关形态学参数,包括真假腔面积、直径等,其与手动测量相关性良好(r2=0.95)。Cao 等[28]也基于深度学习的模型为B型主动脉夹层(TBAD)的准确有效分割提供了一种很好的方法,并使TBAD 解剖特征的自动测量成为可能。此外,Lopez-Linares 等[29]提出了一种基于深度卷积神经网络(DCNN)的机器学习方法,可从CTA 中自动提取感兴趣的血栓区域,并可以精准地量化血栓体积,从而更好地指导预后。近年来,多模态心血管成像的概念得到发展,即根据不同的影像学特点,有效整合来自各种不同成像模式的信息来解决实际问题[30]。Wang 等[31]的研究发现,通过将主动脉CT 及MRI 图像进行融合,再对融合后的图像进行机器学习,可以提高图像识别的准确性。
综上所述,近年来,随着影像学技术的发展,AAS 的影像学诊断方式更为多样,除了传统的形态学诊断,目前基于血管动力学及血管壁炎症的影像学方式也得到了发展,这对精准评估AAS 危险分层意义重大,但这些研究数目相对较少,未来需进一步研究。
利益冲突:所有作者均声明不存在利益冲突
