芝麻素对糖尿病心肌病的保护作用及机制研究
2021-10-06郭振刘方圆安鹏汪铭煜杨丹杨政樊迪唐其柱
郭振,刘方圆,安鹏,汪铭煜,杨丹,杨政,樊迪,唐其柱
糖尿病心肌病(DCM)是1 型和2 型糖尿病最为严重且常见并发症之一[1]。DCM 的主要机制是高血糖和晚期糖基化终产物的产生,导致内皮功能障碍,引起炎症和氧化应激的增加[2],其主要特征是心肌结构和功能的改变,表现为早期心肌顺应性降低和舒张期充盈受阻的舒张功能不全,晚期收缩功能不全[3]。
芝麻素(sesamin,SES)是一种木脂素类植物营养素,是芝麻籽和芝麻油的主要成分之一[4]。研究表明,它具有多种生物学功能,包括抗氧化应激[5-7]、抗炎[8-9]、抗高血压[10]的作用。而其在DCM 中的作用尚少见报道,结合SES 具有的抗炎、抗氧化的药理作用,本研究猜想SES 是否可以改善链脲佐菌素(streptozotocin,STZ)诱导的糖尿病心肌损害。
1 材料与方法
主要试剂与材料:SES(#607-80-7)购自上海融禾医药科技发展有限公司(上海),其纯度≥99%。STZ 购自Sigma Aldrich(St Louis,MO,美国),血糖、丙二醛(MDA)、超氧化物歧化酶(SOD)检测试剂盒购自南京建成生物试剂公司(江苏,中国),白细胞介素1β(IL-1β)、白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)等引物由生工生物工程公司合成(上海),细胞DCMEM 培养基和胎牛血清购自GIBCO Life Technologies(GIBCO,美国)。羊抗兔二抗(美国CST 公司,7074);反转录试剂盒和实时PCR(RT-PCR)试剂(瑞士Roche 公司,4896866001),SYBRGreen I Master(瑞士Roche 公司4707516001)。定量RT-PCR 仪(瑞士R oche 公司,型号:LC480),酶标仪(美国伯腾仪器有限公司,Synergy HT)。
动物分组及给药方法:50 只健康雄性C57BL/6J小鼠,8 周龄,体重在18~23 g,购自中国医学科学院动物研究所。实验小鼠经过1 周检疫后,将周龄及体重达标且健康的雄性小鼠入组。将小鼠随机分为5组(每组8 只):对照组、SES组、DCM组、DCM+二甲双胍(MET,10 mg/kg)灌胃组(简称DCM+MET组)以及DCM+SES(100 mg/kg)灌胃组(简称DCM+SES组)[11]。
DCM 模型建立:小鼠给与腹腔注射STZ(溶于0.1 mol/L 的柠檬酸盐缓冲液中,pH=4.5,50 mg/kg),连续注射5 d。一周后,断尾采血检测其空腹血糖平均值≥16.6 mmol/L,且出现糖尿病典型症状,表示糖尿病模型建立成功。对照组小鼠注射等体积柠檬酸盐溶液。STZ 注射12 周后进行MET 和SES 持续灌胃4 周。4 周后取出小鼠心脏用于病理和分子生物学分析。
葡萄糖耐量试验(OGTT):小鼠麻醉取材前一天,饥饿处理16 h。葡萄糖(2.0 g/kg)灌胃,分别在0、30 min、60 min 和120 min 使用血糖仪测量小鼠血糖浓度。
心肌肌钙蛋白I(cTnI)和肌酸激酶同工酶(CKMB)水平:MET 和SES 持续灌胃4 周后,麻醉前取小鼠眼眶下静脉丛血液,室温下放置2 h 后离心获得血浆上清。使用cTnI 和CK-MB 检测试剂盒,按照说明书检测血清cTnI 和CK-MB 水平。
SOD 活性和MDA 含量检测:MET 和SES 持续灌胃4 周后收集各组小鼠心脏组织按照试剂盒说明书检测S0D 活性及MDA 水平。
二氢乙啶(DHE)染色检测心肌氧化应激水平:取材后的小鼠心脏经脱水、石蜡包埋、切片后,脱蜡水合、DHE 染色、荧光显微镜下拍照。
免疫组化检测炎症浸润程度:取材后的小鼠心脏经脱水、石蜡包埋、切片后,脱蜡水合、柠檬酸抗原修复、10%羊血清封闭后,孵育TNF-α、CD45 一抗4℃过夜,次日复温,应用二氨基联苯胺(DAB)显色,拍照。
RT-PCR 检测信使RNA(mRNA)表达水平:取出冻存的心脏组织每个检测样品15 mg,加入1 ml TRiZOL 研磨制成匀浆。按照总RNA 提取步骤获得样品组织总RNA。每个组织样品取出2 μg 总RNA逆转录获得互补DNA。使用SYBR GREEN I RTPCR 体系检测心肌细胞相关基因的表达。
蛋白免迹印迹(Western blot)检测炎症和氧化应激标志物的蛋白水平:取心脏组织或H9c2 细胞,研磨后加入RIPA 裂解液进行裂解,提取蛋白并定量。每孔蛋白上样量50 μg 进行聚丙烯酰胺凝胶(SDSPAGE)电泳。转膜,封闭后分别孵育一抗,4℃过夜,次日二抗孵育1 h 后显色。以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参,采用Image-Pro Plus 6.0 软件检测各条带的吸光度(A)值。
细胞培养Sirt3 抑制试验:心肌H9c2 细胞使用10% FBS/DCMEM 培养基培养。心肌H9c2 细接种在六孔板上培养,1×104细胞数/孔。在37℃、5%二氧化碳(CO2)培养箱中常规培养24 h。将细胞分为8组:①对照组[5.5 mmol/L 葡萄糖(GLU)培养24 h]、②SES组[11](10 mmol/L 处理24 h)、③高糖(HG)组(33 mmol/L GLU刺激24 h)、④HG+SES组(33 mmol/L GLU+10 mmol/L SES 24 h),及在前四组的基础上分别添加Sirt3 选择性抑制剂(3-TYP,50 μmol/L 处理24 h)即:⑤对照+3-TYP组、⑥SES+3-TYP组、⑦HG+3-TYP组、⑧HG+SES+3-TYP组。细胞处理结束后使用细胞增殖检测(CCK8)试剂盒(碧云天)检测心肌H9c2 细胞的存活率。
统计学方法:数据分析采用SPSS 23.0 数据分析软件。计量资料采用均数±标准差(±s)表示,多组间比较采用单因素方差分析,两两比较采用SNK-q 检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组血糖水平和心肌损伤标志物比较(图1)
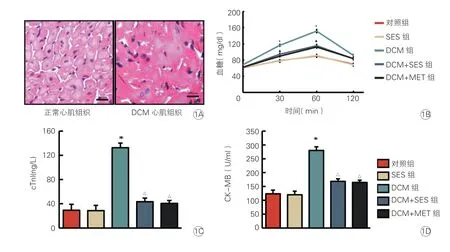
图1 各组小鼠血糖水平和心肌损伤标志物的比较(各组n=8)
HE 染色结果表明,对照组心肌细胞排列整齐,结构清晰;DCM组心肌组织结构排列紊乱,结构不清晰,细胞核膜皱缩破裂(图1A),可证明DCM 模型构建成功。在OGTT 试验中分别检测四个时间点小鼠餐后0 min、30 min、60 min 和120 min 的血糖水平。各组小鼠餐后血糖水平在60 min 时间达到高峰,DCM组小鼠血糖水平显著高于对照组(P<0.05),DCM+SES组和DCM+MET组小鼠餐后血糖水平显著低于DCM组(P<0.05),而DCM+MET组 与DCM+SES组小鼠餐后血糖水平差异无统计学意义(P>0.05,图1B)。
DCM组小鼠cTnI、CK-MB 水平均显著高于对照组(P均<0.05),DCM+SES组和DCM+MET组小鼠cTnI、CK-MB 水平均显著低于DCM组(P均<0.05),而DCM+MET组与DCM+SES组小鼠cTnI、CK-MB 水平差异均无统计学意义(P均>0.05,图1C、1D)。
2.2 SES 对DCM 小鼠心肌组织氧化应激状态的影响(表1、图2)
表1 各组小鼠MDA 和SOD 含量比较(各组n=8,±s)
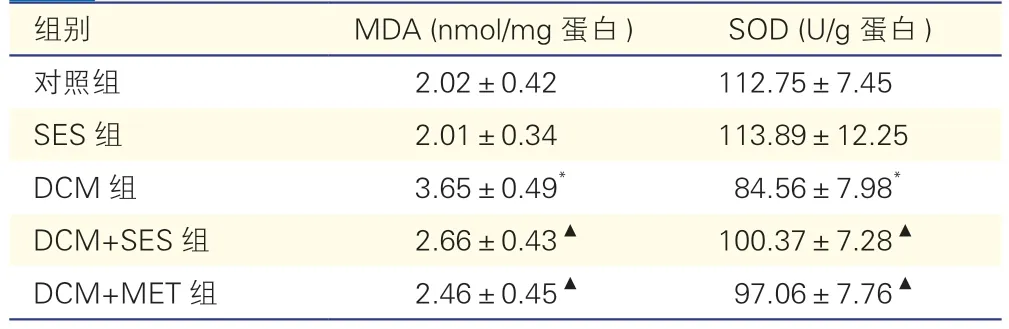
表1 各组小鼠MDA 和SOD 含量比较(各组n=8,±s)
注:SES:芝麻素;DCM:糖尿病心肌病;MET:二甲双胍;MDA:丙二醛;SOD:超氧化物歧化酶。与对照组比较*P<0.05;与DCM组比较▲P<0.05
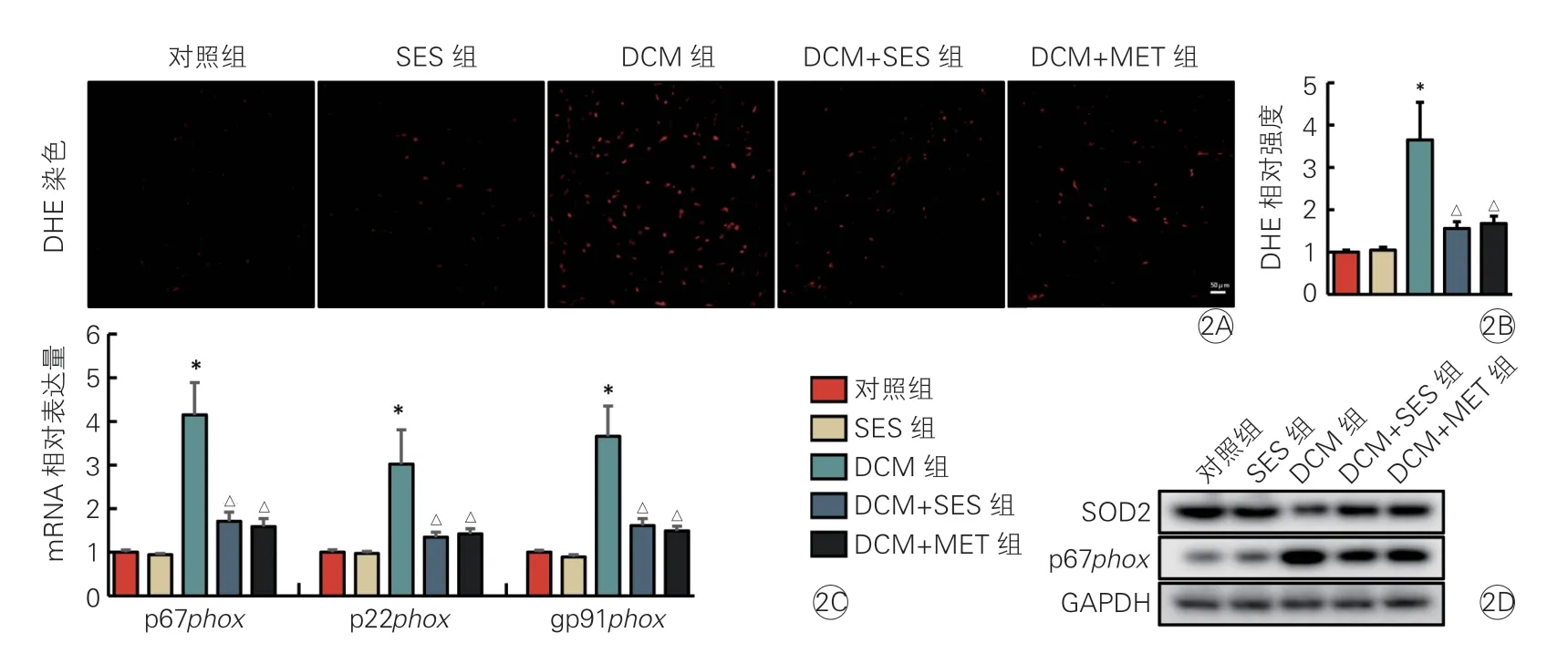
图2 SES 对DCM 小鼠心肌组织氧化应激状态的影响(各组n=8)
DCM组小鼠脂质过氧化产物MDA 显著高于对照组,而SOD 活性含量显著低于对照组(P<0.05);DCM+SES组心肌组织中MDA 显著低于DCM组,而SOD 含量显著高于DCM组(P<0.05),而DCM+MET组与DCM+SES组间MDA/SOD 含量水平差异均无统计学意义(P均>0.05,表1)。
DHE 染色结果表明,DCM组小鼠的DHE 阳性强度明显强于对照组(P<0.05),DCM+SES组和DCM+MET组小鼠的DHE 阳性强度显著低于DCM组(P<0.05),且DCM+MET组与DCM+SES组之间差异无统计学意义(P>0.05,图2A、2B)。
RT-PCR 结果表明,DCM组小鼠的烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶功能亚基(p22phox、p67phox以及gp91phox)mRNA 表达水平明显高于对照组(P均<0.05),DCM+SES组小鼠的p22phox、p67phox以及gp91phoxmRNA 表达水平显著低于DCM组(P均<0.05),且DCM+MET组与DCM+SES组 间p22phox、p67phox及gp91phoxmRNA 表达水平差异均无统计学意义(P均>0.05,图2C)。
Western blot 结果表明,DCM组小鼠的SOD2/p67phox蛋白表达水平明显低于/高于对照组(P均<0.05),DCM+SES组小鼠心肌组织的SOD2/p67phox蛋白表达水平显著高于/低于DCM组(P均<0.05),且DCM+MET组与DCM+SES组间SOD2/p67phox蛋白表达水平差异均无统计学意义(P>0.05,图2D)。
2.3 SES 对糖尿病小鼠心肌组织炎症的影响(图3)
免疫组化染色结果表明,DCM组小鼠的CD45和TNF-α 阳性区域明显高于对照组,DCM+SES组小鼠心肌组织的CD45 和TNF-α 阳性区域显著低于DCM组(P均<0.05),且DCM+MET组与DCM+SES组间CD45 和TNF-α 阳性区域差异无统计学意义(P均>0.05,图3A、3B)。
RT-PCR 结果表明,DCM组小鼠的IL-6、IL-1β 和TNF-α mRNA 表达水平明显高于对照组(P均<0.05),DCM+SES组和DCM+MET组小鼠的IL-6、IL-1β 和TNF-α mRNA 表达水平显著低于DCM组(P均<0.05,图3C)。
Western blot 结果表明,DCM组小鼠的TNF-α蛋白表达水平显著高于对照组(P<0.05);DCM+SES组和DCM+MET组小鼠的TNF-α 蛋白表达水平显著低于DCM组(P<0.05),而DCM+MET组 与DCM+SES组间TNF-α 蛋白表达水平差异无统计学意义(P>0.05,图3D)。

图3 SES 对DCM 小鼠心肌组织炎症的影响(各组n=8)
2.4 SES 通过上调Sirt3 对抗高糖导致的心肌细胞氧化应激和炎症紊乱及细胞的损伤(图4)
Western blot 结果表明,DCM组小鼠的Sirt3 蛋白表达水平显著低于对照组(P<0.05);DCM+SES组小鼠的Sirt3 蛋白表达水平显著高DCM组(P<0.05,图4A、4B)。
细胞实验中,通过设置不同的浓度梯度(0~50 mmol/L)的SES,在10 mmol/L 时,SES 能够最大限度的保护由高糖引起的心肌细胞损伤,同时又能较明显的激活Sirt3。细胞实验中,HG+SES组的活性氧(ROS)水平显著低于HG组(P<0.05);应用3-TYP后,HG+SES+3-TYP组 与HG+3-TYP组ROS 水平差异无统计学意义(P>0.05,图4C)。Western blot 结果表明,在未加3-TYP 的条件下,SES 均可改善高糖诱导的氧化应激、炎症状态和凋亡(图4D)。HG+SES组SOD2/p67phox蛋白表达水平显著高于/低于HG组(P均<0.05),HG+SES+3-TYP组与HG+3-TYP组SOD2 和p67phox蛋白表达水平差异均无统计学意义(P均>0.05);HG+SES组TNF-α 蛋白表达水平显著低于HG组(P<0.05),HG+SES+3-TYP组 与HG+3-TYP组TNF-α蛋白表达水平差异无统计学意义(P>0.05);HG+SES组BCL-2/BAX 蛋白表达水平显著高于/低于HG组(P均<0.05),HG+SES+3-TYP组 与HG+3-TYP组BCL-2 和BAX 蛋白表达水平差异均无统计学意义(P均>0.05)。HG+SES组细胞存活率显著高于HG组[(87.68±8.64)% vs.(55.67±7.85)%,P<0.05],HG+SES+3-TYP组 与HG+3-TYP组 细胞存活率差异无统计学意义[(55.39±8.32)%vs.(59.67±7.42)%,P>0.05,图4E]。

图4 SES 通过上调Sirt3 对抗高糖导致的心肌细胞氧化应激和炎症紊乱及细胞的损伤(各组n=6)
3 讨论
长期以来,糖尿病一直对人类健康有着巨大的威胁。糖尿病患者易并发DCM,可以造成不可逆转的心肌重构和心力衰竭,甚至引发心血管事件和死亡发生[12]。针对DCM 患者理想的治疗药物应该可以改善DCM 患者的葡萄糖代谢、心肌细胞内氧化应激和炎症,而不会引起任何不良反应。然而,长期使用常规的抗糖尿病药物进行治疗和预防会带来副作用并且对DCM 的缓解作用并不显著。世界卫生组织糖尿病专家委员会宣布,400 多种传统药物有作为DCM 替代疗法应用潜力[13]。良好的血糖控制是延缓或阻止糖尿病慢性并发症发生发展的重要措施[14]。本研究表明,SES 同MET 可显著降低糖尿病小鼠的血糖水平并可显著改善STZ 引起的心脏损伤。
炎症是DCM 的重要病理特征[15],高血糖和游离脂肪酸代谢增加与IL-6、TNF-α、单核细胞趋化蛋白-1 和核因子κB(NF-κB)等促炎细胞因子上调有关[16]。研究表明,SES 可通过减少心肌细胞凋亡和减轻炎症反应来改善心肌梗死引起的心功能障碍[17]。在本研究中,与DCM组相比,SES 治疗降低了CD45 和TNF-α 在心肌组织中的表达,表明SES 治疗减少了炎症细胞的浸润。SES 治疗降低了糖尿病小鼠心肌中TNF-α 等炎症因子mRNA 的水平,其抗炎作用与MET 治疗效果无显著差异。这些数据表明SES 在控制DCM 中减轻炎症方面有重要作用。
氧化应激增加与DCM 相关的生化和结构变化有着关键作用。SES 通过抑制氧化应激,对阿霉素诱导的急性肝肾毒性具有典型的保护作用[18]。SES通过抗氧化应激对STZ 诱导的胰腺细胞损伤具有保护作用[19]。此外,高糖高脂引起的心肌细胞损伤和凋亡可能与NADPH 氧化酶大量表达相关[20]。与这些结果相一致的是,SES 显著降低了STZ 诱导的脂质过氧化产物MDA 含量的上升,以及明显提升了SOD 活性。此外,SES 处理可降低由STZ 诱导的心肌ROS 的生成以及NADHP 氧化酶功能亚基的表达。本研究发现SES 可重建氧化及抗氧化平衡。
Sirt3 是线粒体中的一个重要的烟酰胺腺嘌呤二核苷酸(NAD)依赖的去乙酰化酶,能够调控线粒体中许多代谢酶的活性。Sirt3 在控制ROS 稳态中起关键作用。Sirt3 能够通过降低细胞ROS 水平来阻断心肌肥厚[21]。研究表明,线粒体sirtuin 家族参与了糖尿病患者的胰岛素抵抗[22]。Sirt3 可以预防甚至逆转糖尿病引起的视网膜、骨骼和心脏损伤[23-24]。SES 介导的Sirt3 上调通过抑制ROS 产生和下游信号通路阻断心脏重构反应[11]。与之前研究相一致[25],SES 和MET 上调Sirt3 的表达。为了探究Sirt3 是否在SES 对DCM 的保护作用中起着关键作用,本研究应用3-TYP 来抑制Sirt3 的表达。与期望符合的是,3-TYP 在细胞实验中的应用消除了SES 抗炎症、抗氧化应激和抗凋亡的保护作用,表现为SES 不能逆转相关蛋白的表达。
本研究证实了SES 在STZ 诱导的DCM 损伤中的治疗作用。SES 显著的降血糖作用、抗氧化应激以及抗炎等等多种生理作用均被证实。更重要的是,SES 主要通过上调Sirt3 的表达来发挥抗氧化应激、抗炎和抗凋亡的作用。本研究仍存在一定的局限性。SES 激活Sirt3 的机制需要进一步的探索发现。本研究通过使用Sirt3 的外源性抑制剂3-TYP,进一步证实SES 通过Sirt3-SOD2 依赖途径保护高糖诱导的心肌细胞损伤。总之,本研究结果为常见广泛植物预防和治疗DCM 提供有效证据,并且为DCM 治疗药物的研发提供了新思路。
利益冲突:所有作者均声明不存在利益冲突
