奶牛黏膜病的BVDV HJ-1 株全基因组序列分析
2021-10-05邵红张林雁夏立勇佟海山李旭阳周玉龙张旭
邵红,张林雁,夏立勇,佟海山,李旭阳,周玉龙,张旭
(1.黑龙江八一农垦大学动物科技学院,大庆 163319;2.黑龙江八一农垦大学人文学院;3.黑龙江省东宁市畜牧兽医服务总站;4.杜尔伯特蒙古族自治县畜牧技术服务中心)
牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)是牛病毒性腹泻/黏膜病的病原体。BVDV 属于黄病毒科(Flaviviridae)瘟病毒属(pestivirus)成员,基因组由大约12.3 kb 的单股正链RNA 组成。BVDV基因组是单个开放阅读框架(ORF),非翻译区(UTRs)位于基因组的两侧。基因组编码一个大的多肽,可进一步被细胞和病毒的蛋白酶切割成4 个结构性的和8 个非结构性蛋白,这些病毒粒子蛋白编码的顺序为NH2-Npro-capsid-Erns-E1-E2-p7-NS2-NS3-NS4a-NS4b-NS5a-NS5b-COOH[1-2]。根据不同的分型标准,BVDV 仅有一种血清型和两种生物型。基于5’-UTR、Npro和E2 基因分型结果,BVDV分离株被分成2 个主要基因型BVDV-1 和BVDV-2,以及新出现的HoBi-like 病毒,被称为BVDV-3[3-4]。BVDV基因组的易变异性导致其基因亚型众多,BVDV-1 被进一步分成18 个亚型1a-1u,BVDV-2 被分成3 个亚型2a-2c[5-8]。BVDV 全基因组序列蕴含大量的生物信息,是研究其致病机制和开发新型疫苗工作的前提。
BVDV 能够感染牛、鹿等多种反刍兽,引起的临床症状复杂多样,包括腹泻、黏膜糜烂溃疡、血小板减少症、繁殖障碍、免疫抑制以及持续感染等[9-12]。尤其是BVDV 引起的持续感染(PI)牛作为传染源也可以发展成黏膜病,给养牛业带来巨大经济损失。2010年黑龙江某奶牛场荷斯坦奶牛爆发黏膜病,病牛表现为严重腹泻、口腔、食道、胃肠道黏膜糜烂溃疡,以及全身内脏脏器官表现出血综合症病变,发病率20%病死率70%,自病死牛脾脏分离到BVDV HJ-1株,属于BVDV-1b 基因亚型,而且该病毒能够诱导MDBK 细胞发生自噬[13-15]。目前,已报道的全基因组序列的BVDV 毒株多来自于持续感染动物,对于引起黏膜病及出血性综合症高致病性BVDV 毒株基因组信息资源缺乏。因此,研究通过分段重叠PCR 扩增法获取BVDV HJ-1 株全基因组序列并进行生物信息学分析,探究BVDV HJ-1 株的遗传多样性,为BVDV 的诊断、疫苗研制和致病机理研究提供依据。
1 材料与方法
1.1 毒株、细胞和试剂
BVDV HJ-1 株和基因工程菌E.coli DH5α 为实验室保存[9]。MDBK 细胞购自中国科学院上海细胞库。Trizol Reagent、DMEM 培养基、胎牛血清和反转试剂盒均为Thermo Fisher Scientific 产品;DNA 胶回收试剂盒为Omega 产品;LA Taq DNA 聚合酶、dNTPs、pMD18-T载体和DNA Marker DL2000 均为TaKaRa 产品。
1.2 病毒的扩增
将分离株病毒BVDV HJ-1 接种于汇合度为70%的MDBK 细胞,37 ℃吸附1 h,间隔15 min 轻轻摇晃一次,加入维持液适量。37 ℃CO2培养箱培养,待60%~70%细胞发生病变时收毒,将病毒的细胞培养物反复冻融3 次以后,4 000 r·min-1,离心5 min,上清液-80 ℃保存。
1.3 引物的设计合成
参考BVDV-1b CP7 毒株全基因序列(GenBank 登录号U633479),经序列比对于保守区设计了13 对特异性的引物,相邻扩增片段间重叠不少于15 bp,见表1。引物由上海生工生物工程技术服务有限公司合成。
1.4 病毒RNA 制备及RT-PCR
应用制备的BVDV RNA 按照cDNA 合成试剂盒说明书进行反转录,获得cDNA 后进行PCR 反应,50 μL 体系:LA Taq Buffer 5 μL,2.5 mM 的dNTPs 5 μL,10 μM 的上下游引物各2 μL,cDNA 2.0 μL,LA Taq DNA 聚合酶(5 U·μL-1)0.2 μL,ddH2O 33.8 μL。PCR 反应条件:95 ℃5 min;94 ℃30 s,退火30 s,温度见表1,72 ℃120 s,35 个循环;72 ℃7 min。取5 μL PCR 产物电泳分析结果。
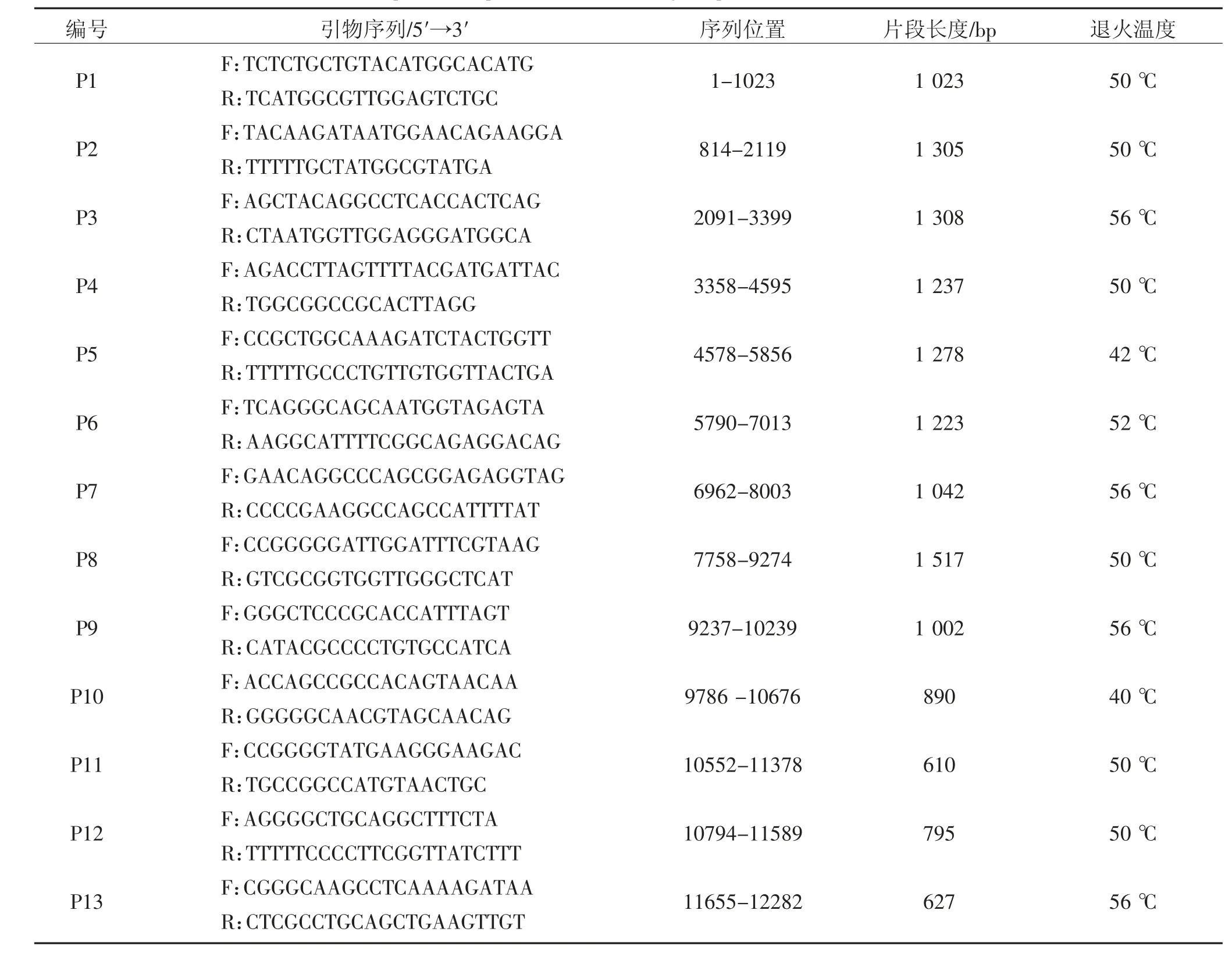
表1 BVDV HJ-1 株全基因扩增引物及退火温度Table 1 Amplification primers and annealing temperature of BVDV HJ-1 strain
1.5 目的基因克隆测序
按照Omega 胶回收试剂盒说明书纯化PCR 产物,按pMD18-T 载体说明书进行连接,转化大肠杆菌DH5α 感受态细胞,挑选经PCR 鉴定阳性重组菌3 株,委托北京六合华大基因科技有限公司测序。
1.6 生物信息分析
应用DNAMAN 分析软件对各测定片段进行拼接,获得BVDV HJ-1 株全基因组序列(GenBank 登录号KU756226.1)并进行基因分析。利用MEGA6.0软件制作进化树进行亲缘性分析。用DNA Star 进行全基因核苷酸序列分析,运用SWISS-MODEL 在线软件对测序所得到的BVDV HJ-1 株全基因进行氨基酸序列的结构预测;运用DNAStar MegAlign 分析软件进行核苷酸分析,并且建立进化树,同时进行同源性分析;运用RNA structure 软件分析分析5’UTR一级结构与二级结构的差异;运用DNAStar Protean分析软件分析各种氨基酸含量,并且运用ExPaXy 在线软件对测得的结构蛋白进行疏水性、柔性,以及跨膜区域的预测;使用CBS 网站NetNGlyc 1.0 在线分析软件对实验中测序所得到的结构蛋白片段进行糖基化位点分析。
2 结果与分析
2.1 BVDV HJ-1 全基因克隆测序
病毒的全基因的扩增与鉴定:用LA Taq DNA 聚合酶进行RT-PCR 克隆获得覆盖HJ-1 株全基因组并且相互重叠的13 条目的片段,分别为P1(1 023 bp)、P2(1 305 bp)、P3(1 308 bp)、P4(1 250 bp)、P5(1 278 bp)、P6(1 123 bp)、P7(1 042 bp)、P8(1 517 bp)、P9(1 000 bp)、P10(890 bp)、P11(610 bp)、P12(795 bp)、P13(627 bp)。各目的片段PCR 结果见图1,从各图可见PCR 结果获得的目的片段与预期的大小相符合,分别将各PCR 产物纯化后连接到p-MD18-T 载体进行测序。
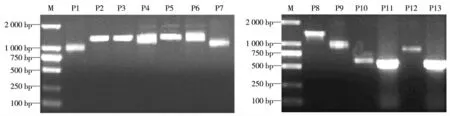
图1 覆盖HJ-1 全基因的13 个片段(P1-P13)的扩增结果Fig.1 13 Fragments covering the complete genome of BVDV(P1-P13)
2.2 BVDV HJ-1 全基组序列分析
把13 个BVDV HJ-1 基因组PCR 片段克隆重组菌送至上海生工生物公司测序,把侧学正确的基因序列使用Lasergene 分析软件进行组装出完整基因序列。经分析结果表明,BVDV HJ-1 株全基因长度为12 282 nt,共编码3 912 个氨基酸,其中5’UTR 长度为368 nt,编码区长11 736 nt,3’UTR 长度为178 nt,HJ-1 基因组的组成见表2,全基因核苷酸中含有31.9%A、25.6%G、22.3%U 和20.2%C。HJ-1 株全基因编码的氨基酸中亮氨酸(Leu)含量最高,具体见表3。

表2 BVDV HJ-1 株基因组的组成Table 2 The genomic constitution of the BVDV HJ-1 strain
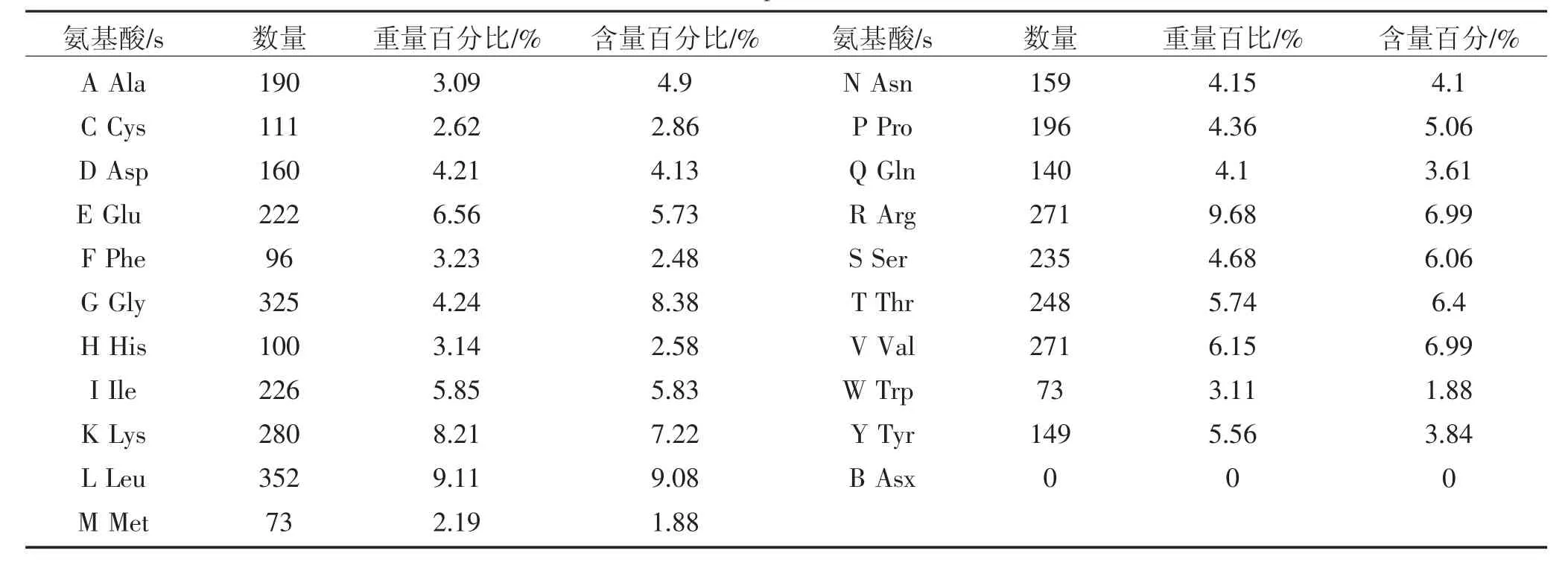
表3 HJ-1 株BVDV 编码氨基酸含量分析Table 3 Amino acid composition of BVDV HJ-1 Strain
2.3 BVDV HJ-1 株序列同源性分析
BVDV HJ-1 株的全基因组序列与13 株BVDV参考株进行序列比较,结果HJ-1 株与各参考毒株核苷酸同源性在70.1%~93.5%,其中与BVDV-1b 基因亚型的CP7 株的相似度最高达到93.5%;与NewYork93、Orengon24V、JZ05-1 和C413 株等差距较大,同源性仅为70.1%~75%,说明HJ-1 株属于BVDV-1b 基因亚型。具体结果见图2。
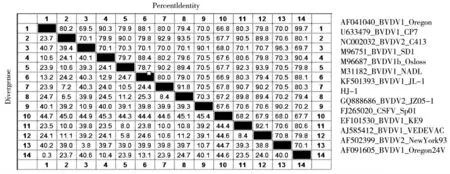
图2 HJ-1 株与GenBank 上病毒株全基因核苷酸同源性比较结果Fig.2 Result of sequence homology comparing the HJ-1 strains with whole genes from GenBank strains
BVDV HJ-1 株与参考株的各基因片段比较可见,5’UTR 核苷酸同源性为66.9%~96.9%,Npro 核苷酸同源性为70.8%~91.3%,C 核苷酸同源性为70.5%~93.3%,E0 核苷酸同源性为72.0%~93.0%,E1 核苷酸同源性为63.8%~88.5%,P7-NS2 核苷酸同源性为68.5%~91.3%,NS3 核苷酸同源性为75.6%~93.0%,NS4A 核苷酸同源性为49.0%~93.0%,NS4B 核苷酸同源性为49.2%~79.6%,NS5A 核苷酸同源性为66.0%~92.5%,NS5B 核苷酸同源性为71.6%~93.6%,3’UTR 核苷酸同源性为66.2%~95.5%。由表4 可见非结构蛋白相比结构蛋白变化大,并且E1 相对于E2 变异较大,非结构蛋白中NS3 与NS4A 相对稳定,整个基因比较5’UTR 和3’UTR 相对更稳定,5’UTR最稳定更为保守。

表4 HJ-1 株与参考株的核苷酸同源性比较(%)Table 4 Whole nucleotide sequence comparison of HJ-1 stains with other strains
2.4 BVDV HJ-1 株与参考毒株核苷酸序列进化分析
把HJ-1 株与其他12 株BVDV 及1 株CSFV 全基因核苷酸进行比对并绘制进化树,结果显示HJ-1株与CP7 株进化关系最密切,在同一进化分枝,同属于BVDV-1b 基因亚型,见图3。
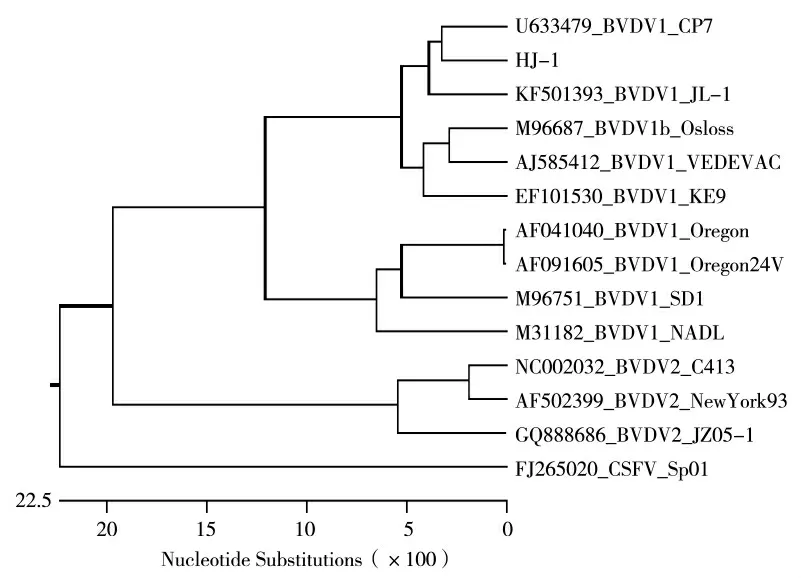
图3 BVDV HJ-1 株全基因系统进化分析Fig.3 Phylogenetic analysis of the whole gene of BVDV
2.5 BVDV HJ-1 株结构蛋白的生物学分析
BVDV HJ-1 株结构蛋白的氨基酸序列理化性质的分析:亲水性/疏水性是了解蛋白质性质的一个重要特征,HJ-1 株结构蛋白的亲水性/疏水性为间隔性分布,HJ-1 株结构蛋白主要由四个结构蛋白,共899个氨基酸组成,各蛋白的氨基酸位置如下:C 蛋白(1-103)、E0(104-330)、E1(331-525)E2(526-889)亲水区域主要在C 蛋白区域,疏水蛋白主要在E2 蛋白区域,见图4。结构蛋白E1-E2 二聚体的形成主要是由于跨膜区域富含带电荷的氨基酸残基,通过对氨基酸序列的分析可得到5 个潜在的跨膜信号区域,分别为95-110、390-410、480-510、645-660、870-892。其中3 个区域信号较好分别为95-110、480-510、870-892,形成跨膜螺旋结构区域,即其中1-94 区域位于膜内区域,在95-110 区域形成跨膜螺旋结构区域,然后进入膜内区域,在480-510 和870-892 区域形成跨膜螺旋结构区域,在893-899 区域又进入膜内,但是870-892 这一区域的跨膜信号起到主要的作用,见图5。

图4 BVDV HJ-1 株结构蛋白推导氨基酸序列的疏水性Fig.4 Hydrophobic property of BVDV HJ-1 structural protein

图5 BVDV HJ-1 株推导结构蛋白氨基酸序列跨膜性分析Fig.5 Transmembrane tendency of BVDV HJ-1 structural protein
BVDV HJ-1 株结构蛋白糖基化位点的分析发现:BVDV 结构蛋白上富含糖基化位点,共有14 个潜在的糖基化位点,见图6,其中E0 蛋白上8 个糖基化位点,E1 蛋白上2 个糖基化位点,E2 蛋白上4 个糖基化位点,主要的糖基化位点位于E0 和E2 蛋白上,经过与参考毒株的对比可见,BVDV1 型与BVDV2型结构蛋白的糖基化位点有两处不同,CSFV 结构蛋白的糖基化位点较少只有3 个,但是CFSV 在E2 蛋白上的711 位氨基酸糖基化位点与BVDV-1 型和BVDV-2 型相同,BVDV-2 型E0 蛋白相对BVDV-1型在168 位氨基酸上少了一个糖基化位点,BVDV-1型E2 蛋白相对BVDV-1 型在784 位氨基酸上少了一个糖基化位点,如表5 所示。

表5 HJ-1 株与参考毒株N-糖基化位点分析与比较Table 5 Potential N-linked glycosylation sites of HJ-1 in structural proteins among reference strains
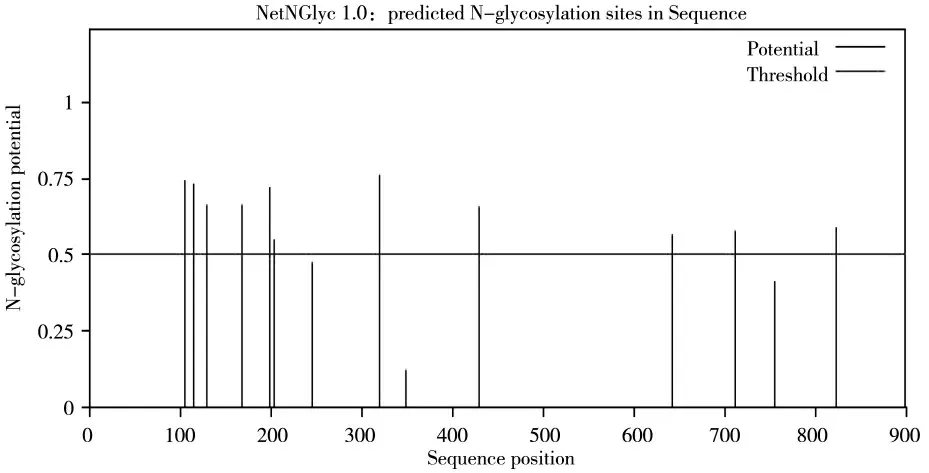
图6 BVDV HJ-1 株N-糖基化位点预测Fig.6 Predicted N-glycosylation sites of BVDV strain HJ-1
3 讨论
实验通过MDBK 细胞增殖BVDV HJ-1 分离株,通过观察细胞生长状况发现该毒株能够在MDBK 上稳定的生长,致使细胞产生典型的CPE,为一株CP型毒株。并通过PCR 成功分段扩增出覆盖全基因组的13 段基因序列,组装出完整的全序列,全长12 282个核苷酸。通过全基因组序列、5’UTR 和Npro序列分析其属于BVDV-1b 基因亚型。由于HJ-1 分离株基因组高度变异,PCR 扩增困难,经反复实验优化引物序列最终才成功获得目的基因。HJ-1 全基因组含有一个较大的开放阅读框(ORF),共有11 736 个核苷酸,可编码为3 912 个氨基酸,由于该病毒能引起细胞病变,可以成功的分化成12 个成熟的蛋白质[14,16]。
5’UTR 是BVDV 病毒完成复制以及基因组表达复制必须的,具有重要的初级结构和二级结构[16]。运用RNA structure 软件可以很容易的预测出二级结构,BVDV HJ-1 株的5’UTR,I 区和III b-III e 区相对比较保守,毒株之间II 区的二级结构差异明显,变异性较高。IRES 位于III b-III e 区,介导翻译的起始,含有至少3 个突变位点,点突变出现在不同的基因片段上,RNA 病毒的突变率高于DNA 病毒,一般突变率分别为10-3-10-4和10-8-10-11[17-18]。5’UTR 是负责翻译转录关键区域,回文结构的突变点可决定了基因的类型和分类[14,19]。HJ-1 株病毒在5’UTR 区与其他毒株差异显著,具有独特的二级结构,说明HJ-1株是一株独特的毒株,其生物学功能差异有待进一步研究。
N-糖基化位点的特征主要为Asn-X-Ser/Thr,结构蛋白在糖基化位点的修饰下能够完成正确的折叠,传导信号,抵消消化酶的作用,并且糖基化位点具有识别病毒抗原的功能[19]。通过糖基化位点的分析可得知HJ-1 株与BVDV-1b 型毒株CP7(能引起牛黏膜病)在糖基化位点上无较大差异,而与BVDV2型差异较大。实验中发现BVDV HJ-1 株与猪瘟病毒结构蛋白中有一个共同的糖基化位点,可能是BVDV与CSFV 具有共同抗原的原因。研究表明糖基化位点对于病毒的复制以及抗原识别等情况下可以起到重要的作用,糖基化位点是内质网α-葡萄苷酶阻断剂,具有抗BVDV 的能力,所以通过研究糖基化位点变化情况可以更深层次的研究BVDV 感染宿主的机制,为BVDV 未来防控计划提供理论基础[19-20]。
总之,完成BVDV HJ-1 株全基因测序丰富了国内BVDV 基因组信息,全基因序列中含有大量的信息,为构建反向遗传系统,研究病毒致病的分子机制、基因以及蛋白质的功能,BVDV 疫苗的研究奠定了基础。
