LAMA3在胰腺癌中的预后价值及机制的生物信息学分析
2021-10-04王维杰赵森峰曹家辉李冰洁
王维杰,赵森峰,2,曹家辉,2,李冰洁
(郑州大学第一附属医院,河南 郑州 450052,1.肝胆胰外五科,3.肿瘤科;2.郑州大学 医学科学院,河南 郑州 450052)
胰腺癌是恶性程度最高的消化道恶性肿瘤之一,具有手术切除率低、转移率高、复发率高以及对放化疗不敏感的特性,预后极差[1-2]。研究表明,LAMA3(Laminin subunit alpha 3)基因编码层粘连蛋白332(Laminin 332,LM-332)α亚基,在不同肿瘤中呈现不同的表达模式,低表达于胃癌、乳腺癌和前列腺癌等,但在肝癌、胰腺癌和鳞状细胞癌中呈现高表达[3-6]。越来越多的证据表明,LAMA3的异常表达和甲基化与癌症的发生和发展密切相关,具有重要的靶向研究价值和生物学标志物意义[7-9]。但是,LAMA3在胰腺癌中的信号通路和预后评估的相关研究鲜有报道,因此,本研究基于TCGA和GEO数据库,明确LAMA3在胰腺癌中的表达情况,分析其与胰腺癌临床病理特征的相关性及其在预后中的评价作用,通过基因富集分析(gene sets enrichment analysis,GSEA)进一步预测其在胰腺癌中的信号通路,为研究LAMA3在胰腺癌发生、发展中的作用机制提供新的理论基础。
1 资料和方法
1.1 数据采集与处理
本研究中所涉及的胰腺癌转录组数据和患者临床数据来自于肿瘤基因组图谱(the Cancer Genome Alas,TCGA)和基因表达综合(Gene Expression Omnibus,GEO)数据库,主要利用生物信息学的方法进行数据处理和统计分析。首先在TCGA数据库分析LAMA3的差异表达,继而采用Cox回归分析与临床病理特征的相关性,进而Kaplan-Meier分析与总生存期的关系。最后,在GEO数据库进一步验证LAMA3的差异表达和生存分析。
1.2 差异表达分析
采用limma R软件包进行Wilcoxon检测,探讨LAMA3在正常组织和肿瘤组织中的差异表达(|lgFC|>2且P<0.01)。本研究利用179例肿瘤组织和4例非肿瘤组织的LAMA3表达数据进行差异表达分析,同时利用4对肿瘤组织和癌旁组织的LAMA3表达数据进行配对差异表达分析。P<0.05认为差异有统计学意义。
1.3 单因素和多因素Cox回归分析
根据LAMA3 表达值的中位值,将患者分为高低两组,将临床数据和风险评分一起进行Cox分析,计算各临床特征的HR和95%CI,P<0.05认为差异有统计学意义。
1.4 预后评价与Kaplan-Meier生存分析
根据LAMA3 表达值的中位值,将患者分为高低两组。使用Survival R包绘制ROC曲线,同时计算AUC值,ROC曲线下的面积值在0~1之间。在AUC>0.5的情况下,AUC越接近于1,说明诊断效果越好。AUC在0.5~0.7时有较低准确性,AUC在0.7~0.9时有一定准确性,AUC在0.9以上时有较高准确性。使用Kaplan-Meier方法对LAMA3 高低表达组的生存期进行分组比较,统计学方法选用Log-rank。在P<0.05的情况下,不同分组的生存曲线离散度越高,表示LAMA3高低表达组的生存差异越大。
1.5 GSEA通路富集分析
从复杂调控网络的角度出发,通过GSEA的方法,基于京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)生物学通路数据库,对基因集合进行基于KEGG数据库的生物通路富集分析,从而提取出最相关的生物通路上的差异基因,更加有利于下游实验的开展。
2 结果
2.1 LAMA3在胰腺癌中的差异表达和配对分析
使用edgeR R包分别计算TCGA数据库中正常胰腺组织、癌旁和胰腺癌组织的差异表达,结果提示无论与正常组织还是癌旁组织相比,胰腺癌组织中LAMA3的表达均显著增高(P<0.05)(见图1A、B)。GEO数据库进一步验证差异表达分析,结果提示LAMA3在胰腺癌组织中的表达高于正常组织(P<0.05)(见图1C)。

图1 LAMA3在胰腺组织的表达情况
2.2 单因素和多因素Cox回归分析
将TCGA数据库胰腺癌的分级、淋巴结的侵犯转移情况、TNM分期及肿瘤的大小等临床性状与LAMA3 的表达情况进行单因素Cox回归分析,结果提示胰腺癌的淋巴结转移(HR2.26,P=0.003)和LAMA3 的表达(HR1.02,P=0.001)与预后生存相关(见表1)。进一步多因素Cox回归分析结果提示胰腺癌的淋巴结转移(HR1.91,P=0.024)和LAMA3的表达(HR1.02,P=0.003)与预后生存相关,表明LAMA3 是胰腺癌一个重要的独立预后因子(见图2)。

表1 应用单因素Cox回归分析TCGA数据中胰腺癌临床病理特征与总体生存期的关系

图2 多因素Cox回归分析TCGA数据中胰腺癌临床病理特征与总体生存期的关系
2.3 LAMA3高表达的预后评价
根据LAMA3 表达的中位数将患者分为高表达组和低表达组,5 年总生存率的ROC曲线下面积为0.711(见图3A),说明我们的模型可以很好地预测患者的生存情况。针对高表达组和低表达组的Kaplan-Meier生存分析显示,低表达组的总生存时间明显长于高表达组(P<0.01)(见图3B)。我们通过GEO数据集GSE21501 进一步验证LAMA3 高表达与胰腺癌的预后,结果与前一致(见图3C)。综上可见,LAMA3高表达是胰腺癌一个独立的不良预后因子。
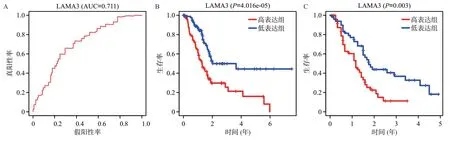
图3 LAMA3相关ROC曲线及生存曲线
2.4 GSEA通路富集分析
基于KEGG生物学通路数据库,对差异基因集合进行GSEA通路富集分析表明,p53信号通路、细胞周期、DNA复制、剪接体、蛋白酶体及氧化磷酸化在LAMA3高表达表型中富集;细胞因子-细胞因子受体相互作用和细胞黏附分子在LAMA3 低表达表型中富集,提示LAMA3高表达与胰腺癌细胞的增殖、侵袭和转移机制密切相关(见图4)。
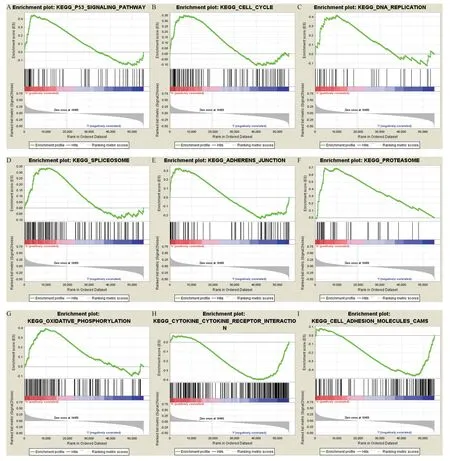
图4 GSEA通路富集分析
3 讨论
胰腺癌是消化道恶性程度最高的肿瘤,由于缺乏早期特异性的诊断标志物且肿瘤生物学行为进展迅速,确诊为胰腺癌的患者大部分已属晚期,常伴有早期转移和广泛的局部性扩散,仅20%的患者有外科手术根治性切除的机会,而接受系统性化疗的晚期患者的中位生存期也只有8个月左右,因此,胰腺癌的5年总生存率在4%~5%[10-11]。此外,针对胰腺癌最常用的肿瘤标志物是CA199,然而CA199在疾病早期并没有明显升高,其敏感性和特异性也仅为70%[12-13]。因此,深入研究胰腺癌进展的分子机制并挖掘新的具有高特异性和敏感性的生物标志物是改善胰腺癌患者生存预后的重要措施之一[14]。
LAMA3是层粘连蛋白家族主要成员LM-332的编码基因之一,研究发现,LAMA3在胃癌、乳腺癌、肝癌、胰腺癌等肿瘤中异常表达,对肿瘤的发生发展具有重要影响[3-6];另外,LM-332家族参与了胰腺癌、乳腺癌、结肠癌、胃癌和前列腺癌等恶性肿瘤的增殖、侵袭及转移,尤其与胰腺癌的不良预后密切相关[15-18]。然而,在胰腺癌中尚缺乏针对LAMA3的系统性分析和深度的机制挖掘。
本研究基于生物信息学技术,系统性地分析了LAMA3 在胰腺癌中的差异表达,并多方面评估其过表达对胰腺癌预后的诊断价值。分析结果表明,LAMA3 在胰腺癌组织中的表达显著高于正常和癌旁组织,过表达LAMA3 的胰腺癌患者总体生存期显著减少。进一步单因素和多因素的Cox回归分析证实,LAMA3 高表达可能是胰腺癌一个独立的不良预后因子。Yang等[19]对层粘连蛋白基因家族在胰腺癌中的表达进行了全面的生物信息学分析,发现LAMA3 在胰腺癌中显著高表达并与其不良预后密切相关,联合血清LAMC2和CA199水平可增加对早期胰腺癌患者的诊断效能。Kim等[20]联合LAMA3、E2F7、IFI44、SLC12A2和LRIG1这5个功能基因构建胰腺癌的预后模型,可有效改善胰腺癌的个体化治疗策略,有望成为胰腺癌潜在的新药物靶点。综上可见,LAMA3很可能是胰腺癌的一个独立预后因子,在胰腺癌的增殖、侵袭及转移过程中可能发挥着重要的调控作用。
此外,DNA甲基化和RNA可变剪接等表观遗传修饰可调控LAMA3的表达,在乳腺癌、胃癌、膀胱癌和卵巢癌等的研究中证实LAMA3发生甲基化,具有肿瘤早期诊断意义[21]。LM-332由LNα3、LNβ3和LNγ2链组成,LAMA3是LNα3亚基的编码基因。一方面,LNα3 链与其他多肽链组成层粘连蛋白,通过层粘连蛋白-受体互作活化黏着斑激酶,进而参与细胞信号传导;另一方面,LNα3 链的缺失使得细胞无法聚集半桥粒,层粘连蛋白连接不上细胞骨架,导致细胞的黏附性降低。研究表明,LAMA3在乳腺癌、胃癌和膀胱癌中低表达致使LM-332 无法合成,使得上皮细胞易于脱离细胞外基质,从而促进癌细胞的侵袭和转移[21-22]。然而,目前尚不清楚LAMA3在胰腺癌组织高表达的具体作用机制。我们基于KEGG生物学通路数据库,对差异基因集合进行GSEA通路富集分析表明,p53信号通路、细胞周期、DNA复制、剪接体、蛋白酶体及氧化磷酸化在LAMA3高表达表型中富集,而细胞因子-细胞因子受体相互作用和细胞黏附分子在LAMA3 低表达表型中富集,提示LAMA3在胰腺癌中过表达可能参与了癌细胞的增殖、侵袭和转移,值得进一步深入的研究和证实。
综上所述,LAMA3在胰腺癌中过表达可能是胰腺癌一个独立的不良预后因子。过表达的LAMA3可能参与了胰腺癌细胞的增殖、侵袭和转移机制的调控,有望成为胰腺癌诊治的新靶点和生物学标志物。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:王维杰负责课题设计、数据收集、资料分析、论文撰写;赵森峰、曹家辉参与论文修改;李冰洁指导课题设计、论文撰写及最后定稿。
