白光和红光光周期对西兰花芽苗菜生理生化和萝卜硫苷代谢的影响
2021-09-29赵西连肖军霞李晓丹郭丽萍
赵西连,庄 莉,肖军霞,2,李晓丹,2,郭丽萍,2,
(1.青岛农业大学食品科学与工程学院,山东青岛 266109;2.青岛特种食品研究院,山东青岛 266109)
西兰花为十字花科芸苔属,其芽苗菜富含抗坏血酸、花色苷、可溶性糖、可溶性蛋白、萝卜硫素、硫代葡萄糖苷等活性成分,具有极高的营养价值和保健作用。研究表明,西兰花芽苗菜具有降低血糖、抗癌、抗氧化、消炎、降低心血管疾病、调节机体免疫力等功能,受到国内外广泛关注,被认定为标准绿色产品[1−3],这主要是其中的萝卜硫素所起的作用。萝卜硫素在西兰花芽苗菜中以其前体物质萝卜硫苷的形式存在,细胞破碎后在黑芥子酶的作用下形成;因此,萝卜硫苷的含量对于萝卜硫素的形成至关重要。西兰花芽苗菜既可以作为蔬菜食用,也可以作为功能性食品的原料,虽然在我国应用还很少,但已引起研究者的重视。
光质和光周期是影响植物生长发育的基本因素之一,对植物的物质代谢、光合作用以及基因表达均有调控作用。通过应用节能环保的新型光源——发光二极管(light emitting diode,LED)调节光环境来提高芽苗菜产量及品质已成为研究热点[4]。刘文科等[5]以豌豆芽为试材,比较白光、蓝光、红光和红蓝光对豌豆苗营养成分的影响,发现白光处理下豌豆茎中花色苷积累最多,分别是红光、蓝光和红蓝光处理的1.42、3.35和1.81倍。Pérez-Balibrea等[6]研究表明,光照较黑暗下生长的西兰花芽苗菜总硫苷、总酚和抗坏血酸含量较黑暗分别高33%、61%和83%。张欢等[7]发现红光比白光、黄光、蓝光和红蓝光等更有利于萝卜芽苗菜的生长和营养品质的改善。邬奇等[8]研究了光周期对黄瓜和番茄幼苗生长的影响,发现随着光周期的延长,可溶性糖和可溶性蛋白含量逐渐增高,光周期16 h·d−1更利于促进黄瓜和番茄幼苗生长。但以上研究主要集中于不同光质对芽苗菜营养品质的影响,对于光周期调控芽苗菜品质研究较少,尤其对于西兰花芽苗菜的相关研究还未见报道。此外,LED红光处理下萝卜愈伤组织增殖倍数,萝卜硫素产量最高[9];而红光和蓝光对西兰花愈伤组织中萝卜硫素的积累效果强于白光[10],表明光质能够调控萝卜硫素的积累。目前,西兰花芽苗菜的研究主要集中于外源物质(如钙、ATP、糖、激素等)和环境(热激、低氧等)对其品质和萝卜硫素富集的影响[3,11−14]。关于白光和红光光周期对西兰花芽苗菜生理生化和萝卜硫苷的代谢还未见报道。
因此,本文以黑暗为对照,研究白光和红光光周期为4、8、12、16、20 h处理下4和7 d的西兰花芽苗菜的可溶性糖、可溶性蛋白、花色苷、抗坏血酸、硫代葡萄糖苷、黑芥子酶和萝卜硫素的含量变化,为LED光在西兰花芽苗菜工业化生产方面提供可靠的理论依据。
1 材料和方法
1.1 材料与仪器
西兰花种子 潍坊市寿禾种业公司;乙腈和甲醇 色谱纯,天津市科密欧化学试剂有限公司;DEAE Sephadex TMA25离子交换树脂、咪唑 北京索莱宝科技有限公司;二氯甲烷、牛血清白蛋白、考马斯亮蓝、草酸 国药集团上海化学试剂有限公司;烯丙基硫苷标准品、硫酸酯酶 美国Sigma 公司。
光照培养箱 上海高致精密仪器有限公司;UV-5100紫外可见分光光度计 上海元析仪器有限公司;Thermo Ultimate 3000高效液相色谱仪 美国赛默飞公司;HH-S2数显恒温水浴锅 金坛市医疗仪器厂。
1.2 实验方法
1.2.1 西兰花种子发芽方法 将西兰花种子用次氯酸钠消毒后冲洗至中性后,在30 ℃水浴锅中浸泡4 h。将浸泡后的种子均匀地平铺在装满蛭石的培养盘中,于25 ℃下黑暗催芽1 d后分别置于黑暗/光照(每天光照时间分别为4、8、12、16和20 h)的培养箱中进行培养,植株距离光源约50 cm,光照强度为50 μmol·m−2·s−1,每天喷洒去离子水两次,分别于4和7 d取样测定。
1.2.2 芽苗菜含水量的测定 从每个光周期的西兰花芽苗菜中随机摘取20棵芽苗菜为一个样本,称量鲜重后放在55 ℃烘箱中干燥至恒重,称量干重,计算芽苗含水量。
1.2.3 可溶性蛋白含量的测定 选用王学奎[15]的方法,称取0.2 g芽苗加入1 mL蒸馏水研磨成匀浆后,再加入4 mL蒸馏水冲洗研钵,全部转移至10 mL离心管内,10000 r/min离心5 min。取1 mL上清液后再加入5 mL G-250考马斯亮蓝溶液,室温下反应5 min,在595 nm波长下测吸光值。含量表示为mg/g 鲜重(FW)。
1.2.4 可溶性糖含量的测定 称取芽苗菜0.5 g加入1 mL蒸馏水研磨后倒入试管中,再加入14 mL蒸馏水持续煮沸20 min。冷却后进行过滤,取1 mL滤液加入6 mL蒸馏水稀释混匀。取1 mL提取液加入5 mL蒽酮溶液,沸水浴反应10 min,在620 nm波长处测吸光值。
1.2.5 花色苷含量的测定 参照于海鑫等[16]的方法测定。称取0.2 g芽苗,用4 mL酸化乙醇研磨提取,10000×g离心5 min后收集上清液,于535 nm处测定吸光值。花色苷含量按照下式计算。
花色苷含量(mg/100 g FW)=(A535×V)/(98.2×W)×100
式中:A535:535 nm处吸光值;V:定容体积,mL;98.2:花色苷在535 nm处的平均消光系数;W:样品质量,g。
1.2.6 维生素C含量的测定 根据王志英等[17]的方法测定。取0.3 g芽苗,用5 mL 2%的草酸研磨提取,匀浆于8000 r/min离心5 min,上清液过0.45 μm膜后进行HPLC测定。HPLC条件:色谱柱为Eclipse XDB-C18柱,检测波长为254 nm,流速为0.8 mL/min,柱温30 ℃,进样量20 μL。流动相:0.1%草酸:甲醇=95%:5%。
1.2.7 硫代葡萄糖苷含量的测定 参照Guo等[18]的方法测定。取500 mg西兰花芽苗,加入4 mL煮沸的75%甲醇于80 ℃下浸提15 min,于10000×g离心5 min,残渣继续浸提2次,上清液过DEAE Sephadex A-25柱;然后加入硫酸酯酶溶液于35 ℃下反应16 h后,用3 mL蒸馏水洗脱得到脱硫硫代葡萄糖苷,过0.45 μm膜后进行HPLC分析。
HPLC分析条件:色谱柱为Eclipse XDB-C18柱,流动相为超纯水和20%乙腈,先用水洗脱1 min;1~21 min,0~100%乙腈;21~26 min,100%~0乙腈;检测波长为226 nm,流速为1 mL/min,柱温30 ℃,进样量20 μL,以烯丙基硫苷作为内标。
1.2.8 黑芥子酶活性的测定 参照王志英等[17]的方法测定。取0.5 g西兰花芽苗,用3 mL 0.1 mol/L pH6.5磷酸盐缓冲液冰浴研磨,4 ℃下10000×g离心15 min,上清液即为粗酶液。取粗酶液0.5 mL与0.5 mL 1 mmol/L的烯丙基硫苷混合,于37 ℃水浴反应10 min后沸水灭酶5 min,用葡萄糖试剂盒测定葡萄糖含量。以每分钟被黑芥子酶转化生成1 nmol葡萄糖为一个酶活力单位,酶活力单位为U/mg FW。
1.2.9 萝卜硫素含量的测定 根据郭丽萍等[19]的方法。取0.5 g新鲜的西兰花芽苗菜,加4 mL蒸馏水研磨,水解3 h后加入4 mL二氯甲烷萃取,蒸干二氯甲烷相用2 mL体积分数10%乙腈溶解,进行HPLC分析。检测波长254 nm,紫外检测器,流速0.6 mL/min,柱温30 ℃。洗脱程序:0~20 min,10%~60%乙腈;20~25 min,60%~100%乙腈。
1.3 数据处理
实验设3次重复,结果采用SPSS18.0进行统计分析,Duncan’s新复极差法在0.05水平上进行显著性检验。采用Origin 2017软件作图。
2 结果与分析
2.1 白光和红光光周期对西兰花芽苗菜生理生化的影响
2.1.1 白光和红光光周期对西兰花芽苗菜芽长和含水量的影响 由图1A可以看出,与白光处理相比,红光处理促进西兰花芽苗菜芽长增长。光周期12 h·d−1时,4和7 d红光处理组西兰花芽苗菜芽长是白光的1.37和1.21倍。与黑暗相比,光照对西兰花芽苗菜生长有抑制作用。在光周期20 h·d−1时,4 d西兰花芽苗菜在白光和红光处理下芽长分别较黑暗降低32.7%和23.0%。张欢等[7]研究发现,随光周期从0延长至12 h·d−1油葵芽苗菜在红光处理下下胚轴长显著降低,与本研究结果一致。这现象可能主要是因为植物细胞感受到红光后,导致了植物体内光敏色素红光(Pr)构型和远红光(Pfr)构型的相互转化,从而影响植株细胞内的内源激素,加速了茎的细胞分裂和茎根伸长[20]。图1B结果表明,4 d时西兰花芽苗菜含水量随着光周期的延长先升高后降低后再升高,相较于红光,白光显著降低了西兰花芽苗菜的含水量(P<0.05)。光周期对7 d西兰花芽苗菜含水量影响不显著(P>0.05)。

图 1 白光和红光光周期对西兰花芽苗菜芽长(A)和含水量(B)的影响Fig.1 Effect of white and red light photoperiod on sprout length (A) and water content (B) in broccoli sprouts
2.1.2 白光和红光光周期对西兰花芽苗菜可溶性糖和可溶性蛋白含量的影响 由图2A可以看出,4 d西兰花芽苗菜中可溶性糖含量显著高于7 d(P<0.05),红光处理下西兰花芽苗菜中可溶性糖含量显著高于白光处理组(P<0.05),在光周期为16 h·d−1时含量最高,红光处理下4和7 d芽苗菜可溶性糖含量分别是白光的1.46和1.62倍;白光对7 d芽苗菜的可溶性糖含量无显著影响(P>0.05)。姜宗庆[21]研究发现,与白光和蓝光相比,红光更有利于提高香椿芽苗菜可溶性糖含量,本研究也发现红光处理相较白光处理下西兰花芽苗菜可溶性糖含量更高。由图2B知,红光和白光处理下可溶性蛋白含量变化趋势基本一致,均在光周期为16 h·d−1达到最高。光周期 为16 h·d−1时,红光和白光处理下4 d芽苗菜的可溶性蛋白含量分别是黑暗的1.69倍和1.55倍。7 d西兰花芽苗菜可溶性蛋白含量比4 d显著降低(P<0.05)。这是由于芽苗菜生长过程中可溶性蛋白和可溶性糖作为主要营养补充物质供给生长而被大量消耗,因此造成含量下降[22]。

图 2 白光和红光光周期对西兰花芽苗菜可溶性糖(A)和可溶性蛋白(B)含量的影响Fig.2 Effects of white and red light photoperiod on soluble sugar (A) and soluble protein contents (B) in broccoli sprouts
2.1.3 白光和红光光周期对西兰花芽苗菜花色苷的影响 白光和红光不同光周期下西兰花芽苗菜花色苷含量变化如图3所示。随着光周期的延长,红光处理下花色苷含量先增加后趋于稳定,白光处理下花色苷含量不断增加,白光处理下20 h·d−1时最高,4和7 d白光处理下西兰花芽苗菜花色苷含量分别是黑暗的9.74倍和6.34倍。当光周期大于4 h·d−1后,白光处理下西兰花芽苗菜花色苷含量显著高于红光(P<0.05),这与在荞麦芽苗菜和豌豆苗的研究结果一致[5,23]。研究表明,光照通过上调花色苷合成途径中相关基因表达实现了甘蓝芽苗菜中花色苷的积累[24],因此白光和红光提高西兰花芽苗菜中花色苷含量与花色苷合成途径中相关基因表达和酶活力有关。但是关于不同光质和光周期对花色苷富集的结果不同,其具体机制有待于进一步探究。

图 3 白光和红光光周期对西兰花芽苗菜花色苷含量的影响Fig.3 Effects of white and red light photoperiod on anthocyanin contents in broccoli sprouts
2.1.4 白光和红光光周期对西兰花芽苗菜抗坏血酸含量的影响 研究表明,光照较暗处理显著提高了西兰花芽苗菜中抗坏血酸含量[6]。本研究也得到了相似的结果,但白光和红光处理对西兰花芽苗菜中抗坏血酸含量的影响效果不同(图4)。红光不同光周期处理下,西兰花芽苗菜中抗坏血酸含量先增加后稳定,而白光处理下西兰花芽苗菜中抗坏血酸含量先增加后降低。张欢等[7]红光处理较黑暗也显著提高了油葵芽苗菜中抗坏血酸的含量,随着光周期的延长,抗坏血酸含量先增加后趋于稳定,与本研究结果一致。本研究中红光处理下抗坏血酸含量显著高于白光处理,刘素慧等[25]在香椿苗中研究结果一致。光周期16 h·d−1下,红光4和7 d西兰花芽苗菜抗坏血酸含量分别较黑暗提高了81.9%和78.5%;白光照射下,7 d西兰花芽苗菜抗坏血酸含量在光周期20 h·d−1最高,4 d在光周期16 h·d−1达到最高,4 d在光周期16 h·d−1比7 d光周期20 h含量高19.7%(图4)。红光处理下7 d西兰花芽苗菜抗坏血酸含量高于4 d,而白光处理下除光周期20 h·d−1外,4 d芽苗菜的抗坏血酸含量高于7 d。L-半乳糖酸-1,4-内酯脱氢酶是抗坏血酸合成过程中的关键酶[26],本研究中白光和红光对西兰花芽苗菜中抗坏血酸含量影响的不同可能与该酶对不同光的敏感性不同,因而导致基因表达和酶活力的差异。

图 4 白光和红光光周期对西兰花芽苗菜抗坏血酸含量的影响Fig.4 Effects of white and red photoperiod on ascorbic acid contents of broccoli sprouts
2.2 白光和红光光周期对西兰花芽苗菜萝卜硫苷代谢的影响
2.2.1 白光和红光光周期对西兰花芽苗菜硫代葡萄糖苷的影响 硫代葡萄糖苷是一类含硫、氮的亲水性阴离子植物次生代谢产物,是十字花科特有的成分。当细胞破碎时,硫代葡萄糖苷接触到黑芥子酶,生成异硫氰酸酯、硫氰酸酯和腈类等物质,其中异硫氰酸酯由于显著的抗癌功效受到广泛关注[27−28]。萝卜硫苷属于脂肪族硫苷,是西兰花芽苗菜中含量最高的硫代葡萄糖苷。如图5所示,白光和红光处理下,总硫代葡萄糖苷含量变化趋势和萝卜硫苷、脂肪族硫苷变化趋势基本一致。Moreira-Rodríguez等[29]研究发现,UV-B照射可以显著增加西兰花芽苗菜硫代葡萄糖苷的含量,本研究发现白光和红光处理也显著提高了西兰花芽苗菜中萝卜硫苷、脂肪族硫苷和总硫苷含量。红光处理后西兰花芽苗菜萝卜硫苷含量明显高于白光,光周期12 h·d−1时,红光处理下4和7 d萝卜硫苷含量分别是白光的1.18倍和1.14倍。红光处理下4和7 d芽苗菜中萝卜硫苷含量均在光周期16 h·d−1时最高,分别是黑暗的1.88倍和2.30倍。芽苗菜生长过程中伴随着萝卜硫苷的分解[28],因此7 d比4 d芽苗菜中萝卜硫苷含量减少。
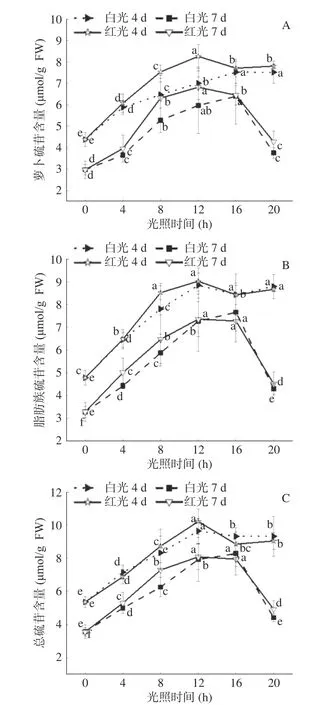
图 5 白光和红光光周期对西兰花芽苗菜萝卜硫苷(A)、脂肪族硫苷(B)和总硫苷含量(C)的影响Fig.5 Effects of white and red photoperiod light on sulforaphane (A), aliphatic sulforaphane (B) and total sulforaphane content (C) contents in broccoli sprouts
2.2.2 白光和红光光周期对西兰花芽苗菜黑芥子酶活力的影响 除萝卜硫苷含量外,黑芥子酶活力对于异硫氰酸酯的形成也非常重要。图6表明,4 d西兰花芽苗菜黑芥子酶活力明显高于7 d,4 d红光和白光处理均在光周期16 h·d−1时含量最高,分别是7 d的1.63倍和2.36倍。红光比白光处理下西兰花芽苗菜中黑芥子酶含量更高。Guo等[30]研究表明,在发芽后3~7 d时西兰花芽苗的黑芥子酶活力逐渐增强,而本研究中4 d芽苗菜的黑芥子酶活力高于7 d,原因可能是酶活表示的方法不同,本文用的是每克样品的活性,Guo等[30]用的是比活力。

图 6 白光和红光光周期对西兰花芽苗菜黑芥子酶活力的影响Fig.6 Effects of white and red photoperiod light on myrosinase activity in broccoli sprouts
2.2.3 白光和红光光周期对西兰花芽苗菜萝卜硫素形成的影响 萝卜硫素是萝卜硫苷在黑芥子酶的水解作用下形成的产物之一,是目前已发现的抗癌活性最强的天然活性物质,因此引起广泛关注[31]。萝卜硫素是西兰花异硫氰酸酯的一种,在种子及芽苗菜中占总挥发性物质的66.605%和64.399%[19]。如图7所示,在不同光周期处理下萝卜硫素的变化趋势与其底物萝卜硫苷的变化基本一致,都是先增加后降低。白光和红光处理下,萝卜硫素含量均在光周期16 h·d−1达到最高,分别比黑暗提高53%和61%;在光周期小于12 h·d−1时,红光处理下萝卜硫素形成量显著高于白光处理(P<0.05),而当光周期大于12 h·d−1时,红光处理下萝卜硫素形成与白光处理之间差异不显著甚至低于白光处理,这与不同光质和光周期处理下黑芥子酶活力变化有关。

图 7 白光和红光光周期对西兰花芽苗菜萝卜硫素含量的影响Fig.7 Effects of white and red photoperiod on sulforaphane contents in broccoli sprouts
3 结论
与黑暗相比,白光和红光处理能够明显提高西兰花芽苗菜的品质。与白光相比,红光处理明显促进西兰花芽苗菜的生长并提高可溶性糖、可溶性蛋白、抗坏血酸和萝卜硫苷含量,但花色苷含量相反。在光周期小于12 h时,红光处理下萝卜硫素形成量显著高于白光处理(P<0.05),而当光周期大于12 h·d−1时,红光处理下萝卜硫素形成与白光处理之间差异不显著甚至低于白光处理。综合考虑,红光光周期12 h·d−1更加有利于西兰花芽苗菜品质的提高,也更符合经济效益。本研究为LED光在西兰花芽苗菜的工业化生产提供技术支撑和理论基础;今后,将深入研究红光调控萝卜硫苷代谢的机制,为我国功能性芽苗菜类食品的产业化进一步提供科学依据。
