多组学筛选及验证lncRNA CCAT1通过调节miR-148b-3p和FGF9促进结直肠癌发生及发展机制研究
2021-09-29才层,郑超,毛睿
才 层,郑 超,毛 睿
新疆医科大学第一附属医院肿瘤中心,新疆 乌鲁木齐 830054
近年来,结直肠癌(colorectal cancer,CRC)已成为癌症死亡的主要原因之一,我国CRC的发病率和死亡率快速上升[1-3]。长链非编码RNA(long non-coding RNA,lncRNA)是长度超过200个核苷酸的非编码RNA,它与多种肿瘤发生关系密切,包括CRC[4]。研究显示,结直肠癌相关转录物1(colorectal cancer associated transcript 1,CCAT1)是一个2 628 bp的lncRNA,首次在CRC中被发现且其在CRC各病理阶段均有上调[5-6]。目前研究表明,CCAT1能够调控CRC细胞增殖和转移,但具体作用机制尚不明确,有待进一步研究[1]。
微小RNA(miRNA)是一种短链非编码RNA,通过与mRNA互补序列结合调控许多生物学过程,包括细胞分化及凋亡等[3,7-8]。研究表明,miRNA广泛参与CRC的发生、发展、预后和复发[1]。在已报道的miRNAs中,miR-148b已被证实在抑制CRC细胞增殖中发挥重要作用。因此,它被确定为肿瘤抑制因子[3]。而重组人成纤维细胞生长因子9(human fibroblast growth factor 9,FGF9)位于人染色体13q11~q12,其在胚胎发育、肿瘤发生和组织修复中发挥着重要作用[9-10]。尽管已有部分文献对这些分子的作用进行了报道,但其是否存在相互调控及其具体发挥作用的机制尚不明确。而且由于CRC所处位置的原因,在初期很难被发现和治愈。因此,充分阐明其发病机制,寻找早期CRC检测的生物标志物[4,11-12]是当前CRC预防和治疗的当务之急。
1 材料与方法
1.1 患者及组织标本选择的30例CRC组织及匹配的癌旁组织为2016年1月至2019年12月从新疆医科大学第一附属医院CRC外科手术中获得的标本。所有标本均经病理证实为CRC,术前均未进行局部或全身治疗。立即将所有组织放置到液氮中,置于-80 ℃下提取总RNA。该项目的设计和实施均已得到新疆医科大学第一附属医院医学伦理委员会的批准(批号:K202006-02),所有患者均签署知情同意书。
1.2 肿瘤基因组图谱(TCGA)分析应用R软件(Version 3.3.3)和Bioconductor软件包(impute、DeSeq2、limma)对9例CRC样本和9例正常样本进行差异表达基因(differentially expressed genes,DEGs)分析。首先,采用箱形图对微阵列数据进行质量检测。然后通过归一化法来消除并行实验误差。基于“impute”和“limma”软件包构建聚类分析图。其次,选择“lmFit”来处理数据。采用经验贝叶斯方法寻找显著差异。经Benjamini-Hochberg法校正P值,校正P<0.05和log2(FC)>2均认为差异有统计学意义。
1.3 DAVID和基因集富集分析(gene set enrichment analysis,GSEA)基于KEGG数据库进行GSEA分析。将所有归一化mRNA的表达数据上传到GSEA v3.0软件。采用默认加权富集统计量对数据进行1 000次处理,归一化P<0.05认为显著富集。其次,利用气泡图和脊图对数据进行可视化,描述不同通路的分布。
1.4 细胞培养人结直肠癌细胞株(HT-29、Caco-2、SW480和SW620)和正常人结直肠上皮细胞株NCM-460,以及人胚胎肾细胞株HEK-293T购自北纳生物(北京,中国)。细胞系NCM-460和HT29在McCoy’s 5A(Thermo Fisher Scientific,USA)中加入质量浓度为100 g/L的胎牛血清(FBS,Thermo Fisher Scientific)培养。将Caco-2培养于添加NaHCO31.5 g/L、丙酮酸钠0.11 g/L和质量浓度为200 g/L的胎牛血清的MEM培养基(GIBCO BRL,Grand Island,NY,USA)中。将添加质量浓度为100 g/L的胎牛血清的RPMI-1640培养基用于培养细胞系SW480和SW620。将HEK-293T细胞培养于含有4 mmol/L谷氨酰胺、丙酮酸钠和质量浓度为100 g/L的胎牛血清的高糖DMEM中。所有细胞系均在37 ℃、5% CO2的潮湿空气中培养。
1.5 细胞转染靶向CCAT1和FGF9的小干扰RNA(siRNA)购自Invitrogen公司(Carlsbad,CA,USA)。miR-148b-3p抑制剂和模拟物以及pcDNA3.1载体购自吉玛基因(上海,中国)。按照制造商的说明,用Lipofectamine 2000(美国卡尔斯巴德Invitrogen公司)将siRNA质粒转染到6孔板中的细胞系中。使用Lipofectamine 2000将miR-148b-3p模拟物及其抑制剂转染到细胞中。合成CCAT1序列,亚克隆到pcDNA3.1载体中。通过pcDNA-CCAT1转染,最终过表达CCAT1,并以空pcDNA载体作为对照。siRNA的序列如表1所示。
1.6 细胞增殖实验使用CCK-8试剂盒检测细胞增殖。根据制造商的规程,转染后的细胞以2×103/孔细胞浓度接种于96孔板。分别孵育24、48、72 h后,每孔加10 μl CCK-8溶液。然后37 ℃连续孵育2 h,450 nm处用酶标仪(美国BioRad 680型)测定吸光度值。
1.7 细胞迁移与侵袭实验在Transwell迁移实验中转染48 h后,3×104个细胞被电镀到无血清介质(8 μm孔径,微孔)。下腔加入含质量浓度为100 g/L的胎牛血清的培养基。孵育24 h后,将仍停留在上膜上的细胞取出。将有迁移并穿过膜的细胞用0.1%结晶紫溶液染色30 min,然后用IX71倒置显微镜(Olympus,Tokyo,Japan)在9个光学和视野范围内计数。实验是独立的,重复3次。
1.8 实时荧光定量PCR(qRT-PCR)所有的RNA均来自CRC组织和细胞。所有样品均采用PrimeScript RT-PCR试剂盒(Takara,中国)从1 μg总RNA中合成。使用SYBR Green PCR试剂盒(Takara,中国)顺利进行PCR。qRT-PCR采用ABI PRISM 7500序列检测系统(Applied Biosystems,USA)。当U6作为miRNA的内参基因,lncRNA的表达用GAPDH标准化。引物序列及扩增长度如表2所示。

表2 引物序列及扩增长度Tab 2 Primer sequence and amplification length
1.9 蛋白免疫印迹试验(Western blotting)将细胞用PBS稀释,加入蛋白酶抑制剂混合物(Sigma-Aldrich,St.Louis,MO,USA)的RIPA裂解缓冲液裂解。处理后的细胞在冰上孵育20 min。用10% SDS-PAGE分离上清液,然后电泳转移到PVDF膜(Millipore,北京,中国)。本研究严格遵守说明书,使用了针对FGF9(ab71395,1∶1 000,Abcam,Cambridge,MA,USA)和GAPDH(1∶1 000,Abcam,UK)的一抗。清洗膜,用抗兔二抗(ab6721,1∶2 000,Abcam)孵育,然后用增强化学发光(ECL,Thermo Scientific,USA)观察印迹。所有实验均独立重复3次。
1.10 双荧光素酶报告基因检测HEK-293t细胞在12-或24-孔板内转染200 ng空pmirGLO-NC pmir-GLO-CCAT1-wt(或pmir-GLO-FGF9-wt),或pmir-GLO-CCAT1-mut(或pmirGLO-FGF9-mut)(Sangon生物技术,中国上海)和2 ng pRL-TK(美国WI Promega,麦迪逊)和miR-148b-3p模拟物或抑制物经Lipofectamine 2000转染进入细胞。使用荧光素酶测定系统(Promega,Madison,WI,USA)检测荧光素酶的相对活性,独立转染重复3次。
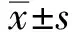
2 结果
2.1 CRC组织中CCAT1、miR-148b-3p及FGF9的表达情况为了确定lncRNA在CRC中的作用,我们利用TCGA数据集分析了9对CRC组织和相关的邻近正常组织。结果显示,401个lncRNA在癌组织与正常组织中的表达差异有统计学意义(P<0.05)。接下来,我们应用GSEA对TCGA数据集中的mRNA表达进行通路分析。如图1所示,结直肠组织中有许多通路被激活,如WNT信号通路、JAK/STAT信号通路和MAPK信号通路。其中,我们注意到不断有报道说明MAPK信号通路参与CRC的发生发展[13-14]。然后,我们利用芯片分析MAPK信号通路中不同表达的lncRNA和mRNA(见图2A)。在图2B中,我们发现了CRC中CCAT1/FGF9轴。此外,我们注意到miR-148b-3p既可以靶向CCAT1和FGF9,也可以在CRC组织中下调(见图2C~2D)。
2.2 lncRNA CCAT1在CRC组织和细胞中高表达
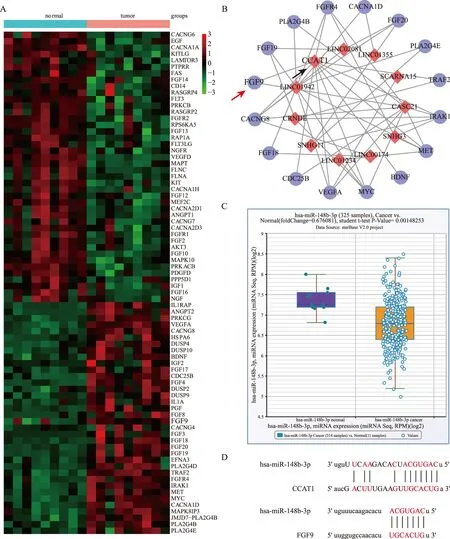
我们通过qRT-PCR检测了30对CRC组织及癌旁组织中CCAT1的表达。结果表明,CCAT1在CRC组织中表达显著上调(P<0.01,见图3A)。CRC中较高的CCAT1表达水平与肿瘤大小、AJCC分期呈正相关(P<0.05,见图3B~3C)。CCAT1在CRC细胞系中也有表达。如图3D所示,HT-29、Caco-2、SW480和SW620细胞中CCAT1的表达高于NCM-460细胞(P<0.01)。此外,为了评估CCAT1表达与CRC患者预后的相关性,使用TCGA数据库对患者术后生存期进行Kaplan-Meier生存分析。Kaplan-Meier生存曲线结果显示,CCAT1表达水平高的患者生存时间明显短于CCAT1表达水平较低的患者(见图3E)。这些结果表明,增加CCAT1表达对CRC的发展至关重要。
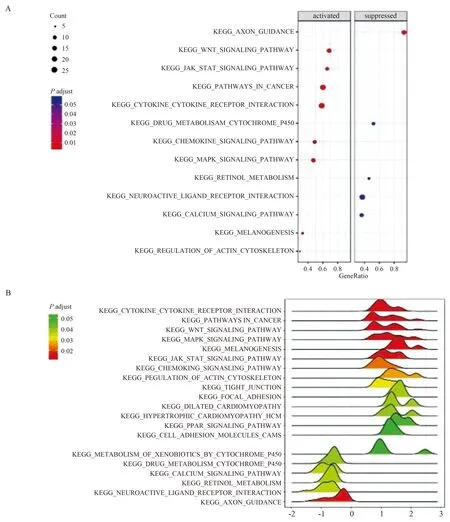
注:A:KEGG通路基因在CRC组织和正常组织中的分布情况;B:CRC发生过程中参与通路分布情况。
2.3 CCAT1表达上调可加速CRC细胞的增殖和迁移转染两种siRNA后,HT-29和SW480细胞中CCAT1表达下调(P<0.01,见图4A)。同时,通过pcDNA-CCAT1转染SW480和HT-29细胞使CCAT1过表达(P<0.01,见图4B)。为研究CCAT1是否直接调控CRC细胞增殖和侵袭,采用CCK-8法分析CRC细胞增殖情况,Transwell法分析迁移情况。结果显示,与对照组相比,上调CCAT1显著促进了HT-29和SW480细胞的增殖和迁移,下调CCAT1显著抑制了HT-29和SW480细胞的增殖和迁移(P<0.01,见图4C~4D)。上述结果表明,CCAT1具有促进CRC细胞增殖和迁移的作用。
2.4 CCAT1直接靶向miR-148b-3p并使其在CRC细胞中表达我们进一步使用Starbase 3.0数据库进行生物信息学分析(http://starbase.sysu.edu.cn),发现CCAT1与miR-148b-3p之间存在一个结合位点(见图2D)。采用qRT-PCR检测miR-148b-3p在正常组织及肿瘤标本中的表达水平。我们发现miR-148b-3p在CRC组织中下调(P<0.01,见图5A)。同时,CCAT1和miR-148b-3p在癌组织和正常组织中的表达呈负相关(R2=0.52,P=0.02;R2=0.44,P=0.04)(见图5B)。qRT-PCR检测miR-148b-3p在CRC细胞中的表达。结果显示,CRC细胞中miR-148b-3p的表达低于NCM-460细胞(P<0.01,见图5C)。双荧光素酶报告基因检测证实,CCAT1可以靶向miR-148b-3p(P<0.01,见图5D)。转染si-CCAT1导致miR-148b-3p表达增加,转染pcDNA3.1降低miR-148b-3p表达(P<0.01,见图5E)。同时,转染miR-148b-3p抑制剂可以抑制miR-148b-3p的表达,转染miR-148b-3p模拟物可以促进miR-148b-3p的表达(P<0.01,见图5F)。
注:A:MAPK信号通路中差异表达的基因;B:与MAPK信号通路有关的差异表达的lncRNA/mRNA的相互作用网络;C:从TCGA数据库获取miR-148b-3p在正常组织和肿瘤组织中的表达;D:miR-148b-3p与CCAT1和FGF9能结合位点的序列比对。
2.5 miR-148b-3p通过靶向FGF9的表达调控CRC的功能我们还检测了FGF9在CRC组织和细胞系中的表达。结果显示,FGF9在肿瘤组织中的表达高于癌旁组织(P<0.01,见图6A)。相关性分析显示,FGF9与miR-148b-3p在肿瘤及邻近组织中的表达呈负相关(见图6B)。在细胞系中,HT-29、Caco-2、SW480和SW620中FGF9的mRNA和蛋白表达均高于NCM-460(P<0.01,见图6C~6D)。双荧光素酶报告基因检测证实FGF9与miR-148b-3p存在靶向调控关系(P<0.01,见图6E)。分别用qRT-PCR和Western blotting检测转染后mRNA和蛋白的表达。我们的结果证实了siRNA可以在HT-29细胞和SW480细胞中抑制FGF9的表达。此外,siRNA1的效果比其他三种效果更好(P<0.01,见图6F~6G)。因此,siRNA1出现在后续的实验中。转染pcDNA3.1-CCAT1能促进FGF9的表达,转染miR-148b-3p抑制剂也能达到同样的效果。miR-148b-3p抑制剂和si-FGF9共转染逆转了这些作用(P<0.01,见图6H~6I)。以上结果表明,CRC细胞系中CCAT1通过miR-148b-3p途径调控FGF9的表达。
注:A:采用qRT-PCR方法检测30对CRC组织中CCAT1的表达,并与癌旁组织进行比较,**P<0.01;B:CCAT1在较大的肿瘤(肿瘤直径≥5 cm)中的表达情况,*P<0.05;C:CCAT1在不同临床分期中的表达情况,*P<0.05;D:采用qRT-PCR方法检测不同CRC细胞中CCAT1的表达情况,与NCM-460比较,**P<0.01;E:Kaplan-Meier分析检测差异表达CCAT1的生存率情况。
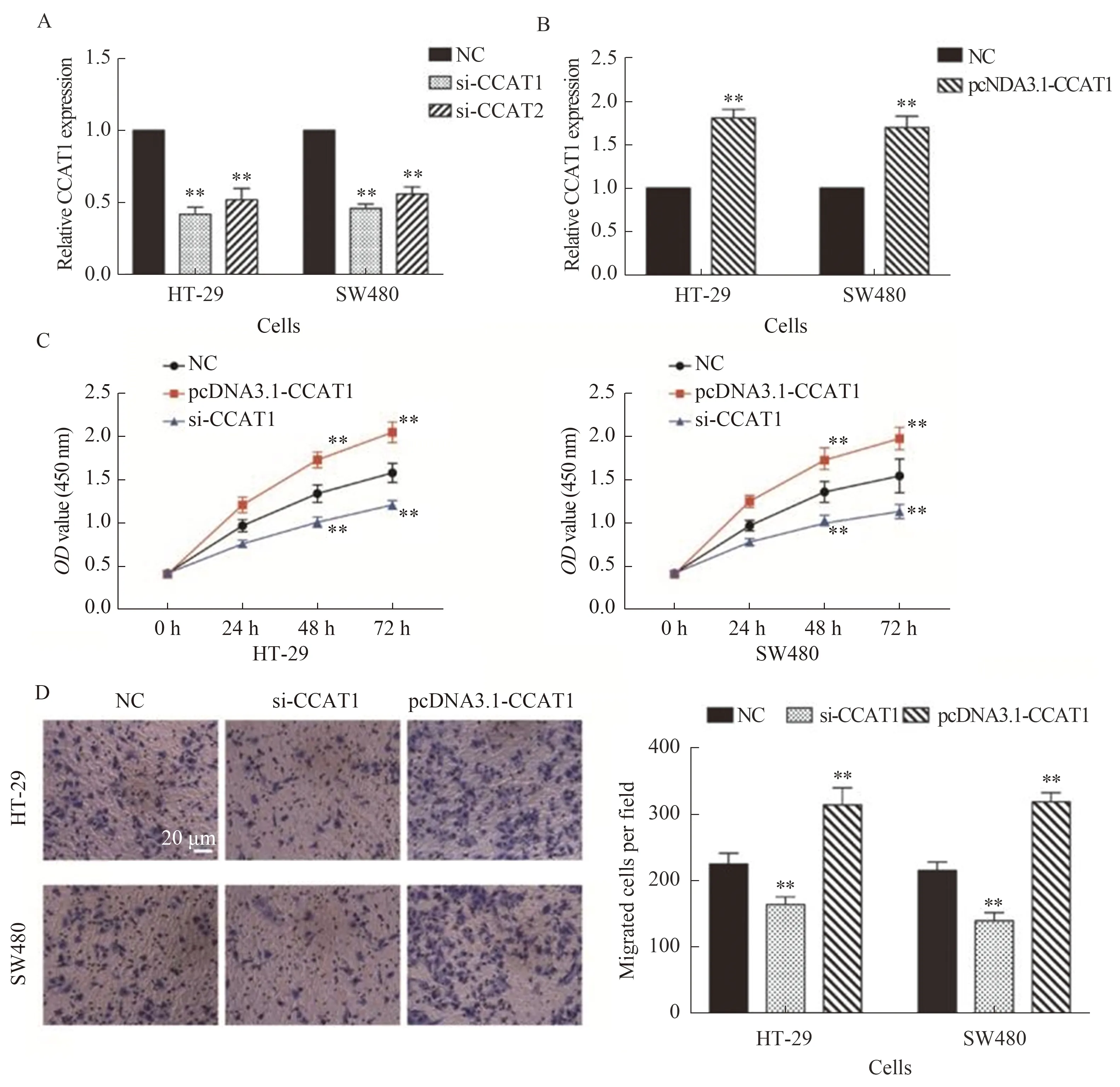
注:A~B:用qRT-PCR检测转染si-CCAT1、si-CCAT2(A)和pcDNA3.1-CCAT1(B)后CCAT1的表达,与NC组比较,**P<0.01;C:CCK-8法检测各组细胞增殖情况,与NC组比较,**P<0.01;D:Transwell法检测各组迁移能力(放大40倍)。与NC组比较,**P<0.01。
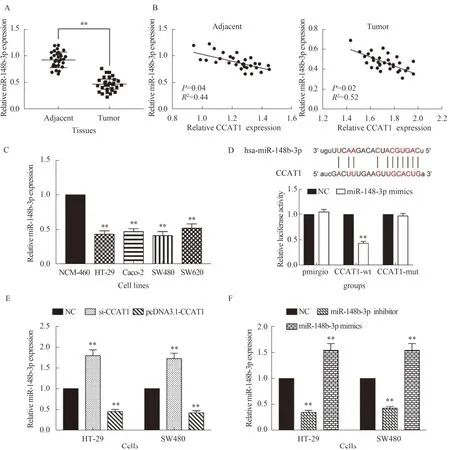
注:A:采用qRT-PCR方法检测30对CRC组织中miR-148b-3p的表达,与癌旁组织比较,**P<0.01;B:癌旁组织和肿瘤组织中CCAT1和miR-148b-3p的表达均呈负相关;C:采用qRT-PCR方法检测四种CRC细胞系中miR-148b-3p的表达。与NCM-460比较,**P<0.01;D:双荧光素酶报告检测CCAT1和miR-148b-3p的靶向情况;E:转染si-CCAT1和CCAT1过表达后miR-148b-3F的表达;F:转染miR-148b-3p抑制剂和miR-148b-3p模拟物后miR-148b-3p的表达。与NC组比较,**P<0.01。
2.6 抑制FGF9可抑制CRC细胞的增殖和迁移为了证实FGF9对CRC细胞系功能的影响,我们采用CCK-8法和Transwell迁移法检测转染miR-148b-3p模拟物、miR-148b-3p抑制剂、si-FGF9和miR-148b-3p抑制剂与si-FGF9后的变化。结果显示,过表达miR-148b-3p和抑制FGF9可抑制CRC细胞的增殖和迁移,而共转染miR-148b-3p可逆转这一作用(P<0.01,见图7)。综上所述,在CRC细胞系中,CCAT1通过抑制miR-148-3p的表达,进而促进FGF9的表达,促进细胞增殖和迁移。
3 讨论
目前研究表明,非编码RNA在癌症发生的分子机制中起着调节作用。已有研究表明,大量lncRNA在CRC组织和正常上皮组织中表达有差异。这些lncRNA通过调控其靶基因的表达,在调节肿瘤表型中发挥着重要作用[15-16]。在本研究中,我们通过生物信息学方法筛选并研究了lncRNA CCAT1的生物学功能,并发现某些因素可能参与了CCAT1在CRC中的调节。CCAT1是CRC异常表达的lncRNA之一,有报道称CCAT1在CRC组织中上调,与正常黏膜相比上调了235倍[17]。Alaiyan等认为,这种上调贯穿于疾病的所有阶段,包括晚期转移性疾病[18]。值得强调的是,Nissan等观察到CCAT1的表达主要在肿瘤发生的早期阶段显著[17]。这些证据表明,迫切需要通过探索新的治疗策略来预防CRC。在本研究中,CCAT1在CRC组织和细胞系中检测到上调,这与肿瘤较大、TNM分期较晚、总体生存期较短有关。在功能上,我们发现过表达和敲低CCAT1分别促进和抑制CRC细胞增殖和迁移。此外,我们进一步证明了CCAT1通过竞争性结合miR-148b-3p调控CRC中的FGF9产生致癌功能,这为CRC提供了一个新的可选择的治疗靶点。
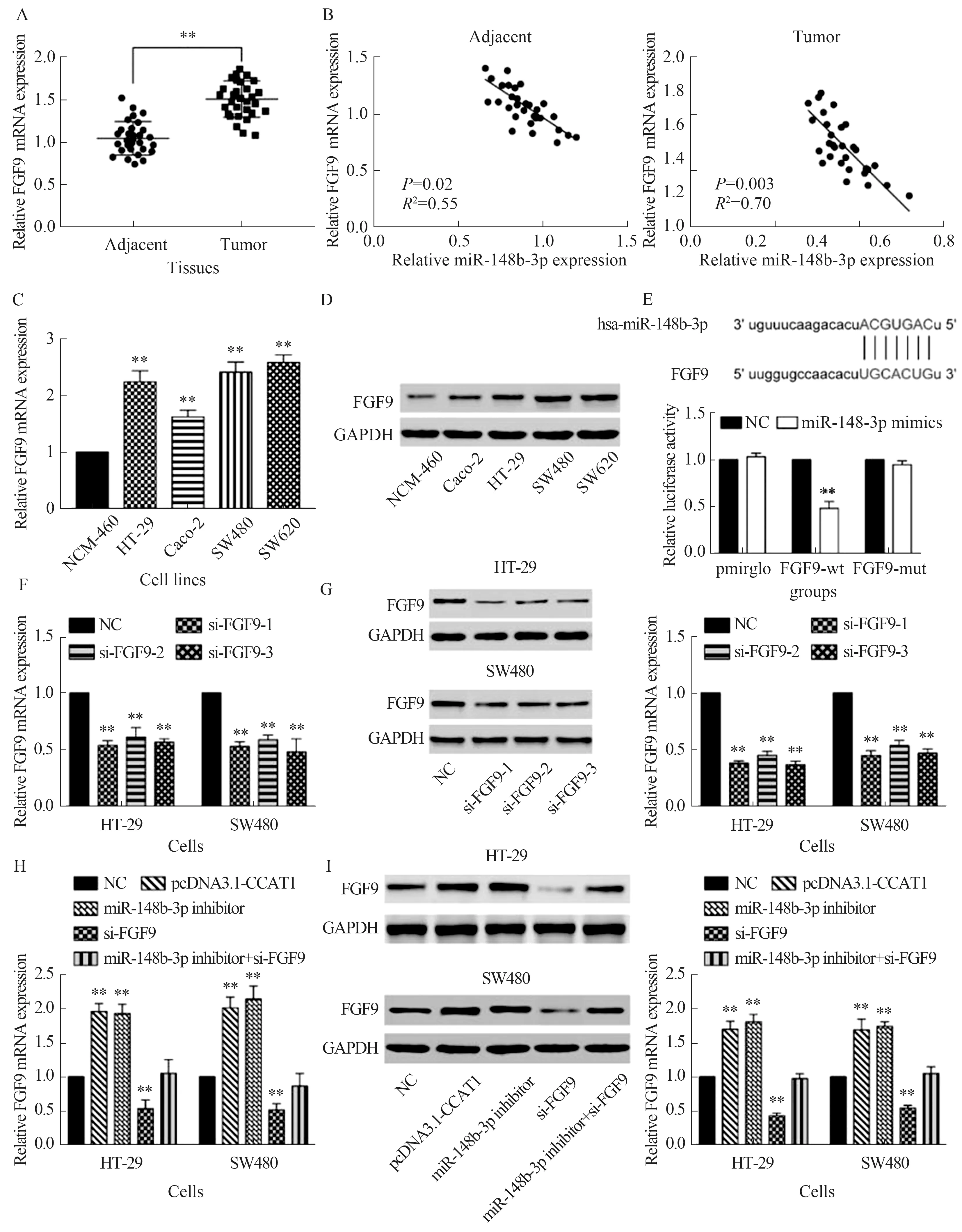
注:A:采用qRT-PCR方法检测30对CRC组织中FGF9的表达,与癌旁组织比较,**P<0.01;B:miR-148b-3p和FGF9在肿瘤组织和正常组织中的表达均呈负相关;C~D:用qRT-PCR(C)和Western blotting(D)检测FGF9在四种CRC细胞系中的表达,与NCM-460比较,**P<0.01;E:双荧光素酶报告基因检测miR-148b-3p与FGF9的靶向关系;F~G:通过qRT-PCR(F)和Western blotting(G)检测转染si-FGF9-1、si-FGF9-2和si-FGF9-3后FGF9的表达。与NC组比较,**P<0.01;H~I:qRT-PCR(H)和Western blotting(I)检测转染pcDNA3.1-CCAT1、miR-148b-3p抑制剂、si-FGF9及miR-148b-3p抑制剂和si-FGF9共转染后FGF9的表达。与NC组比较,**P<0.01。
大量研究表明,CCAT1在肿瘤进展过程中可以作为肿瘤启动子。已经证实,CCAT1可以作为竞争性内源性RNA,竞争性结合miRNA。如Li等发现了CCAT1在骨肉瘤中的致癌作用,并通过生物信息学分析和分子生物学实验预测了其与miR-148a的靶向关系[6]。同样,另有研究表明,CCAT1逆转miR-410的作用,促进CRC细胞增殖[11]。虽然已有大量miRNAs被证实参与CRC的发病机制,但miR-148b-3p通过CCAT1的功能仍未被探索[1]。在本研究中,我们使用Starbase 3.0(http://starbase.sysu.edu.cn)进行了生物信息学分析,发现miR-148b-3p具有CCAT1的结合位点。因此,该结果得到了双荧光素酶报告基因的验证。我们还发现miR-148b-3p在CRC组织中与CCAT1相比下调。我们的研究数据表明,CCAT1与miR-148b-3p的表达在癌组织和正常组织中均存在负相关。
由于FGF9在细胞增殖和存活过程中受到多种miRNA的调控,其激活与上游结合因子之间的关系值得关注。在已有的研究中,Wang等验证了miR-372-3p在喉癌鳞状细胞癌抑制中的潜在作用[19]。此外,另一项研究表明,miR-26a靶向FGF9抑制胃癌细胞的生长和转移[20]。在本研究中,CCAT1与FGF9之间的密切联系首次通过生物信息学研究得到证实。此外,miR-148b-3p可能是CCAT1和FGF9的潜在靶基因。我们检测到FGF9在CRC组织和细胞系中均高表达。通过功能缺失确认FGF9在CRC中的致癌作用,通过生物信息学分析和分子生物学实验发现miR-148b-3p是CCAT1的靶标,可以靶向FGF9。
然而,生物信息学分析的结果也预测了一个潜在的信号通路,这需要进一步的研究。另外,由于多方面的原因,我们未进行体内实验和临床试验,但这为我们进一步的研究提供了方向。此外,CCAT1的上游转录因子可能为进一步揭示CRC发生机制提供新的思路。
综上所述,人HT29、Caco-2、SW480和SW620细胞中检测到CCAT1、miR-148b-3p和FGF9之间的相互作用。我们的研究表明,lncRNA CCAT1具有通过调控miR-148b-3p和FGF9促进CRC进展的作用。因此,CCAT1/miR148b-3p/FGF9轴调控网络可能为CRC治疗提供一种潜在的、新颖的治疗策略。
