误诊为嗜酸性粒细胞性胃肠炎的Cronkhite-Canada综合征1例报道
2021-09-29刘自珍姚诚子
刘自珍,姚诚子,贺 娜,弥 曼
1.西安医学院,陕西 西安 710021;2.咸阳市中心医院全科医学科; 3.西安医学院第一附属医院消化内科
病例患者,男,60岁,以“间断腹泻5年余,加重伴乏力、腹胀半个月”之主诉收住入院。3个月前无明显诱因地出现大便次数增多,4~5次/d,为不成形黄色稀便,无黏液及脓血,无里急后重感,无黑便,无腹痛、腹胀,无反酸、恶心、呕吐、呕血,无胸闷、气短等,经外院“输液治疗(具体不详)”后有所缓解。半个月前以上症状再次发作,伴乏力、食欲不振、味觉异常、腹胀、偶有腹痛,口服“肠炎宁”后未见明显缓解,为进一步诊治遂来我院,门诊以“胃癌待查”收住。自发病以来,神志清,精神欠佳,食纳差,夜休差,小便如常,大便如上,近3个月体质量减轻4 kg。
既往史:5年前被诊断为嗜酸性粒细胞性胃肠炎(eosinophilic gastroenteritis,EG),电子胃镜(2015-8-11,见图1):胃Ca(1.borrmann Ⅳ? 2.淋巴瘤?);病理回报:(胃窦)慢性黏膜炎伴息肉样增生,内见少量浆细胞及嗜酸性粒细胞(eosinophils,EOS)浸润,间质水肿,黏液样变,部分细胞增生活跃。免疫组化:CK(部分+)、Vim(部分+)、EMA(部分+)、ALK(-)、S-100(-)、CD68(-)、MPO(-)、CD30(-)、LCA(-)。电子胃镜(2016-4-21,见图2):贲门左后壁黏膜结节状隆起,整个胃腔以胃角、胃窦、胃体后壁为主黏膜粗糙结节状隆起,表面充血呈樱红色,活检质软,整个胃腔蠕动差。幽门黏膜光滑,十二指肠球部后壁及降部黏膜散在结节样増生。电子肠镜(2016-4-26,见图3):回盲瓣、升结肠、横结肠、降结肠、乙状结肠见弥漫性粗糙结节样隆起,大小不一,表面充血呈樱桃色,部分表面糜烂,覆少许薄白苔,活检质软,以升结肠及横结肠分布较密集,降结肠及乙状结肠稍稀疏。给予泼尼松片(初始剂量40 mg,1次/d,每10 d减量5 mg,减至5 mg后维持)治疗后,症状缓解不显著。头孢他啶过敏史;吸烟20余年,约20支/d,饮酒30余年,4~5次/周、300 g/次;家族史:家族中无类似病者,否认家族性遗传病、传染病史。
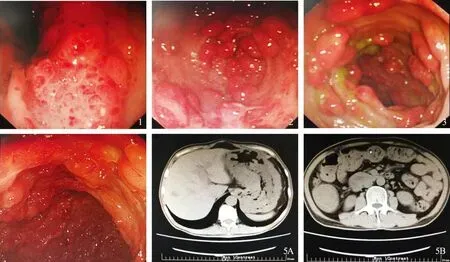
图1 (2015-8-11)胃镜:胃角;图2 (2016-4-21)胃镜:胃窦;图3 (2016-4-26)肠镜;图4 (2020-6-5)胃镜:胃体;图5 (2020-5-31)腹部CTFig 1 Gastroscope: gastric angle (2015-8-11); Fig 2 Gastroscope: gastric antrum (2016-4-21); Fig 3 Colonoscopy (2016-4-26); Fig 4 Gastroscope: gastric body (2020-6-5); Fig 5 Abdominal CT (2020-5-31)
体格检查:体温:36.0 ℃,脉搏:64次/min,呼吸:18次/min,血压:130/80 mmHg。发育正常,营养中等,表情自然。面部、双手皮肤黑褐色色素沉着,全身皮肤未见皮疹、黄染、出血点、瘀斑,无蜘蛛痣,无皮下气肿,双手指甲轻度增厚、色黄,全身浅表淋巴结未触及肿大。头颅大小正常,形态无畸形,左前额毛发稀疏,眼球活动自如,睑结膜无充血及苍白,巩膜无黄染,角膜无混浊,瞳孔等大等圆,对光反射及调节反应存在。双耳听力正常,外耳道无异常分泌物,乳突无压痛。鼻中隔无偏曲,各鼻副窦无压痛。唇红润,伸舌不偏,咽不红,扁桃体不大,颈软,气管居中,甲状腺不大,未见颈静脉怒张,颈动脉搏动无异常。胸廓对称无畸形,触觉语颤双侧对称,无增强或减弱,无胸膜摩擦感,叩诊音清,听诊呼吸音正常,未闻及干湿啰音,无胸膜摩擦音。心前区无隆起,心尖搏动未见异常,心浊音界无扩大,心率64次/min,律齐,各瓣膜听诊区未闻及病理性杂音。腹部平坦,可见片状色素沉着,未见异常蠕动波,腹壁柔软,无压痛、无反跳痛、肝脾肋下未触及,Murphy征阴性,全腹叩成鼓音,肝肾区无叩痛,移动性浊音阴性,肠鸣音3次/min。双下肢轻度凹陷性水肿。肛门及外生殖器未查,生理反射存在,病理反射未引出。
辅助检查:(1)实验室检查:血常规:WBC 12.55×109L-1,RBC 3.18×1012L-1,HB 89 g/L;粪便常规:OB(+);体液免疫八项示:C3 30.78 g/L,IgM 0.38 g/L,IgE 111 IU/L;血气示:K+3.2 mmol/L;细菌感染血清标志物示:IL-6 33.1 pg/ml;肝功示:TBA 59.2 μmol/L,TP 45.6 g/L,ALB 21 g/L,Ca 1.88 mmol/L;ESR 43 mm/h;贫血四项示:EPO 106.29 mIU/ml,FERR 4.9 ng/ml;一般细菌涂片检查(粪):革兰氏染色见G+短杆菌、G-短杆菌及G+链球菌。甲功、凝血四项、输血四项、乳酸脱氢酶同工酶、外周血细胞形态分析、抗中性粒细胞胞浆抗体、抗核抗体谱、风湿系列、尿常规等未见明显异常。
(2)内镜:胃镜提示(见图4):全胃弥漫分布大小不等结节样隆起,表面充血潮红。诊断:多发隆起性病变。病理检查:(胃窦)增生性息肉。肠镜:未行。
(3)影像学检查:胸部CT平扫示:(1)双肺散在肺大泡;(2)右肺中、下叶及左肺舌叶纤维灶伴渗岀;(3)右肺上叶及左肺下叶背段稍高密度模糊影,考虑渗岀可能,建议治疗后复査;(4)扫及肝内稍低密度影,建议必要时进一步检查。上、下腹部+盆腔CT平扫示:(1)肝脏及左肾低密度影,考虑囊性病变,建议增强检查;(2)门静脉增宽,请结合临床;(3)胃腔充盈欠佳,胃壁不均匀增厚(见图5A),升结肠肠壁局部增厚(见图5B),建议进一步检查;(4)左侧肾上腺结节影,建议进一步检查;(5)腹腔内及腹膜后多发淋巴结;(6)前列腺增生;(7)直肠下段壁稍显厚,请结合临床;(8)扫及双侧胸膜增厚。
根据病史、查体、辅助检查等综合考虑诊断为“Cronkhite- Canada综合征(CCS)”,给予泼尼松片(1 mg·kg-1·d-1),联合抑酸、保护胃黏膜、止泻、补充蛋白等对症支持治疗10 d后,腹泻症状较前好转,嘱定期减量,注意保暖,避免受凉,预防感染、出血等激素近期及远期并发症,加强营养支持,1个月后复查胃肠镜,目前一般情况可,仍在随访中。
讨论本例患者为老年男性,以“间断腹泻5年余,加重伴乏力、腹胀半个月”之主诉入院,入院检查表现为肠道细菌感染、贫血、低蛋白血症,低血钾、低血钙,给予输注白蛋白、纠正电解质紊乱、抗炎、补液、抑酸、调节肠道菌群等对症治疗后腹泻症状改善不明显。患者既往5年前曾首次出现腹泻,当地行胃镜病理结果回报提示:(胃窦)慢性黏膜炎伴息肉样增生,内见少量浆细胞及EOS浸润,可能为EG,服用激素后症状缓解不显著。于2016年再次复查胃镜,并行肠镜检查,提示胃肠广泛结节样改变,后在诊治中逐渐出现脱发,面部、双手皮肤黑褐色色素沉着,双手指甲轻度营养不良,食欲不振,味觉异常,腹胀、腹痛、反复腹泻,双下肢凹陷性水肿等,上述表现均符合CCS的典型临床表现,并结合低蛋白血症,轻度贫血,胃镜弥漫性结节样隆起、病理示增生性息肉,以及既往检查结果,排除以肠道多发息肉为主要表现的家族性遗传性疾病,如家族性腺瘤性息肉病(familial adenomatous polyposis,FAP)、Peutz-Jeghers综合征(Peutz-Jeghers syndrome,PJS)等后,考虑诊断为CCS。
CCS是一种极其罕见的以多发性胃肠息肉和外胚层改变为特征的疾病,主要表现为指(趾)甲营养不良、毛发脱落、皮肤色素沉着、腹泻、腹痛、食欲下降、味觉障碍、水肿、乏力和体质量减轻等[1-3]。本例患者与CCS典型的临床表现均符合。CCS于1955年首次由Cronkhite和Canada两位学者报道[4],国内首次报道于1985年,全球已报道超过500例病例[5],近年来,CCS的发病率有所上升,发病年龄26~85岁(平均年龄61岁)。CCS的病理生理学机制尚不清楚,目前,自身免疫过程被认为是CCS的主要病理生理因素[6]。常见的诱发因素是精神刺激、过度劳累或手术等[7-8]。在实验室检测中,超过88%的患者表现为低白蛋白血症(血清白蛋白<30 g/L),但很少表现出蛋白尿。临床表现提示低蛋白血症与肝肾功能障碍无关。其他可表现为非特异性的缺铁性贫血、低钙血症、低镁血症、低钾血症、粪便潜血阳性等[9-11]。
一项对24例CCS患者的内镜研究提示:弥漫性息肉或结节样病变累及胃和结肠(100%)、十二指肠(95.7%)、直肠(66.7%)及末段回肠(50.0%),所有患者均无食管受累。胃肠病变以胃体下部、胃窦部及右半结肠为著。镜下病变多表现为弥漫性黏膜充血水肿,伴息肉或结节样改变,病变严重处可有桑葚样改变[12]。息肉的组织学表现通常是非特异性的,表现为增生性息肉、幼年性息肉、炎性息肉、错构瘤性息肉、管状腺瘤性息肉等[13]。然而,由于很难区分癌前腺瘤和多发性炎性假息肉,CCS中的息肉是否具有恶性潜能一直存在争议。
由于其罕见,CCS的诊断与治疗标准尚未建立。有学者指出符合中老年起病、无遗传因素、典型胃肠道和外胚层改变的临床表现、内镜下表现及病理特征中至少4项,可考虑诊断CCS。该病需与其他胃肠道多发息肉病鉴别,比如:(1)FAP:一种由染色体5上腺瘤性结肠息肉(adenomatouspolyposis coli,APC)基因常染色体显性突变引起的息肉综合征,息肉多于青少年时期出现,其主要特征为患者结直肠存在大量腺瘤性息肉。这种综合征表现为受累者在早期成年期结肠和直肠内有许多腺瘤性息肉发育[14]。(2)幼年息肉综合征(juvenile polyp syndrome,JPS):是一种罕见的恶性多发性息肉病综合征,属于常染色体显性遗传疾病,其特征是沿着胃肠道存在多个幼年性息肉,并与胃肠道癌症以及结肠直肠癌风险增加有关。(3)PJS:是一种罕见的常染色体显性遗传疾病,又称“黑斑息肉病”,以面部、口唇及四肢末端的皮肤处色素斑沉着,胃肠道多发息肉、家族遗传性为主要特征[15],PJS和CCS均以皮肤色素、胃肠道息肉为主要表现,不同的是,PJS多有家族病史,多幼年发病,色素沉着多发于面部,息肉多发于小肠,尤其是空肠、回肠,其次为结肠、直肠、胃。本例患者为老年男性,无家族史,且除面部、双手皮肤黑褐色色素沉着,胃肠道弥漫增生性息肉外,还有双手指甲轻度营养不良、食欲不振、味觉异常、腹胀、腹痛、反复腹泻、双下肢凹陷性水肿等表现,故诊断不符合PJS。
服用类固醇并辅以营养支持治疗被认为是CCS主要的治疗方法,糖皮质激素作为首选药物,其治疗机制可能包括减少胃肠道炎症和抑制自身免疫反应。既往报道,组胺、H2受体拮抗剂、质子泵抑制剂、5-氨基水杨酸、抗生素、幽门螺杆菌根除等治疗也有较好的效果。CCS常见的并发症是营养不良、消化道出血、感染、恶性肿瘤等。早期的发现和适当的类固醇给药可以快速地改善临床症状和消退息肉,这可以带来更好的预后。在长期随访中,息肉病与CCS相关的癌症可能会复发,因此,建议定期内镜监测[16-17]。
EG是一种临床少见的炎症性疾病,表现为胃肠道内不同程度的EOS浸润,伴或不伴有外周血EOS增多。EG的表现取决于EOS浸润的程度,累及黏膜可表现为恶心、呕吐、腹痛、腹泻和体质量减轻;累及肌肉可表现为肠梗阻和穿孔;累及浆膜可表现为腹水和腹胀[18-19]。本例患者本次就诊之初,参考既往诊断的EG病史,此次慢性腹泻原因不除外EG复发、并发急性感染。行胃镜检查后,联系病理科阅片后高倍镜下未见EOS浸润,EG复发可能不大。回顾本例患者病史,本例患者既往5年前首次出现腹泻,胃镜病理结果回报提示:(胃窦)慢性黏膜炎伴息肉样增生,内见少量浆细胞及EOS浸润,故诊断为EG,并给予激素治疗,但效果不佳,后在治疗过程中出现一系列符合CCS的典型临床表现。EG的诊断依据于内镜下黏膜活检标本上的EOS浸润,伴或不伴外周血EOS增多,低蛋白血症,IgE水平升高,缺铁性贫血等。另外,CT扫描提示胃肠道壁不规则变窄、肠壁增厚和腹水有一定的参考意义。然而,本例患者在发病之初,除腹泻,与胃镜示胃窦慢性黏膜炎、息肉样增生,伴少量EOS浸润外,并无更多的依据支持EG的诊断,故EG的诊断并不成立,而在发病后,单用激素治疗后症状未见明显改善,提示诊断不明确,而后诊为CCS后,给予激素加抑酸、保护胃黏膜、止泻、补充蛋白等对症支持治疗后,症状有所好转。所以,这是1例被误诊为EG的CCS。
综上所述,CCS是病因不明的临床罕见病,且缺乏诊断标准与特异性的检查,与其他以胃肠道多发息肉为主要表现的疾病的甄别尤为重要。另外,应注意异病同治的存在,在排除其他相似疾病后,且单药治疗无效时,应考虑是否可能为CCS,并定期胃肠镜检,避免因误诊而延误治疗。
