酱香型白酒机械化制曲发酵细菌群落的演替
2021-09-28左乾程黄永光尤小龙程平言
左乾程,黄永光,*,郭 敏,胡 峰,尤小龙,程平言
(1.贵州大学酿酒与食品工程学院,贵州省发酵工程与生物制药重点实验室,贵州 贵阳 550025;2.贵州茅台酒厂(集团)习酒有限责任公司,贵州 习水 564600)
白酒是华夏民族上千年传承的传统民族特色饮料酒,其酿造工艺别具一格,酒体风味丰富而独特,在国际上美誉度高,与白兰地、威士忌、伏特加、朗姆酒、金酒并列为世界六大蒸馏酒[1]。中国白酒种类繁多,依据口感及风格差异可分为酱香型、浓香型、清香型、米香型、兼香型、芝麻香型、凤香型、特香型、豉香型、药香型、老白干香型[1]。其中以茅台为代表的酱香型白酒是中国白酒中酿造工艺最为复杂、最具特色以及最受消费者喜爱的白酒,其复杂的酿造工艺可概括为“高温制曲、高温堆积发酵、高温馏酒、长期贮存”等[2],高温制曲是酱香型白酒酿造工艺中最关键的环节,高温大曲的质量直接决定着酱香型白酒的产量及质量。
高温大曲是酱香型白酒酿造中的唯一糖化发酵剂,是利用纯小麦作为原料,添加母曲自然接种、培养而成,制曲过程曲胚发酵温度高达60~65 ℃,通过高温发酵、培菌实现制曲过程微生物的演替和酶的有效积累。传统的高温大曲制作主要采用人工操作,存在生产环境差、劳动强度大、生产成本高、生产效率低等缺点,加之由于人工踩曲的开放性,必然会受到操作因素的影响,使得大曲质量难以稳定。近年来,随着传统酿造技术的不断发展,高温大曲机械化制曲进程也在不断推进。高温大曲机械化制曲工艺如图1所示,通过模仿人工脚掌踩曲动作,采用独创气缸两阶段多次踩曲技术(仿生踩曲),代替了传统人工脚掌踩曲的操作,大大提高了高温大曲质量稳定性及生产效率,降低了劳动强度及生产成本。机械化制曲过程除采用仿生压曲机代替传统人工脚掌踩曲操作外,其他条件(如用曲及其比例、制曲原料、工艺操作及发酵参数控制等)皆与传统制曲一致,虽然机械化与传统人工踩出的曲在外观形状及松紧程度上并无明显差异,但机械化压制的曲块与传统人工踩制曲块在发酵过程是否在微生物的生长、微生物菌群结构的差异,以及机械化制曲与传统制曲发酵过程微生物群落演替有无差异,均成为机械化制曲能否代替传统人工制曲的关键问题。
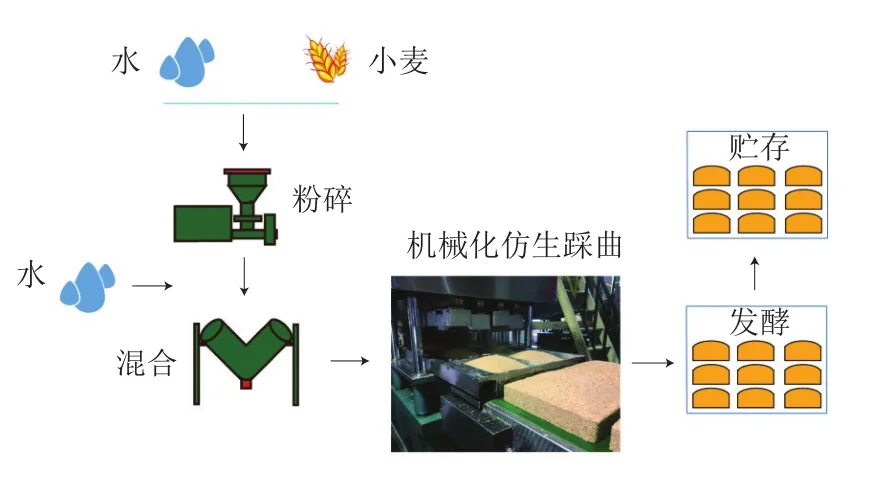
图1 机械化制曲工艺操作流程Fig.1 Flow chart for the mechanized production of high-temperature Daqu
众所周知,酱香型高温大曲与其他香型白酒酿造大曲的区别不只是制曲温度更高,更是曲块中微生物群落结构的独特性、酶类的丰富性及风味物质的复杂性。高温大曲的这些特性直接决定酱香白酒的产量和质量,而这些特性是由制曲过程的微生物群落结构及其演替所决定的。高温大曲发酵过程的微生物菌群结构包括酵母菌、细菌、霉菌及放线菌,其中细菌在白酒发酵过程中具有产酶及产香等功能,其代谢产生丰富的风味物质决定酱香型白酒的风格及品质[3-5],因此,系统解析高温大曲机械化制曲发酵过程细菌群落结构,对了解制曲过程发酵机理、调控大曲生产及提高大曲和白酒质量具有重要意义。目前已经对清香大曲[6]、兼香型大曲[7]发酵过程细菌群落结构进行了研究。对酱香型大曲传统制曲发酵过程细菌群落结构也进行了研究[8],但其机械化制曲发酵过程细菌群落结构以及其与传统制曲发酵过程细菌群落结构有何差别尚不清晰,在一定程度上制约了酱香型白酒机械化制曲的发展,因此,本研究采用高通量测序技术及数理统计分析,对高温大曲机械化制曲发酵过程细菌群落结构及其演替进行解析,并分析环境因子对大曲发酵过程细菌群落结构的调控作用,对了解机械化制曲过程发酵机理、调控机械化大曲生产具有重要意义,以期推动酱香型白酒机械化制曲产业的创新发展。
1 材料与方法
1.1 材料与试剂
样品采自贵州茅台集团XJ公司酱香机械化制曲车间,根据生产经验表明,大曲入房、第1次翻曲、第2次翻曲及大曲出房为发酵关键时间点及关键工艺控制点,因此,选取曲块入房(发酵0 d)、第1次翻曲(发酵7 d)、第2次翻曲(发酵14 d)、曲块出房(发酵40 d)为采样时间点;每个采样时间点采集曲房靠门、中间、靠窗的上、中、下三层大曲样品各500 g,进行粉碎后再充分混匀以消除取样误差,得到一个取样时间点的样品,采集完成后立即进行DNA提取及相关理化指标的测定。
DNA Marker 宝生物工程有限公司;磷酸盐缓冲液、引物合成 生工生物工程(上海)股份有限公司;E.Z.N.A.Soil DNA Kit 美国Omega BioTek公司;异丙醇(分析纯)、TAE缓冲液 北京索莱宝科技有限公司;琼脂糖 南京生兴生物技术有限公司;Goldview染料 上海赛百盛有限公司;rTaqDNA聚合酶试剂盒北京全式金生物技术有限公司。
1.2 仪器与设备
台式高速冷冻离心机、紫外分光光度计 美国Thermo Fisher Scientific公司;高压蒸汽灭菌锅 致徽(厦门)仪器有限公司;旋涡混合器 北京北方同正生物技术发展有限公司;数显恒温水浴锅 国华电器有限公司;电子天平 奥豪斯仪器(上海)有限公司;pH计德国Sartorius公司;聚合酶链式反应(polymerase chain reaction,PCR)仪 美国ABI公司;电泳仪 北京六一仪器厂;凝胶成像仪 上海培清科技有限公司。
1.3 方法
1.3.1 样品预处理及DNA提取[9-12]
分别称取1.1节各取样时间点采取的混合曲粉15 g于无菌离心管中,加入30 mL 0.1 mol/L无菌磷酸盐缓冲液及5 颗玻璃珠,涡旋振荡8 min,400 r/min离心6 min,收集上清液,用磷酸盐缓冲液洗涤沉淀,涡旋振荡6 min,400 r/min离心6 min,吸取上清液,继续用磷酸盐缓冲液洗涤沉淀,涡旋振荡4 min,400 r/min离心6 min,收集上清液。将3 次收集的上清液充分混匀后12 000 r/min离心5 min,弃去上清液,收集细胞沉淀。预处理完成后,参照E.Z.N.A.®Soil DNA Kit的操作说明书进行样品总DNA的提取。
1.3.2 PCR扩增及Illumina MiSeq测序
应用引物338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)扩增V3和V4高变区,引物两端带有12 个随机核苷酸碱基(Barcode)作为样品标签。PCR体系及反应条件参考黄蕴利等[13]的方法,并适当修改。PCR体系:10×Buffer 4 μL,dNTPs 2 μL,正反应物各0.8 mL,rTaqDNA聚合酶0.2 μL,ddH2O 12.2μL,共计20 μL反应体系。PCR条件:95 ℃预变性3 min;95 ℃变性30 s,53 ℃退火30 s,72 ℃延伸60 s,27 个循环;72 ℃再延伸10 min。凝胶电泳:1%琼脂糖凝胶,核酸染料(Gengreen),电压90 V,电泳时间40 min。高通量测序在上海美吉生物医药科技有限公司进行。
1.3.3 理化指标测定
大曲样品温度的测定:采样的同时将温度计插入取样点附近,保持1 min左右,待读数稳定后,记录温度计温度数据。水分、酸度的测定参照QB/T 4257—2011《酿酒大曲通用分析方法》[14]。
1.4 数据及图像处理
采用Microsoft Office Excel 2016进行数据计算,IBM SPSS Statistics进行显著性分析,R语言绘制群落柱形图及相关性热图。
2 结果与分析
2.1 α多样性分析
单个样品的微生物α多样性通常用Shannon指数和Chao1指数表征,Shannon指数一般代表微生物群落中物种的多少[15-16],Chao1指数一般用来估计微生物群落的丰富度[17]。如表1所示,机械化大曲发酵过程中细菌物种多样性与丰富度呈波动式变化,在大曲进入曲房至第1次翻曲阶段呈上升趋势,第1次翻曲至第2次翻曲阶段呈下降趋势,第2次翻曲到出曲房时出现缓慢上升。这种变化趋势主要与曲胚中的理化因子有关,在发酵前期(大曲入房到第1次翻曲阶段),曲培温度及水分适宜细菌生长,所以该阶段细菌物种多样性与丰富度增加,发酵中期(第1次翻曲至第2次翻曲之间),曲胚的平均温度较高,高温淘汰了部分不耐热细菌,致使细菌物种多样性与丰富度降低;第2次翻曲过后,曲胚温度较之前有所降低,部分细菌又重新在大曲上生长,使得细菌物种多样性与丰富度出现部分回升。

表1 样本细菌群落多样性指数Table 1 α-Diversity of bacterial community
2.2 机械化制曲发酵过程细菌群落结构分析
机械化制曲发酵过程中共检出9 个菌门,其中平均相对丰度大于1%的仅有Firmicutes、Proteobacteria、Actinobacteria及Cyanobacteria(图2)。大曲入房时,Firmicutes和Proteobacteria菌门在机械化大曲中占主导地位,平均相对丰度>20%。这与酱香高温大曲传统制曲发酵过程细菌群落结构一致[8],张双燕等[6]通过高通量测序分析北京清香大曲发酵过程也发现这2 个门为其主要细菌种群,李申奥[7]通过高通量测序分析北京清香兼香型大曲发酵过程同样发现这2 个门是主要细菌种群;同时,Firmicutes及Proteobacteria也是芝麻香型高温大曲[18]以及浓香型大曲[19]中的主要细菌种群,说明这些细菌是中国白酒大曲中的关键微生物。此外,图2表明,第1次翻曲之后,Firmicutes及Proteobacteria在机械化大曲中占主导地位(平均相对丰度>20%),且Firmicutes占有绝对优势,平均相对丰度为75.35%。第1次翻曲之后,机械化大曲中变成了Firmicutes占主导地位,相对丰度高达95.66%~97.79%。该结果与清香型大曲[6]、兼香型大曲[7]发酵过程微生物的研究结论一致,表明大曲发酵过程中,细菌门水平群落多样性降低,微生态结构由多菌系演替为单一的厚壁菌门为主导的发酵模式,是大曲发酵门水平微生态变化的规律性模式。
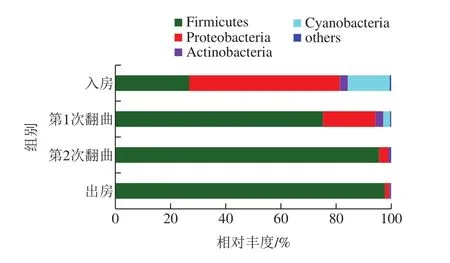
图2 大曲样品中的细菌群落结构(门水平)Fig.2 Bacterial community structure in Daqu samples at phylum level
机械化制曲发酵过程中共检出84 个细菌属,其中优势细菌属(至少在一个样品中相对丰度大于1%) 为14 个(图3),包括Pantoea、Rhizobium、Lactobacillus、Weissella、Bacillus、Oceanobacillus、Lentibacillus、Kroppenstedtia、Thermoactinomyces、Staphylococcus、Enterobacter、Saccharopolyspora、Pediococcus和Tepidimicrobium。大曲进入曲房(发酵0 d)时,大曲中Pantoea相对丰度最高(27.16%),其次是Rhizobium(21.66%)、Bacillus(10.33%)、Thermoactinomyces(4.78%)、Lentibacillus(4.25%)、Kroppenstedtia(3.27%)、Enterobacter(1.71%)及Staphylococcus(1.71%)。Pantoea、Lentibacillus及Kroppenstedtia均被检出于多种大曲中[3,5,7-8],但其在酿酒中的功能尚不清晰;Rhizobium被发现于小麦中,对小麦的生长具有促进作用[20],推测该菌属来源于制曲原料小麦,但其在酿酒中的功能尚未见报道。Bacillus是酱香型白酒发酵过程中主要的功能细菌种群,除了可以代谢淀粉酶、蛋白酶等多种水解酶外,还可代谢产乙偶姻、4-甲基吡嗪等风味物质[21-23],对酱香型白酒的风味品质具有重要贡献[24-25]。Staphylococcus常被发现于香肠、火腿等发酵食品中,可产生独特的风味[26]。第1次翻曲(发酵7 d)时,Pantoea、Lentibacillus及Kroppenstedtia平均相对丰度均下降至1%以下,推测该部分菌属不耐热或不耐酸,曲温及酸度升高导致这部分菌属相对丰度下降。而Bacillus、Lactobacillus、Weissella平均相对丰度上升,其中Bacillus平均相对丰度最高(40.76%),Lactobacillus、Weissella可代谢产生乳酸、乙酸等有机酸类物质,是造成大曲发酵前7 d酸度显著升高的主要原因。大曲中酸度升高一方面可以抑制不耐酸杂菌的生长繁殖,另一方面乳酸、乙酸等物质也为白酒中风味物质的合成提供前体[27-28]。此外,大曲在高温阶段维持一段时间,一方面可以淘汰不耐高温、不耐酸的杂菌,另一方面也为酱香型白酒高温发酵筛选功能微生物。随着发酵的进行,到第2次翻曲(发酵14 d)时,Lactobacillus和Weissella平均相对丰度下降至低于1%,是造成发酵后期酸度下降的主要原因。Bacillus平均丰度也降低至11.07%,而Lentibacillus、Pediococcus及Oceanobacillus平均相对丰度显著升高,均超过或接近10%。大曲出房(发酵40 d)时,Lentibacillus平均相对丰度最高(39.53%),其次为Staphylococcus(18.24%)、Kroppenstedtia(15.58%)、Bacillus(15.53%)、Oceanobacillus(4.70%)及Rhizobium(1.19%)。
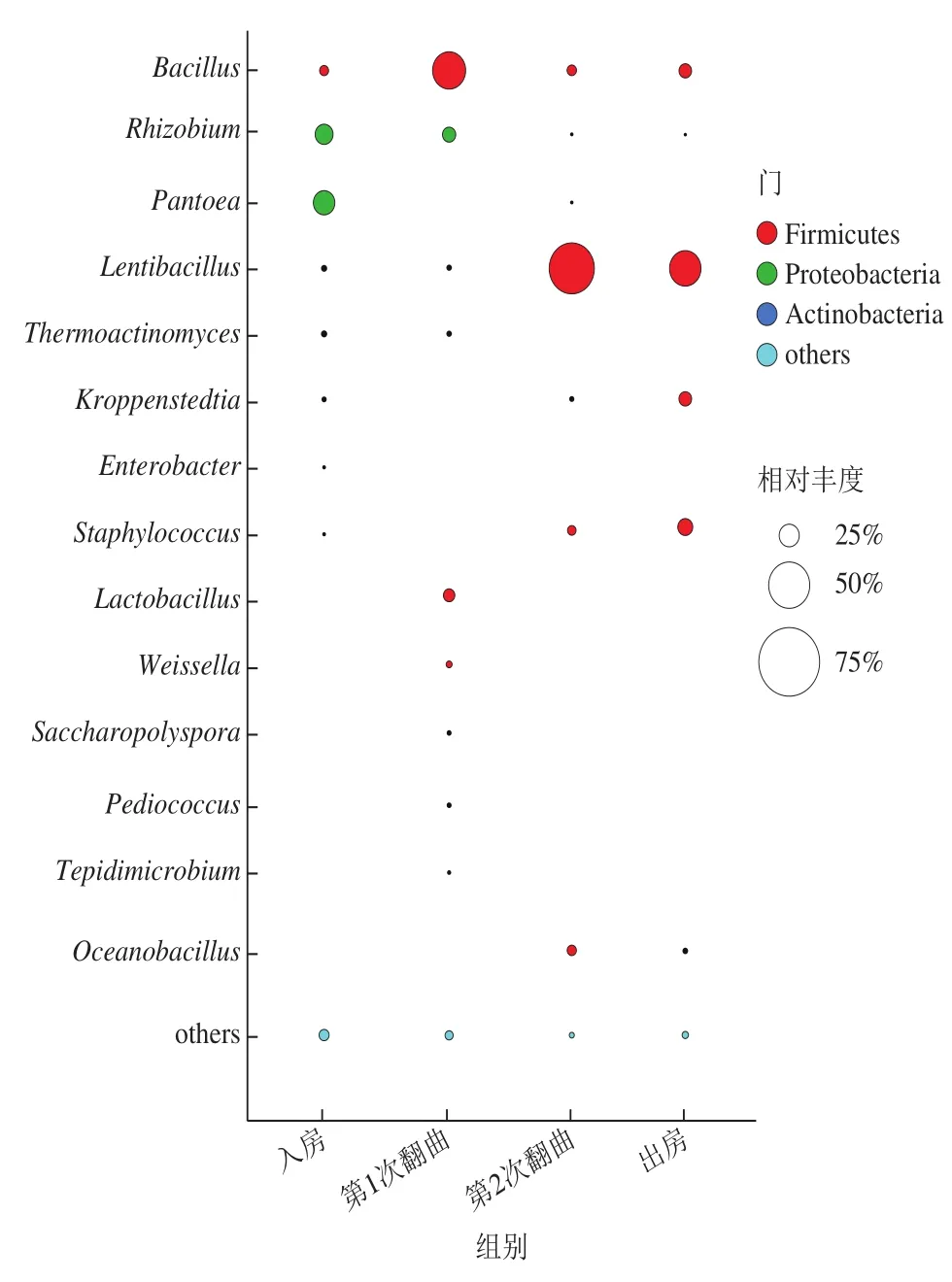
图3 大曲样品中的细菌群落结构(属水平)Fig.3 Bacterial community structure in Daqu samples at genus level
大曲入房(0 d)时,大曲块中Pantoea、Rhizobium及Bacillus为主要优势菌属(平均相对丰度>10%)。第1次翻曲(7 d)时,大曲块中主要优势菌属为Bacillus、Rhizobium及Lactobacillus,平均相对丰度>10%。第2次翻曲(14 d)时,大曲块中Lentibacillus、Oceanobacillus及Bacillus为主要优势菌属,平均相对丰度>10%。大曲块出房(40 d)时,大曲块中Lentibacillus、Staphylococcus、Kroppenstedtia及Bacillus菌属平均相对丰度大于10%,是主要优势菌属。其中,Bacillus在整个发酵过程中平均相对丰度都大于10%,是机械化制曲整个发酵过程中的主要优势菌。同时,Pantoea、Rhizobium、Bacillus、Rhizobium、Lactobacillus、Lentibacillus、Oceanobacillus、Staphylococcus、Kroppenstedtia也是酱香型白酒发酵过程中的主要优势菌[29-31],表明这些菌属在制曲与制酒过程存在明显的菌群迁徙,生态结构演替。
2.3 机械化制曲与传统制曲发酵过程细菌群落结构对比分析
郭敏[8]采用高通量测序对酱香型白酒传统制曲发酵过程细菌群落结构进行研究,共检出82 个细菌属,稍低于机械化制曲发酵过程的84 个细菌属,如图4a所示,其中有75 个细菌属为传统制曲和机械化制曲发酵过程共有细菌属,占传统制曲发酵过程总细菌属数的91.46%,表明机械化制曲与传统制曲发酵过程细菌群落结构差别不大。此外,传统制曲发酵过程的优势细菌属(至少在一个样品中相对丰度大于1%)也是14 个,包括Pantoea、Rhizobium、Lactobacillus、Weissella、Bacillus、Oceanobacillus、Lentibacillus、Kroppenstedtia、Thermoactinomyces、Staphylococcus、Enterobacter、Saccharopolyspora、Leuconostoc和Pseudomonas,其中Pantoea(机械化制曲中平均相对丰度为6.92%,传统曲为7.04%,下述皆为平均相对丰度)、Rhizobium(机械化制曲为10.14%,传统曲为10.02%)、Lactobacillus(机械化制曲为1.76%,传统曲为1.59%)、Weissella(机械化制曲为3.94%,传统曲为3.76%)、Bacillus(机械化制曲为19.10%,传统曲为17.67%)、Oceanobacillus(机械化制曲为3.78%,传统曲为2.74%)、Lentibacillus(机械化制曲为25.14%,传统曲为27.25%)、Kroppenstedtia(机械化制曲为5.69%,传统曲为5.31%)、Thermoactinomyces(机械化制曲为3.94%,传统曲为3.76%)、Staphylococcus(机械化制曲为7.36%,传统曲为6.91%)、Enterobacter(机械化制曲为0.43%,传统曲为0.56%)、Saccharopolyspora(机械化制曲为1.01%,传统曲为1.28%)12 个细菌属为机械化制曲与传统制曲发酵过程共有优势菌(图4b),占传统制曲与机械化制曲发酵过程优势细菌属的85.71%,且这些优势菌属在两种曲醅发酵过程中平均相对丰度较为接近,相差不大;表明机械化制曲与传统制曲过程优势菌具有较高的相似性。与传统制曲发酵过程相比,Pediococcus和Tepidimicrobium是机械制曲发酵过程特有的优势细菌属,但其在酿酒过程中的功能尚不清晰(本课题组正在开展相关研究);而Leuconostoc及Pseudomonas是传统制曲过程特有的优势细菌属,这两种菌属在酿酒中的功能尚不清晰(本课题组正在开展相关研究)。因此,目前的研究结果表明酱香型白酒高温大曲机械化制曲发酵过程细菌群落结构与传统制曲过程具有很高的相似性,表明从发酵细菌群落结构上来说高温大曲机械化制曲可以代替人工制曲,且与传统制曲相比,机械化制曲不仅在很大程度上提高了大曲质量稳定性及生产效率,大幅降低劳动强度及生产成本,还能避免工人在为恶劣的环境下操作,对推动酱香型白酒行业的机械化与现代化发展具有促进作用。

图4 机械制曲与传统制曲发酵细菌群落结构对比Fig.4 Comparison of the structure of bacterial community between mechanical and traditional Daqu-making processes
2.4 环境因子对机械化曲胚中细菌生态结构多样性的影响
环境因子对微生物的生命及其行为具有较强的影响,进而调控微生物在大曲发酵过程中的群落结构及演替。如图5a所示,冗余分析(redundancy analysis,RDA)结果显示大曲温度、水分及酸度对微生物细菌群落结构有重要影响,第1次翻曲时,细菌群落结构主要受温度及水分影响,呈正相关,表明此时的曲醅温度及水分比较适合大曲中细菌生长,第2次翻曲至出房时,大曲中细菌群落结构基本不受温度、水分及酸度等环境因子的影响,推测由于第2次翻曲过后曲醅水分、温度及酸度变化不大,对细菌群落结构影响不大,且经过前期的条件淘汰了部分不能耐受高温制曲条件的细菌,剩下的细菌能够耐受高温大曲的环境,这也是高温制曲的目的,为后期高温发酵筛选微生物。为揭示环境因子对优势细菌群落的影响,将14 个优势细菌属(平均相对丰度>1%)与发酵过程环境因子进行关联分析,结果如图5b所示,大曲优势细菌属(平均相对丰度>1%)受环境因子影响较大,Bacillus、Lactobacillus、Weissella、Pediococcus、Saccharopolyspora、Thermoactinomyces、Rhizobium、Oceanobacillus8 种优势菌群与大曲温度呈正相关,其中Bacillus、Lactobacillus、Weissella等菌属是酱香型白酒发酵过程中的主要功能微生物[29-33],从该层面也论证了酱香型白酒高温制曲的合理性。Thermoactinomyces、Tepidimicrobium、Pantoea、Rhizobium、Saccharopolyspora5 种菌属与大曲水分呈正相关,而Bacillus、Lactobacillus、Weissella等主要功能菌属则与大曲水分呈负相关,该结果表明机械化制曲发酵过程需控制水分不要太高,水分过高导致“烧曲”等异常情况发生,一方面又对Bacillus、Lactobacillus、Weissella等主要功能菌属生长造成不利影响。此外,Bacillus、Lactobacillus、Weissella等主要功能菌属与大曲酸度呈正相关,且Lactobacillus、Weissella等菌属也是大曲发酵过程产酸的主要细菌。以上结果表明,高温大曲发酵过程保持一个相对较高的温度及酸度,既有利于Bacillus、Lactobacillus、Weissella等主要功能菌属的生长,又能抑制不耐热、不耐酸杂菌的生长。
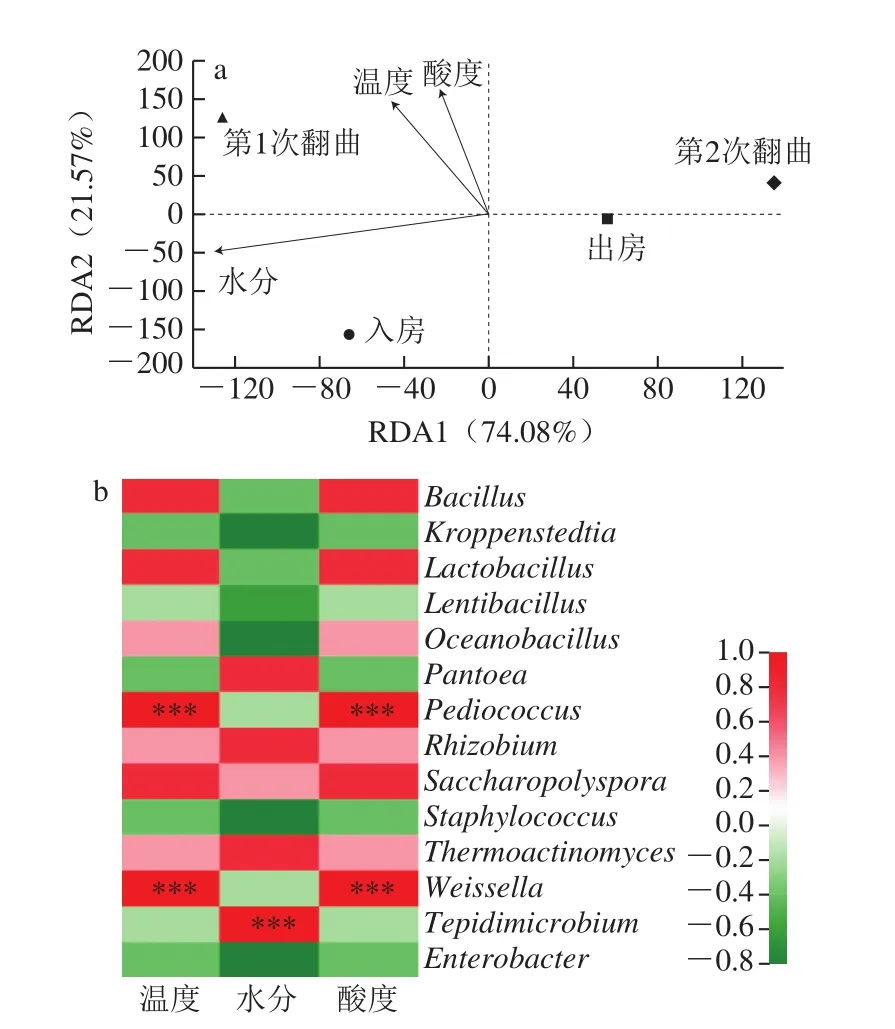
图5 发酵过程中细菌群落结构与大曲理化因子相关性分析Fig.5 Correlation between bacterial community structure and physicochemical properties of Daqu samples during fermentation
3 结 论
本研究应用高通量测序及数理分析方法对酱香型白酒机械化制曲发酵过程中的细菌菌群结构进行解析,从机械化制曲发酵过程中共检出9 个菌门,优势菌门为Firmicutes、Proteobacteria、Actinobacteria及Cyanobacteria,且随着发酵的进行,细菌门水平群落多样性降低,由多菌系生态结构演替为单一的厚壁菌门为主导的发酵模式。机械化制曲发酵过程中共检出84 个细菌属,稍高于传统制曲的82 个细菌属;机械化制曲发酵过程优势细菌属(至少在一个样品中相对丰度大于1%)共14 个,包括Pantoea、Rhizobium、Lactobacillus、Weissella、Bacillus、Oceanobacillus、Lentibacillus、Kroppenstedtia、Thermoactinomyces、Staphylococcus、Enterobacter、Saccharopolyspora、Pediococcus和Tepidimicrobium,其中Pediococcus和Tepidimicrobium是机械制曲发酵过程特有的优势细菌属,Leuconostoc及Pseudomonas是传统制曲过程特有的优势细菌属,表明机械化制曲与传统制曲过程优势菌具有较高的相似性。通过优势菌与环境因子相关性分析发现,主要功能细菌属Bacillus、Lactobacillus及Weissella都与大曲制曲温度呈正相关,与大曲酸度呈正相关,表明在机械化制曲过程中要合理科学控制相对较高的温度酸度,这样既有利于主要功能微生物的生长,又能抑制不耐热、不耐酸杂菌的繁殖。本研究为推进酱香型白酒机械化制曲发展提供了基础理论和学科依据。
本研究从发酵细菌群落结构上说明酱香型白酒的机械化制曲可以代替人工制曲,且与传统制曲相比,机械化制曲不仅在很大程度上提高了大曲质量稳定性及生产效率,大幅降低劳动强度及生产成本,还能避免工人在恶劣的环境下操作,有利于白酒行业的机械化与现代化发展。
