外源茉莉酸甲酯对盐胁迫下玉米幼苗AsA-GSH循环的影响*
2021-09-28杨双龙佟祎鑫张志华虞凡枫贾凌云
陈 芳 杨双龙 张 莉 佟祎鑫 张志华 虞凡枫 贾凌云**
(1 西北师范大学生命科学学院中心实验室 甘肃兰州 730070 2 云南师范大学生命科学学院生化实验室 云南昆明 650501)
土壤盐渍化对农业生产有极大滞碍作用,我国盐渍化土地的总面积约占全国可利用土地面积的4.88%(约1 亿hm2),且每年约有0.83%的农耕土地发生次盐渍化[1-2]。尤其是我国西部干旱荒漠地区,土地盐渍化尤为严重,对当地农业生产和生态环境造成了较为严重的损害。
玉米(Zea maysL.)作为一种喜温农作物,具有品质好、产量高、适应能力较强等特点[3],玉米的大量种植也是解决我国粮食问题的有效手段之一。近年来,随着我国农业技术的发展和种植方式的不断改进,玉米的栽培面积逐年地增加,玉米的产量和品质也有较大的提高,使我国玉米总的种植面积仅次于水稻(Oryza sativaL.)和小麦(Triticum aestivumL.),约为2 000 万hm2[4-5]。有研究表明,土壤盐渍化会导致玉米的产量严重受损[1-2],缓解盐胁迫对植物造成伤害的相关研究迫在眉睫。
茉莉酸甲酯(methyl jasmonat,MeJA)是一种普遍存在于植物体内的重要激素和信号分子,参与植物抗逆反应的众多调控过程[6-8]。已有研究表明,施加MeJA 能降低盐胁迫对植株造成的损伤,从而使其抵抗逆境的能力升高[6,9-10]。庞延军等[11]通过研究表明,一定质量浓度的外源MeJA 可使盐胁迫下水稻种子萌发率明显的提高。而Yoon等[12]研究发现,对盐胁迫下的大豆[Glycine max(Linn.)Merr.]外源施加MeJA,增加了其脯氨酸的含量,降低植株的光合速率,表明外源施加MeJA能减小盐胁迫对大豆造成的伤害。
已有研究证实,植物受到逆境胁迫时,其体内的抗氧化剂含量及抗氧化物酶的活性会发生相应的变化,以强化其抗氧化代谢循环的水平,优化植物活性氧的解毒体系,最终提高植物抵抗逆境的能力[13]。现有研究主要关注MeJA 对盐胁迫下水稻、大豆等植物抗氧化能力的影响,而对于玉米抗盐胁迫的相关研究较少。研究显示,外源MeJA 对于渗透胁迫下的玉米幼苗具有一定的调节作用[14],但外源MeJA 对盐胁迫下玉米幼苗的抗氧化能力影响的研究尚未见报道。本实验通过对短期盐胁迫下的玉米幼苗根系外源施加75 μmol/L MeJA,探究其对150 mmol/L NaCl 胁迫下玉米幼苗抗氧化能力的影响。
1 材料与方法
1.1 材料 本研究实验材料为“农星-207”玉米种子,选购于山东淄博公司。
1.2 材料及培养 选取“农星-207”玉米种子(籽粒饱满),用自来水清洗3~5 次,洗去包衣。用1.5%的CuSO4溶液(称取1.5 g CuSO4溶于100 mL蒸馏水)浸泡消毒10 min 后,再用蒸馏水冲洗2~3 次,浸泡24 h。将浸泡好的种子均匀播种至铺有6 层滤纸的白瓷盘上,用蒸馏水润湿后盖上盖子,期间连续补给适量蒸馏水,注意不能超过种子的2/3。置于温度为28℃培养箱中暗培养60 h,待种子萌发出芽并长至3~4 cm(胚芽鞘)高时,进行相应的处理。
玉米种子的处理参照杨双龙等[15]的方法。萌发60 h 后,将实验材料进行3 种处理:1)蒸馏水培养的对照组(CK);2)150 mmol/L NaCl 盐胁迫实验组(N);3)盐胁迫外施75 μmol/L MeJA 实验组(N+M)。处理前取样一次,以后各组每隔24 h 取一次样,共取5 次,每次实验取3 组样,每组实验取3 个重复。每个重复各称取玉米胚芽鞘0.1 g,装在2 mL 离心管中,经液氮速冻后,在-80℃冰箱保存。
1.3 测定指标及方法
1.3.1 氧化物质含量的测定 还原型谷胱甘肽(GSH)、氧化型谷胱甘肽(GSSG)、按还原型抗坏血酸(AsA)含量的测定按照购买的试剂盒(苏州科铭)说明书进行。
1.3.2 抗氧化酶活性测定 抗坏血酸过氧化物酶(APX)、脱氢抗坏血酸还原酶(DHAR)、单脱氢抗坏血酸还原酶(MDHAR)、谷胱甘肽还原酶(GR)活性的测定按照购买的试剂盒(苏州科铭)说明书进行。
1)APX 活性单位的定义:每分钟每克样本(鲜重)在25℃的条件下催化1 μmol AsA,即为1 个酶活力单位(1 U)。
2)DHAR 活性单位的定义:每分钟每克样本(鲜重)在25℃的条件下形成1 nmol AsA,即为1 个酶活力单位(1 U)。
3)MDHAR 活性单位的定义:每分钟每克样本(鲜重)在25℃的条件下催化1 nmol NADH,即为1 个酶活力单位(1 U)。
4)GR 活性单位的定义:每分钟每克样本(鲜重)在25℃、pH 值为8.0 的条件下氧化1 nmol NADPH,即为1 个酶活力单位(1 U)。
1.4 数据分析 将实验数据统计整理后,用SPSS 19.0 软件和Duncan 氏新复极差法进行多重比较分析数据,用GraphPad Prism8.4.3 进行图表绘制,图中以不同小写字母表明在P<0.05 水平上有显著性差异。
2 结果与分析
2.1 外源MeJA 对盐胁迫下玉米胚芽鞘AsA 含量的影响 由图1 可知,盐胁迫处理的实验组提高了AsA 的含量,24 h 时较对照升高了51.4%(P<0.01),96 h 时升高了42.2%(P<0.01),说明盐胁迫促使AsA 含量提高。盐胁迫下施加外源MeJA 处理进一步提高了AsA 含量,在处理24 h时相比对照增加56.9%(P<0.01),96 h 时增加了55.6%(P<0.01)。盐胁迫下MeJA 处理与单独的NaCl 胁迫处理相比,在24 h 时分别增加3.7%,96 h 时增加7.7%,表明盐胁迫组在施加外源MeJA后,玉米胚芽鞘中AsA 含量显著升高。
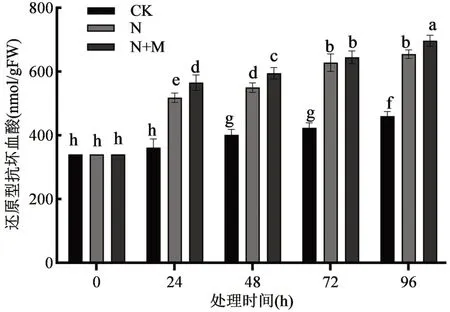
图1 外源MeJA 对盐胁迫下玉米胚芽鞘还原型抗坏血酸(AsA)含量的影响
2.2 外源MeJA 对盐胁迫下玉米胚芽鞘中AsA 代谢酶(APX、DHAR、MDHAR)活性的影响 由图2可知,与对照组相比,单独的盐胁迫处理下APX活性随胁迫时间的延长呈现升高趋势,在96 h 时其活性提高了71.0%(P<0.01)。盐胁迫下施加外源MeJA 处理,APX 活性也呈升高趋势,在处理96 h时其活性与对照组相比提高了91.0%(P<0.01),表明施加MeJA 促进了盐胁迫下玉米胚芽鞘中APX活性的提高。
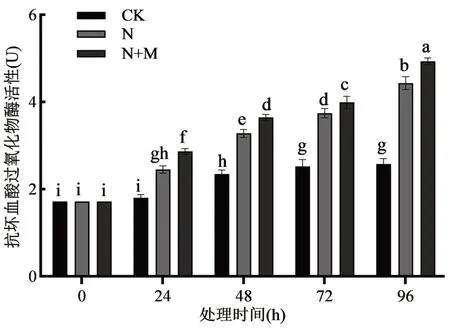
图2 外源MeJA 对盐胁迫下玉米胚芽鞘抗坏血酸过氧化物酶(APX)活性的影响
由图3 可知,在96 h 时单独的盐胁迫处理下,DHAR 活性提高,相比对照组提高了179.8%(P<0.01)。盐胁迫下施加MeJA 处理进一步提高了DHAR 活性,在处理96 h 时相比对照组提高了233.5%(P<0.01),相比单独的盐胁迫处理提高19.2%,表明75 μmol/L MeJA 处理促进了玉米胚芽鞘中DHAR 活性的提高。

图3 外源MeJA 对盐胁迫下玉米胚芽鞘脱氢抗坏血酸还原酶(DHAR)活性的影响
由图4 可知,单独的盐胁迫处理下MDHAR 活性显著提高,在96 h 时相比对照组提高了34.6%(P<0.01)。盐胁迫下施加外源MeJA 处理进一步提高了MDHAR 的活性,在处理96 h 时相比对照组提高了54.2%(P<0.01),相比单独的盐胁迫处理提高了14.6%,表明75 μmol/L MeJA 处理促进了玉米胚芽鞘中MDHAR 活性的提高。
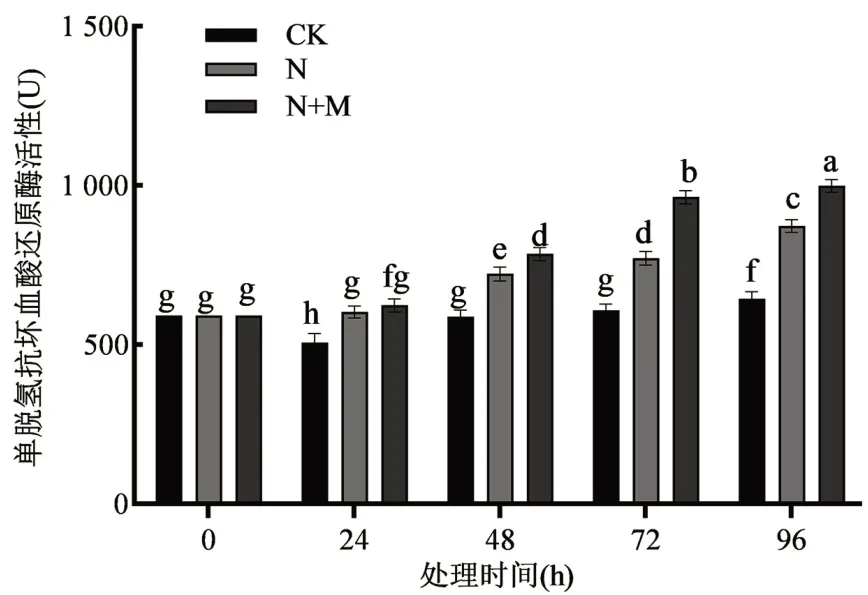
图4 外源MeJA 对盐胁迫下玉米胚芽鞘单脱氢抗坏血酸还原酶(MDHAR)活性的影响
2.3 MeJA 对盐胁迫下玉米胚芽鞘GSH 含量影响
由图5 可知,单独的盐胁迫处理相比对照组提高了GSH 的含量,在96 h 时升高了36.7%(P<0.01),说明盐胁迫促进了GSH 含量的提高。盐胁迫下施加外源MeJA 后进一步提升了GSH 含量,在96 h 时相比对照组增加了86.1%(P<0.01),表明外源施加MeJA处理促进了玉米胚芽鞘中GSH含量的提高。
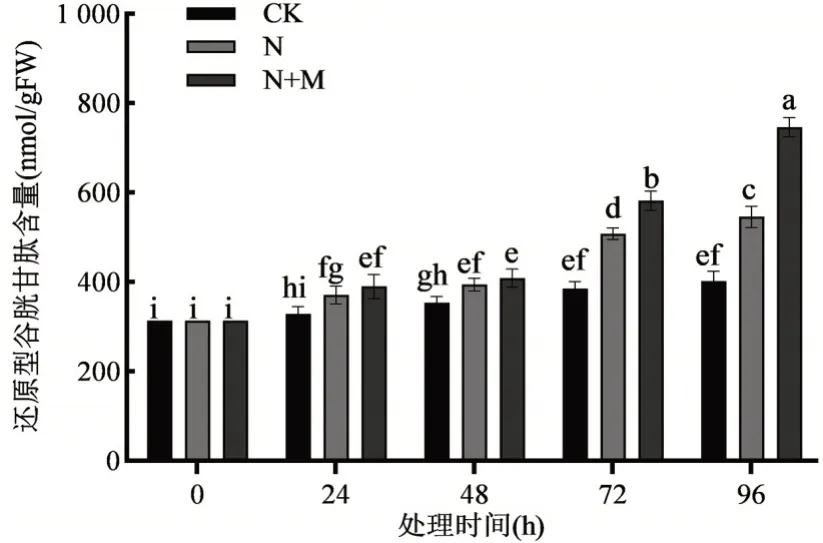
图5 外源MeJA 对盐胁迫下玉米胚芽鞘还原型谷胱甘肽(GSH)含量的影响
2.4 外源MeJA 对盐胁迫下玉米胚芽鞘GSH/GSSG 比值的影响 图6 显示,外源施加MeJA 能提高盐胁迫下玉米胚芽鞘GSH/GSSG 比值,在处理96 h 时,NaCl+MeJA 处理比单独NaCl 处理GSH/GSSG 比值提高了69.7%(P<0.01);同时,NaCl 处理和NaCl+MeJA 处理GSH/GSSG 比值分别比对照组提高了195.6%(P<0.01)和401.6%(P<0.01),表明外源施加75 μmol/L MeJA 处理下,玉米胚芽鞘细胞氧化还原力(GSH/GSSG)增强。

图6 外源MeJA 对盐胁迫下玉米胚芽鞘还原型谷胱甘肽含量与氧化型谷胱甘肽含量(GSH/GSSG)比值的影响
2.5 外源MeJA 对盐胁迫下玉米胚芽鞘中GSH 代谢酶(GR)活性的影响 由图7 可知,单独的NaCl胁迫处理的实验组,在处理96 h 时与对照相比,玉米胚芽鞘中GR 活性上升了31.7%(P<0.01)。与单独的NaCl 处理相比,在处理96 h 时,NaCl+MeJA处理下玉米胚芽鞘中GR 活性升高了13.6%(P<0.05),表明外源施加MeJA 能提高NaCl 胁迫下玉米胚芽鞘中GR 的活性。

图7 外源MeJA 对盐胁迫下玉米胚芽鞘谷胱甘肽还原酶(GR)活性的影响
3 讨论
盐胁迫会对植物细胞造成较严重的氧化胁迫伤害[16-17],而在维持植物细胞的氧化还原平衡中,AsA-GSH 循环具有十分重要的作用[16]。APX 催化AsA 将H2O2转化成H2O 和MDHA,MDHA 在MDHAR 的催化作用下转化成AsA 或进一步生成DHA,而DHA 在DHAR 的催化作用下以GSH 为底物生成AsA,与此同时GSH 氧化成GSSG,GSSG 又可在GR 的作用下还原为GSH[18-19]。
本实验研究表明,在人工模拟的150 mmol/L NaCl 盐胁迫下,外源施加75 μmol/L MeJA 提高了150 mmol/L NaCl 盐胁迫下玉米幼苗AsA-GSH 循环中抗氧化剂AsA、GSH 含量,GSH/GSSG 的比值及抗氧化酶APX、DHAR、MDHAR、GR 活性,从而促进玉米幼苗抗氧化能力的提高。
有研究显示,MeJA 可参与逆境胁迫下AsAGSH 循环的调节过程[20-22],但对于在盐胁迫下,MeJA 调控玉米幼苗中AsA-GSH 循环的机制目前尚不清楚。实验探究玉米幼苗中AsA、GSH 含量变化,GSH/GSSG 比值的变化及AsA-GSH 循环中关键酶活性的变化,旨在阐明MeJA 调控对盐胁迫下玉米幼苗中AsA-GSH 循环的机制的影响。
AsA 在植物细胞的抗氧化胁迫能力方面具有十分关键的作用,而APX、DHAR、MDHAR 及GR是AsA-GSH 循环过程中的关键酶[23-25]。通过研究发现,施加MeJA 促进了盐胁迫下玉米胚芽鞘中的AsA 含量,并提高了AsA 循环中关键酶APX、DHAR、MDHAR 活性,表明盐胁迫下对玉米幼苗外源施加MeJA 能提高AsA 含量,促使AsA 清除盐胁迫下玉米幼苗中产生的过量H2O2,从而缓解盐胁迫造成的损害。实验结果表明MeJA 提高了玉米胚芽鞘中MDHAR 和DHAR 的活性,加速了玉米幼苗中MDHA 和DHA 的转化,最终促使AsA 含量的增加,加速了AsA-GSH 循环。APX 活性的升高表明MeJA 加速了AsA 的转化,但相较于MDHAR 和DHAR 活性的增幅,APX 活性升高较小,说明可能存在另一种转化机制促使AsA 的转化或因玉米胚芽鞘中积累过多活性氧,导致APX 活性升高的比较缓慢。
GSH 含量是AsA-GSH 循环效率高低的重要指标之一[25-26],更为重要的是,植物细胞代谢过程中产生的活性氧(ROS)能在一定程度上被GSH 清除,从而减少由于膜脂过氧化作用对细胞造成严重伤害[27-28]。GSH/GSSG 比值是细胞内重要的氧化还原参数,表示细胞所处的氧化还原状态[11]。同时,本实验也发现150 mmol/L NaCl 胁迫使GSH含量升高,GSH/GSSG 的比值增大,而施加外源MeJA 进一步促使了玉米幼苗在盐胁迫下GSH 含量升高及GSH/GSSG 比值的升高。与单独盐胁迫处理的玉米胚芽鞘相比,外源施加75 μmol/L MeJA 进一步提高了玉米胚芽鞘中AsA-GSH 循环中GR 的活性。GSH 含量升高,GSSG 含量下降,GR 活性升高,表明GSH 含量的增加主要是GSH生成量的增加;GR 活性升高,表明GSH 循环的加速,从另一方面也表明AsA 含量的增加一部分来自于GSH 循环。
综上所述,在150 mmol/L NaCl 盐胁迫条件下,外源施加MeJA 提高了玉米幼苗AsA-GSH 循环中抗氧化剂AsA、GSH 含量及抗氧化酶APX、DHAR、MDHAR、GR 活性,加速了对活性氧的清除,从而促进玉米幼苗抗氧化能力的提高。这些结果为深入研究盐胁迫下MeJA 调控植物抗氧化代谢提供了新的思路,也有助于探明盐胁迫下植物维持细胞氧化还原平衡的机理。因条件限制,本实验未从玉米胚芽鞘的质膜通透性、抗氧化酶活性等其他耐盐生理生化指标方面做进一步探究,期待其他有兴趣的研究者能进行深入研究。
