小麦麦麸阿拉伯木聚糖的体外降脂作用研究
2021-09-27张修威袁婷婷牛猛张宾佳贾才华许燕赵思明
张修威,袁婷婷,牛猛,张宾佳,贾才华,许燕, 赵思明
华中农业大学食品科学技术学院,武汉 430070
随着人们生活水平的不断提高和日常摄入高脂饮食比例的增加,肥胖人群所占的比例逐渐增大,与其相关疾病的发病率也在随之升高[1]。肥胖被普遍认为是心血管疾病、高血脂等病症的主要诱发因素[2]。脂肪摄入与吸收量和脂肪酶活性是影响脂质代谢的重要因素。前期研究表明[3],减少脂肪吸收量与抑制脂肪酶活性是干预和预防肥胖的重要途径。食物组分通过结合体内胆酸盐能够促进血液中胆固醇的代谢,从而起到控制血脂水平的作用;抑制脂肪酶的活性可以减少食物中甘油三酯的水解从而降低胆固醇的产生,达到控制血脂的目的。
阿拉伯木聚糖(arabinoxylan,AX)是一种广泛存在于谷物中的多糖,是谷物细胞壁的重要组成部分。小麦是我国的主要农作物之一,每年小麦加工所产生的副产品中麦麸占了绝大部分[4]。麦麸中AX的含量可达25%左右[5]。根据AX溶解性的不同可分为水溶性AX(water-extractable arabinoxylan,WEAX)和水不溶性AX(water-unextractable arabinoxylan,WUAX)。在小麦中,WEAX占AX总量的25%~30%,具有高黏性。剩余的AX为WUAX,具有较高的持水能力[6]。AX作为一种重要的膳食纤维,具有调节肠道菌群、控制血糖水平、降血脂[7]、调节代谢、抗氧化活性[8]等生理功能。
已有研究[9-12]表眀,麦麸AX具有调节血脂代谢的作用,补充AX可以改善餐后血脂水平和降低体内总胆固醇水平、抵消高脂饮食引起的肠道环境紊乱、预防肥胖症状和减轻体质量。目前关于AX调节血脂代谢的机制尚不明确,对不同类型的AX如WUAX和WEAX降脂活性的研究鲜见报道。本研究以小麦麦麸WUAX和WEAX为研究对象,探究2种AX的胆酸盐结合力和胰脂肪酶抑制活性,阐释AX结构对其降脂作用的影响,为植物多糖调节血脂代谢机制的研究提供参考。
1 材料与方法
1.1 材料与试剂
全麦粉,购于河南省大程粮油集团股份有限公司;牛磺胆酸钠(sodium taurocholate hydrate,STC)、甘氨胆酸钠盐(sodium glycocholate hydrate,SGC)、胰脂肪酶(猪)(9001-62-1,30 000 U/g)、碱性蛋白酶(9014-01-1,200 U/mg)和高温α-淀粉酶(9001-19-8,20 000 U/mL)均购于上海源叶生物科技有限公司;淀粉葡萄糖苷酶(9032-08-0,70 U/mg)购于阿拉丁生化科技股份有限公司;地衣聚糖酶(N/A,5 000 U/mL)购于爱尔兰Megazyme公司。以上试剂为分析纯。
1.2 仪器与设备
HH-4恒温水浴锅,RE-52AA旋转蒸发器,DF-101S恒温加热磁力搅拌器,BSA124S分析天平,SF-TDL-5A离心机,FD-1-50冷冻干燥机,722N可见-分光光度计,Thermo Multiskan Go全自动酶标仪。
1.3 WEAX和WUAX的提取
1)粗AX提取。将全麦粉过筛(孔径0.15 mm)得到麦麸,将麦麸在4 ℃下用蒸馏水浸泡1 h,随后将湿润的麦麸用蒸馏水洗涤多次,进一步去除残留的小麦粉。将洗涤后的湿麦麸置于50 ℃烘箱12 h,称取烘干的麦麸150 g与2.25 L 0.15 mol/L NaOH溶液(包括0.5% H2O2)在80 ℃下反应90 min后离心(4 000 r/min,30 min),将上清液调整至pH值为4.5后同样条件再次离心。蒸发浓缩上清液至原体积的1/4左右后使用乙醇沉淀(乙醇最终体积分数为65%),离心(4 000 r/min,30 min)后得到上清液。
2)WUAX提取。在上清液中加入碱性蛋白酶以去除蛋白,40 ℃水浴40 min,然后煮沸灭酶,使用透析袋(孔径0.1 nm)将上清液用去离子水透析72 h,冷冻干燥得到WUAX。
3)WEAX提取。在上清液加入Sevage试剂(氯仿∶正丁醇=4 ∶ 1,V/V)至所占比例为20%,剧烈振荡1 h,离心收集水层,重复5~6次。然后将水层冷冻干燥得到粗多糖,将其溶于去离子水,加入高温α-淀粉酶,95 ℃水浴反应2 h,煮沸15 min灭活后冷却至室温,再加入淀粉葡萄糖苷酶,在55 ℃下反应4 h,煮沸30 min,使酶失活后,离心(4 000 r/min,15 min),使用透析袋(孔径0.1 nm)将上清液用去离子水透析36 h,冷冻干燥得到一次酶解多糖。将一次酶解多糖配制成1 L质量分数0.5%的溶液,加入地衣聚糖酶,40 ℃水浴反应1 h;煮沸10 min灭酶后,离心(4 000 r/min,30 min),上清液经过透析袋(孔径0.1 nm)透析36 h,冷冻干燥最终得到WEAX[13]。
1.4 胆酸盐结合力测定
1)胆酸盐标准曲线。参考周小理等[14]的研究方法并稍做改动,分别移取0.6、0.7、0.8、0.9、1.0 mL的1 mmol/L STC和SGC标准溶液置于10 mL的具塞试管中,在620 nm波长处测定胆酸盐溶液吸光值,绘制标准曲线。
由图1可知,STC的标准曲线是y=0.73949x+0.00123,相关系数R2=0.999 66,SGC的标准曲线是y=0.70016x+0.03825,相关系数R2=0.997 84,二者均具有良好线性关系。
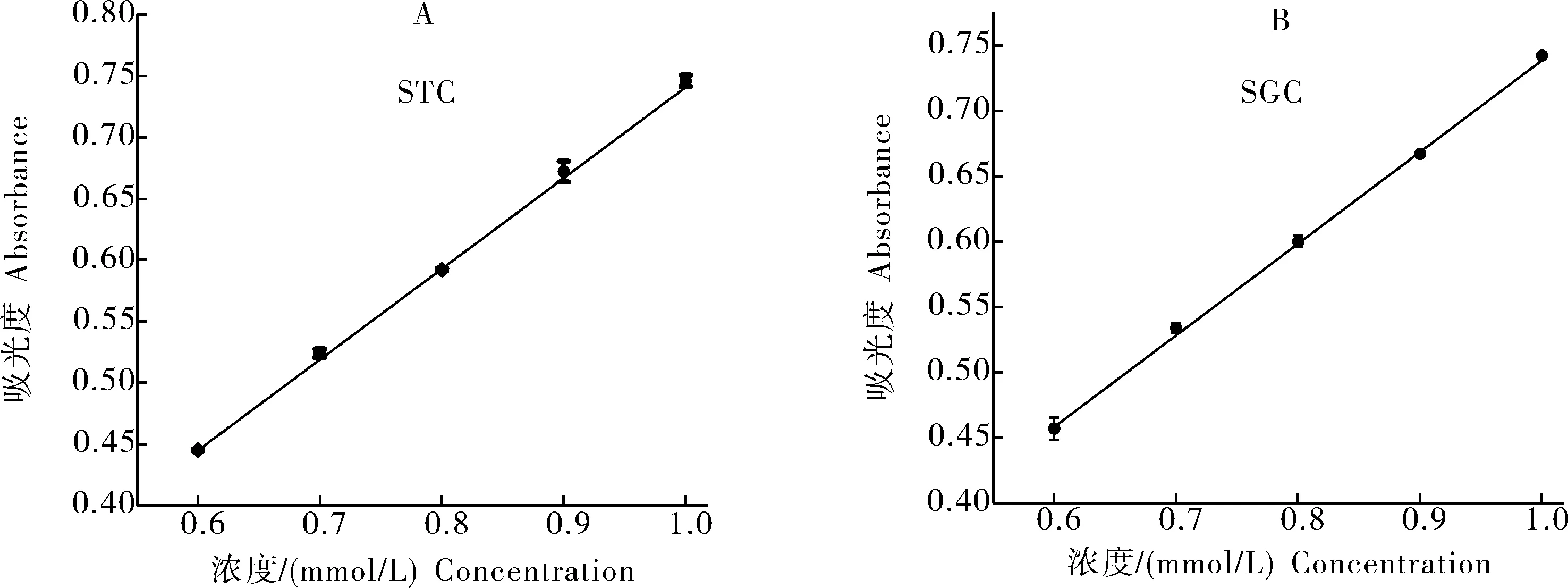
图1 胆酸盐标准曲线Fig.1 The standard curve of cholate
2)WUAX和WEAX胆酸盐结合率的测定。分别称取250、375、500、625、750 mg WEAX和WUAX置于50 mL的具塞试管中,加入5 mL的蒸馏水,放入37 ℃的摇床中,振荡1 h充分混匀,加入10 mL的1 mmol/L的STC和SGC溶液,振荡混匀,37 ℃下水浴1 h,离心(4 000 r/min,30 min),收集上清液。利用标准曲线计算未吸附胆酸盐的含量,从而得到胆酸盐结合率。
3)反应时间对胆酸盐结合量的影响。反应时间分别设置为20、30、40、60、90和120 min,称取500 mg的AX,按照本文“1.4 2)”的步骤测定未吸附胆酸盐的含量,根据胆酸盐结合率的高低,得出最佳反应时间。
4)AX添加量对胆酸盐结合量的影响。分别称取250、375、500、625、750 mg的AX,依照本文“1.4 3)”得出的最佳反应时间,再按照本文“1.4 2)”的步骤测定未吸附胆酸盐的量,根据胆酸盐结合量的大小,得出最适AX添加量。
5)胆酸盐的等温吸附曲线。根据之前试验结果分别得出最佳反应时间和最适AX添加量,分别加入浓度为0.50、0.75、1.00、1.25、1.50 mmol/L的胆酸盐溶液,按照本文“1.4 2)”的步骤计算胆酸盐结合量,绘制等温吸附曲线。
对于吸附等温线用Freundlich方程进行拟合作图,公式(1)如下:
(1)
式(1)中,Qe为平衡结合量,mg/g;Ce为平衡浓度;n为特征常数;Kf为平衡吸附常数。
1.5 胰脂肪酶活性抑制率测定方法
根据黄琳翔等[15]的方法,配制Tris-HCl缓冲液、胰脂肪酶溶液和4-硝基苯棕榈酸酯(PNPP)溶液。向96孔板中加入胰脂肪酶和缓冲液或AX样品,37 ℃下反应30 min,添加PNPP,37 ℃下反应5 min,采用酶标仪每隔1 min测定1次吸光度,共测定20次。绘制“吸光度-时间”曲线,曲线的斜率即抑制胰脂肪酶的反应速率,胰脂肪酶抑制率计算公式如下:
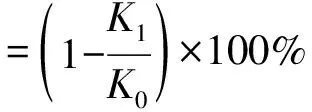
(2)
式(2)中,K0为空白组的斜率,K1为样品组的斜率。
1)WUAX和WEAX对胰脂肪酶抑制率测定。分别选取质量浓度为5、10、20、30、40 mg/mL的WUAX和WEAX,PNPP溶液的质量浓度为2.5 mg/mL,胰脂肪酶的质量浓度为100 mg/mL按照表1的添加量和顺序加入到96孔板,在37 ℃下反应30 min,每隔1 min测定1次吸光度,共测20次,每个编号每种质量浓度均做3次平行。
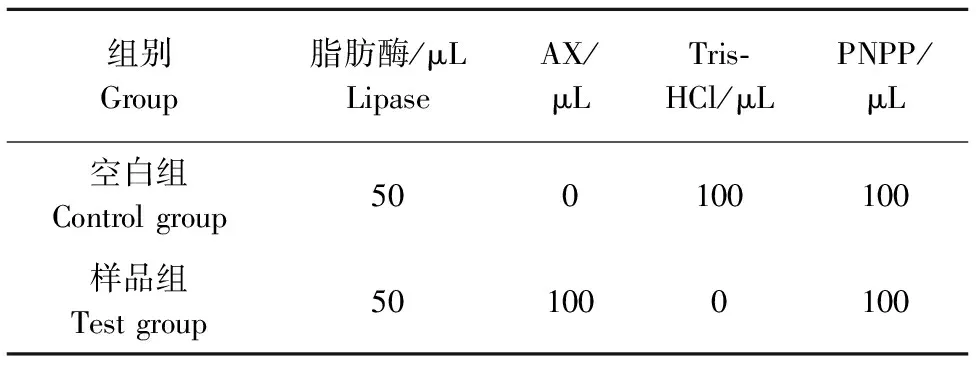
表1 各物质添加量 Table 1 Addition amount of each substance
2)AX对胰脂肪酶的抑制可逆性分析。设置胰脂肪酶的质量浓度分别为50、75、100、125、150 mg/mL,AX质量浓度设定为5、30 mg/mL,按照本文“1.5 1)”的步骤测定反应速率,绘制胰脂肪酶反应速率-胰脂肪酶质量浓度曲线及拟合方程。
3)AX对胰脂肪酶的抑制作用类型分析。PNPP的质量浓度分别设置为1.25、2.50、3.75、5.00 mg/mL,AX质量浓度设定为5、30 mg/mL。通过Lineweaver-Burk双倒数方程绘制曲线并拟合,从而得到胰脂肪酶抑制类型,公式如下:
(3)
式(3)中,v为胰脂肪酶酶反应速率,A/min;vmax为最大反应速率,1/min;Km表示米氏常数;[I]为AX质量浓度,mg/mL;[S]为PNPP质量浓度,mg/mL。
1.6 数据分析
所有指标的测试平行实验不少于3次,使用SPSS 22.0计算平均值和标准差,通过单因素方差分析和多重比较对数据进行显著性分析,当P<0.05时判定数据间具有显著性差异。
2 结果与分析
2.1 AX体外胆酸盐结合力分析
1)WUAX与WEAX的胆酸盐结合率。由图2可看出,WEAX对STC和SGC的结合率低于15%。当WEAX质量浓度低于100 mg/mL时,结合率随质量浓度的增加而增大,且具有显著性差异(P<0.05);当WEAX质量浓度高于100 mg/mL时,结合率变化趋于平缓,无显著性差异(P>0.05)。WUAX对STC和SGC的结合率显著高于WEAX,结合率随着WUAX质量浓度增加而增大,具有显著性差异(P<0.05),当WUAX质量浓度为150 mg/mL时,对STC和SGC的结合率分别达到52.87%和38.30%。
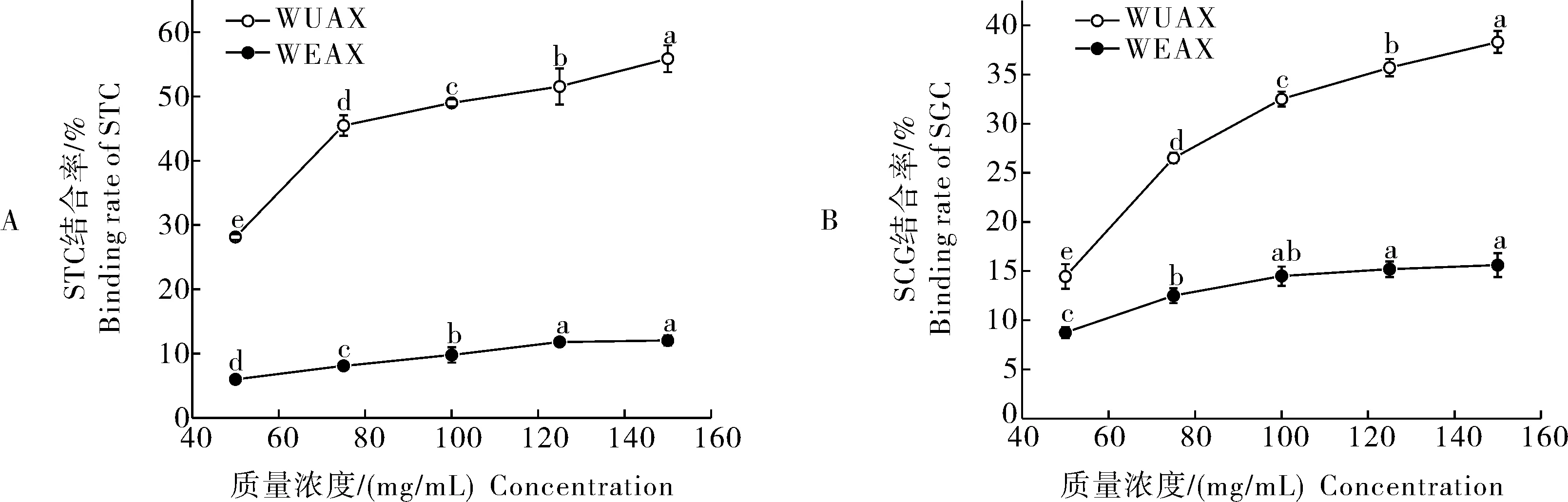
同一曲线中不同字母表示具有显著性差异,P<0.05,n=3,下同。Different letters in the same curve indicate significant differences,P<0.05,n=3,the same as below.
2)WUAX对胆酸盐的吸附动力学分析。由图3所示,在0~40 min内WUAX对STC的结合率随反应时间延长而增加,具有显著性差异(P<0.05),在40 min后结合率变化趋势无显著性变化(P>0.05)。在0~90 min内,WUAX对SGC的结合率随反应时间的延长而增加,具有显著差异(P<0.05),在90 min后,结合率变化趋于平缓。在40 min时,WUAX对STC的结合率为49.50%。在 90 min时,WUAX对SGC的结合率为32.33%。
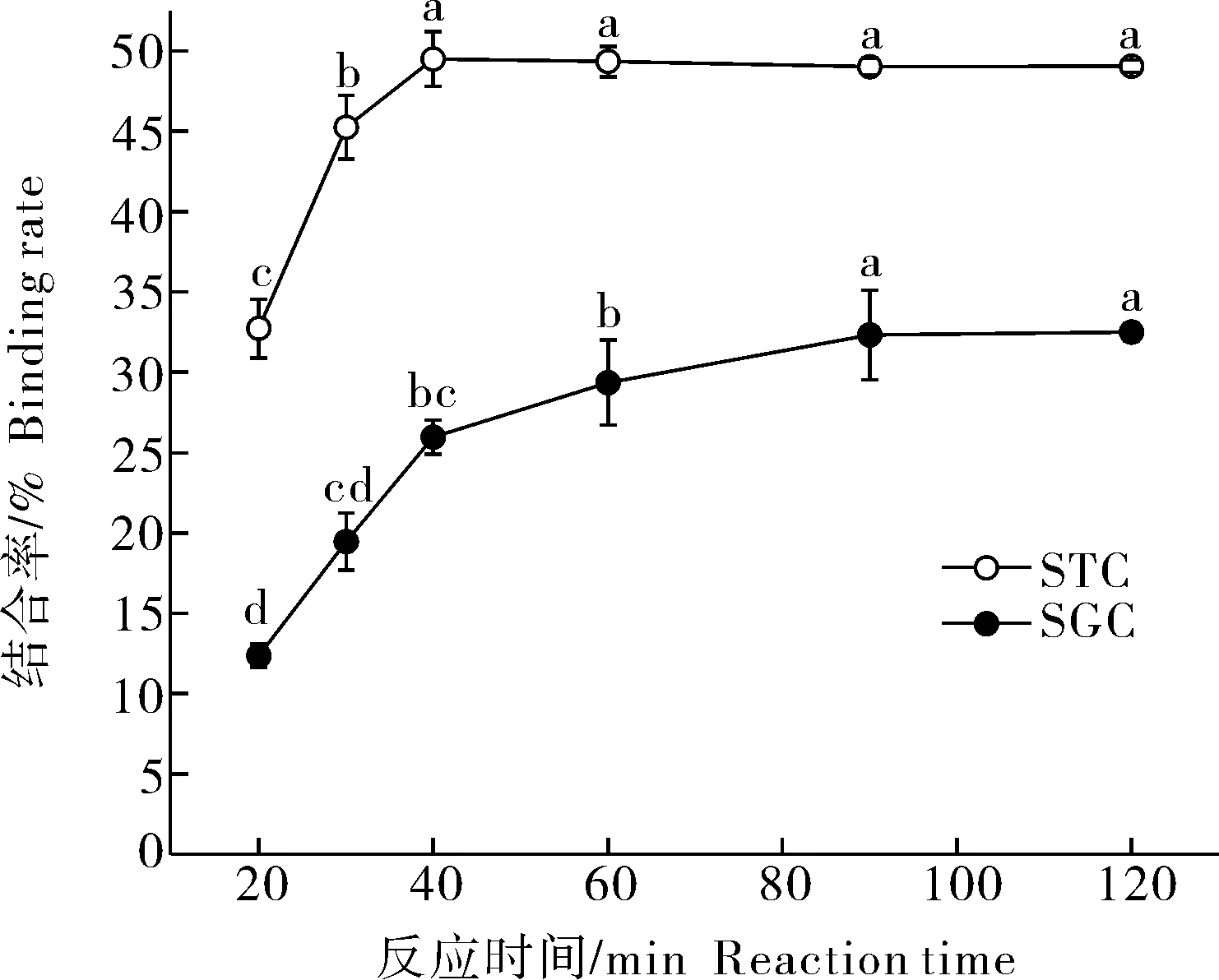
图3 WUAX对胆酸盐的吸附动力学曲线Fig.3 Adsorption kinetics of WUAX to cholate
3)WUAX添加量对胆酸盐结合量的影响。分别选取40 min和90 min为WUAX对STC和SGC的结合时间,进行胆酸盐结合量测定。由图4可知,当WUAX添加量低于375 mg时,对胆酸盐的结合量随其添加量的增加而增加,当WUAX添加量高于375 mg时,胆酸盐的结合量呈现下降的趋势。当WUAX添加量为375 mg时,对STC和SGC的结合量最大,分别为6.12、3.45 mg/g。
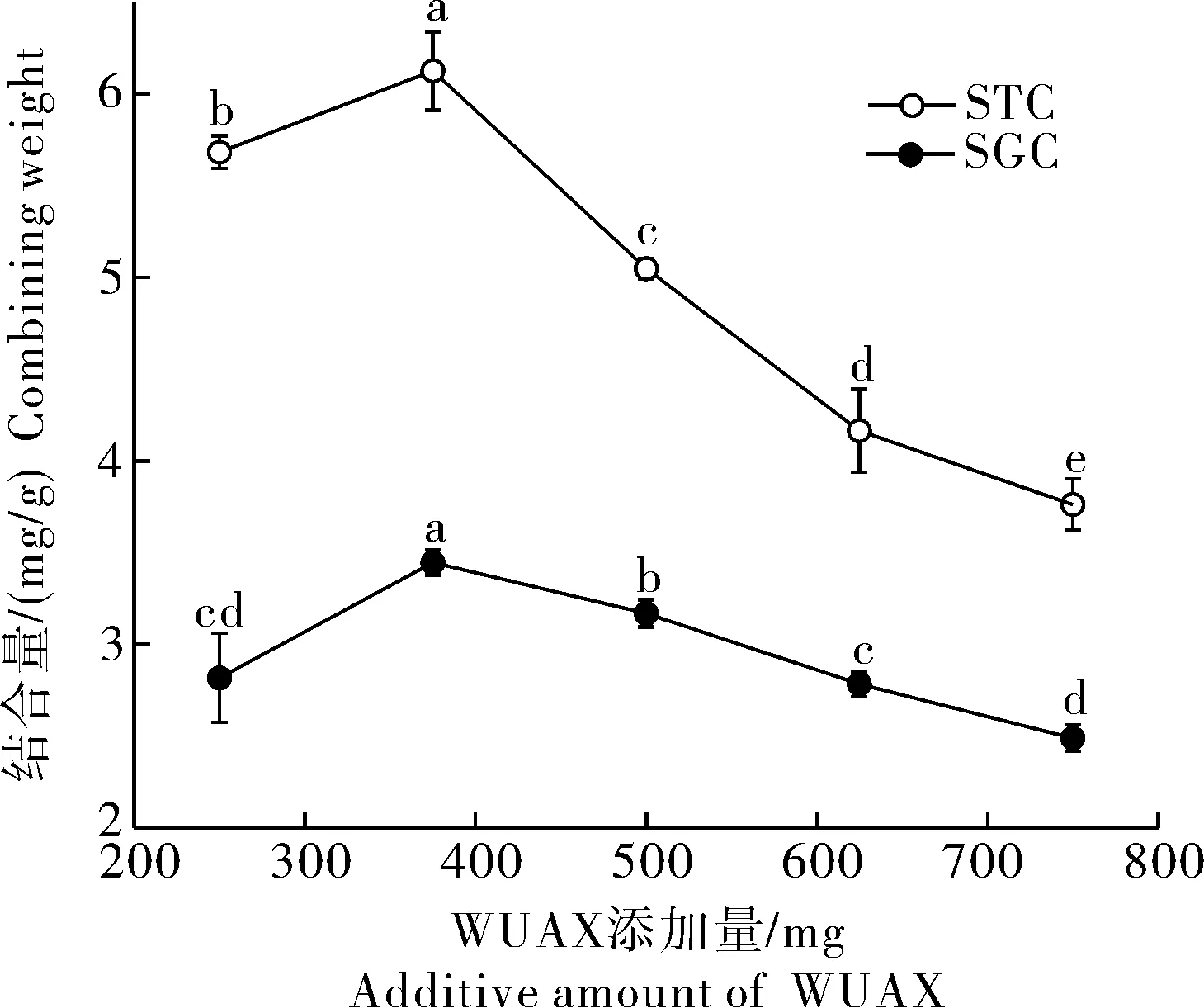
图4 WUAX添加量对胆酸盐结合量的影响Fig.4 Effect of WUAX supplemental level on cholate binding amount
4)WUAX对胆酸盐的等温吸附曲线及拟合方程分析。选取WUAX添加量为375 mg进行胆酸盐等温吸附曲线测定。由图5可知,随着胆酸盐浓度的升高,WUAX对胆酸盐的结合量逐渐增加,结合速率呈先增加后减缓的趋势。WUAX对STC的结合量高于SGC。
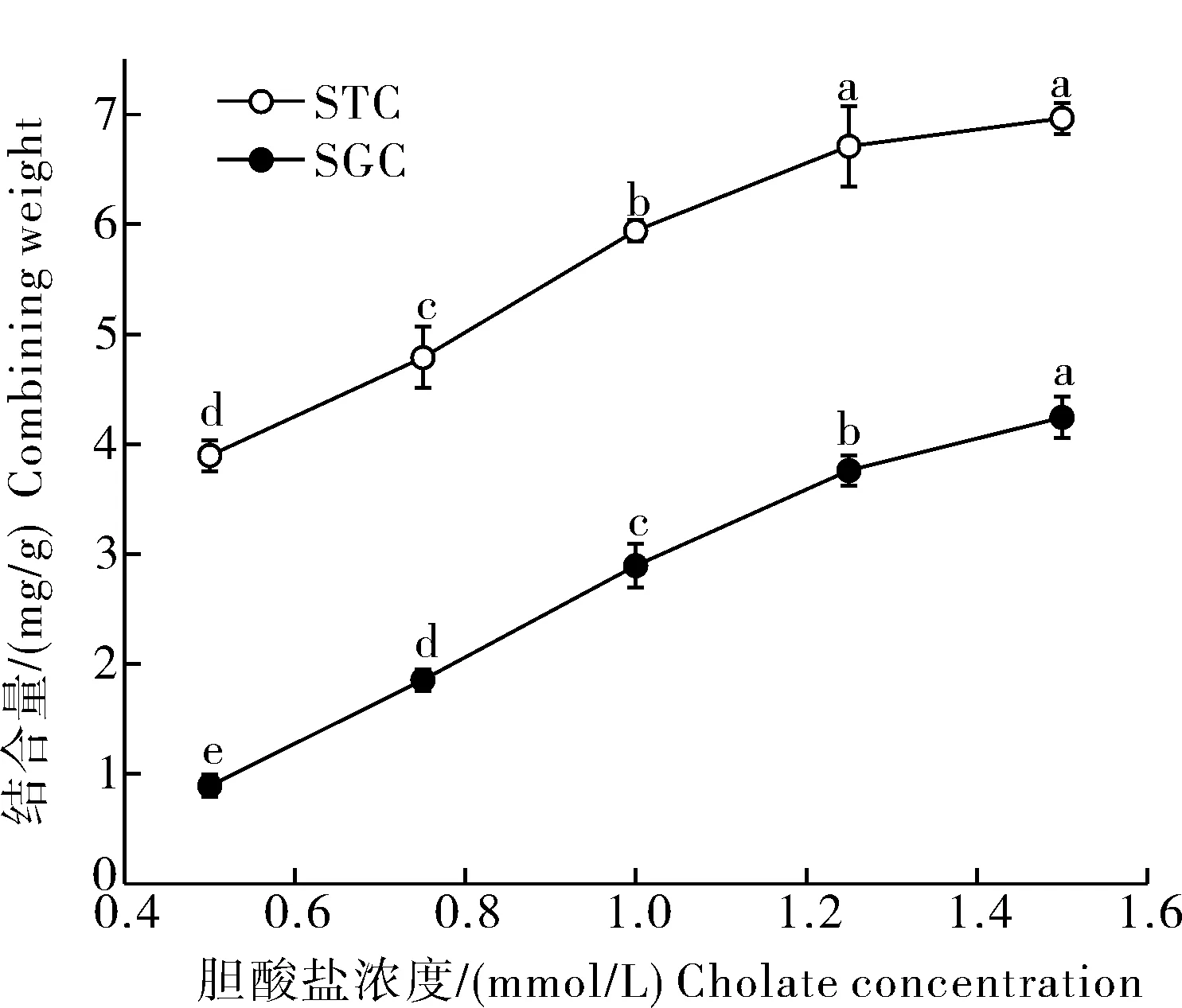
图5 WUAX对胆酸盐等温吸附曲线Fig.5 Isothermal adsorption curve of WUAX for cholate
如图6所示,WUAX结合STC的拟合方程为lnQe=0.51lnCe+1.7567,结合SGC的拟合方程为lnQe=1.31lnCe+0.9883。
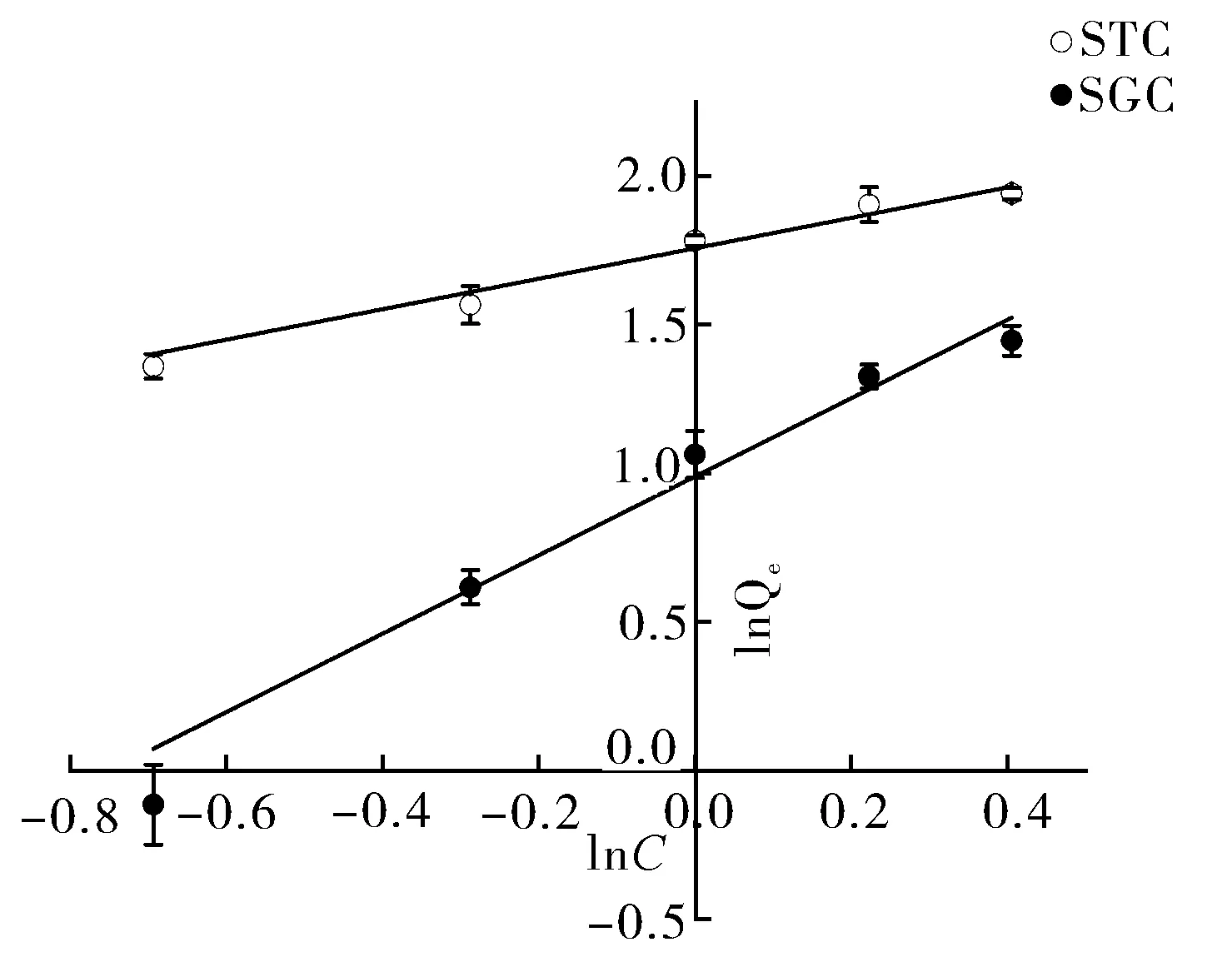
图6 WUAX对胆酸盐的等温吸附拟合曲线Fig.6 Isothermal adsorption fitting curve of WUAX for cholate
2.2 AX体外抑制胰脂肪酶活性评价
1)WEAX和WUAX对胰脂肪酶活性的抑制。由图7可知,当WUAX质量浓度大于5 mg/mL时,对胰脂肪酶的抑制率变化趋于平缓,无显著性差异(P>0.05),当 WUAX质量浓度为30 mg/mL时,抑制率为18.30%。WEAX对胰脂肪酶的抑制率随着质量浓度增加而增加,具有显著性差异(P<0.05),当WEAX质量浓度为30 mg/mL时,对胰脂肪酶抑制率为35.66%。WEAX对胰脂肪酶的抑制能力高于WUAX。
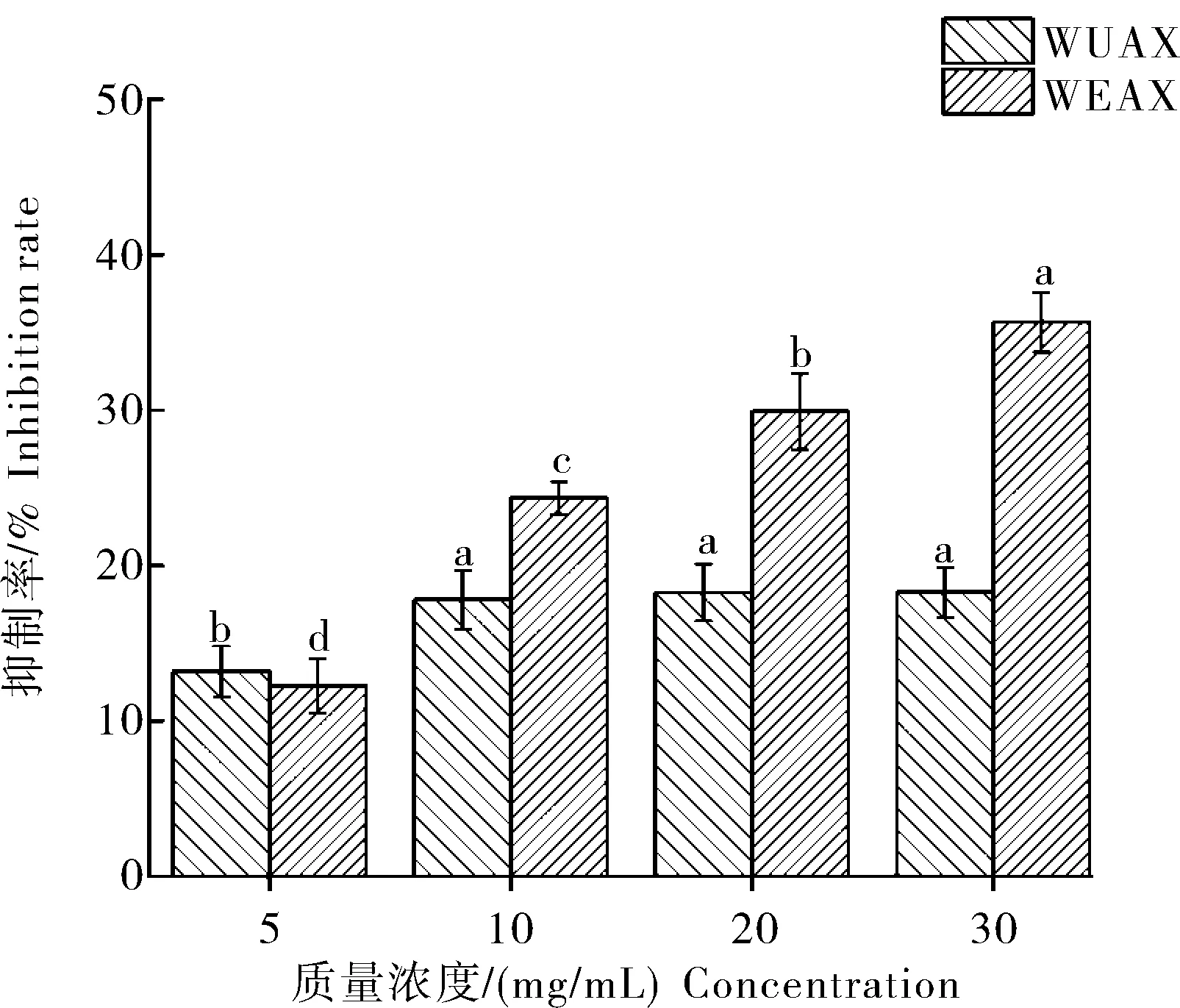
图7 WUAX和WEAX对胰脂肪酶的抑制率Fig.7 Pancreatic lipase inhibition rates of WUAX and WEAX
如图8所示,当WEAX质量浓度低于30 mg/mL时,随着质量浓度的增加,其对胰脂肪酶的抑制率也随之增加。当WEAX的质量浓度高于30 mg/mL时,其对胰脂肪酶的抑制率变化趋于平缓。当WEAX质量浓度为30 mg/mL时,对胰脂肪酶的抑制率达35.93%。
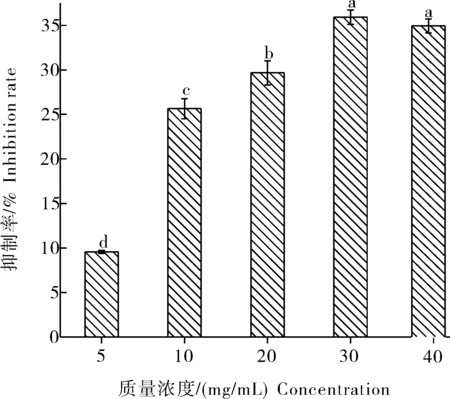
图8 WEAX质量浓度对胰脂肪酶的抑制率Fig.8 Inhibition rate of pancreatic lipaseby WEAX concentration
2)WEAX对胰脂肪酶抑制可逆性分析。由图9可知,WEAX质量浓度在5 mg/mL和30 mg/mL时,拟合曲线交于原点,故WEAX对胰脂肪酶的抑制是可逆性抑制,随着WEAX质量浓度的增加,其斜率降低,并且反应速率曲线都通过坐标原点。
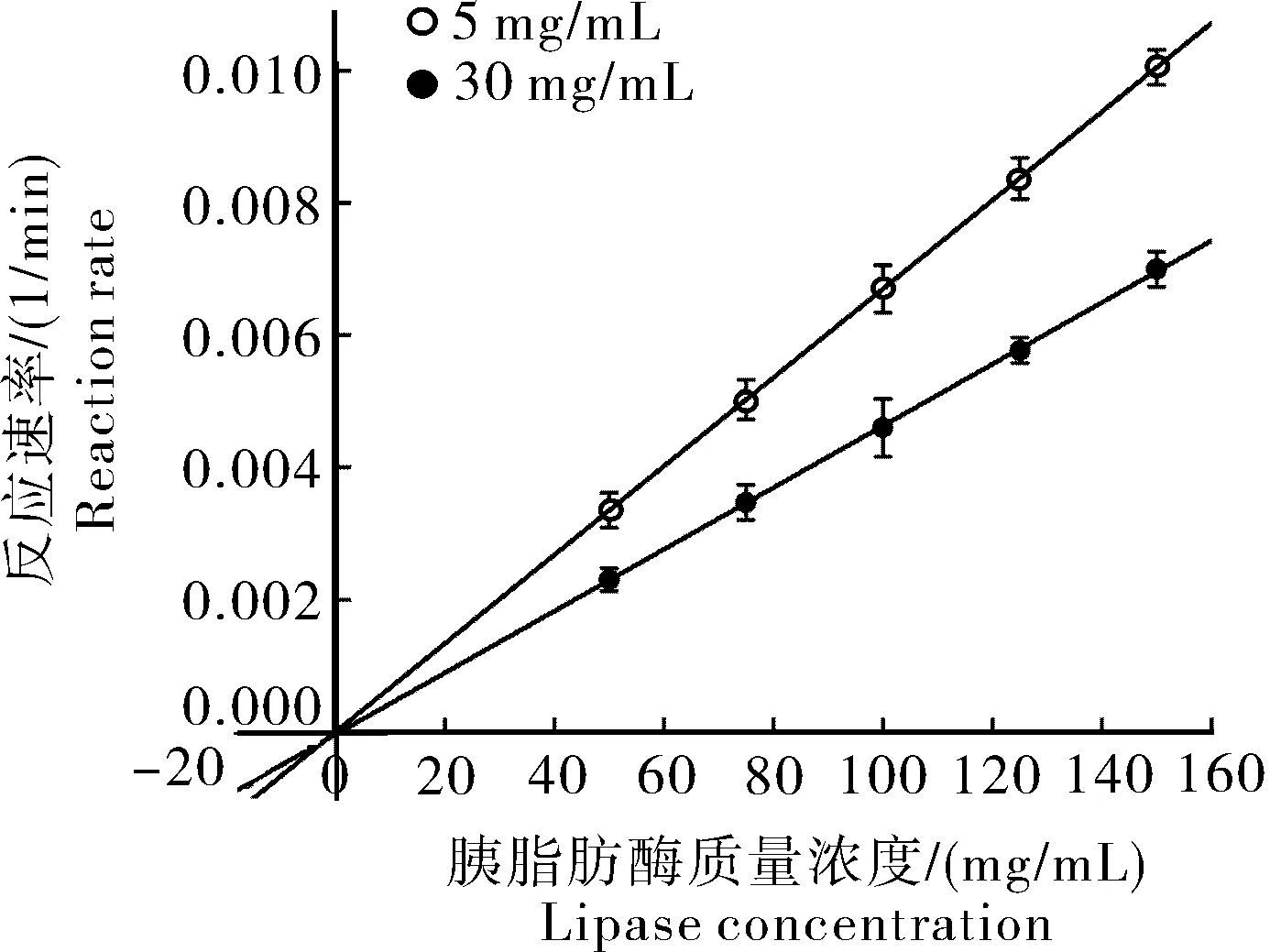
图9 WEAX对胰脂肪酶抑制的可逆性Fig.9 Reversibility of pancreaticlipase induced by WEAX
3)WEAX对胰脂肪酶的抑制类型分析。由图10可知,随着WEAX的质量浓度从5 mg/mL增加至30 mg/mL,拟合曲线的斜率增大,即1/v增大,vmax减小,在横坐标的截距也随之增大,即Km增大。拟合后2条拟合曲线交于第二象限,说明WEAX对胰脂肪酶的抑制类型是混合型抑制。
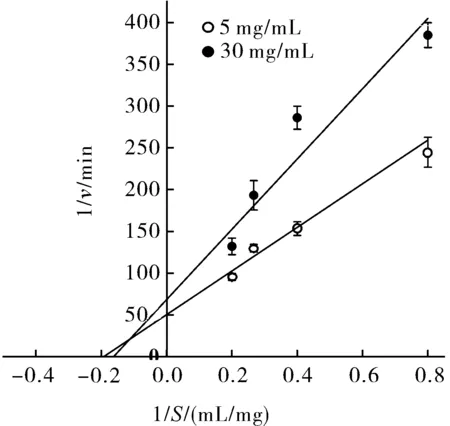
图10 WEAX对胰脂肪酶的Lineweaver- Burk方程拟合曲线Fig.10 Lineweaver-Burk equation fitting curveof pancreatic lipase by WEAX
3 讨 论
本研究以小麦麦麸WUAX和WEAX为对象,研究了2种具有不同结构特性的AX对胆酸盐的结合力和胰脂肪酶抑制活性。结合胆酸盐实验结果表明,WUAX结合胆酸盐的能力强于WEAX。Lin等[16]研究发现胆酸盐结合力会随着其中不溶性纤维含量的增多而升高,这可能是WUAX对STC和SGC的结合力高于WEAX的原因。WUAX对STC结合率和结合量大于SGC,与段振等[17]研究结果相同。相较于SGC侧链上的甘氨酸羧基,STC侧链基团的磺酸基的极性更强,更容易暴露结合位点,在不聚集的状态下更易被多糖结合[18-19]。WUAX对胆酸盐的结合量随其添加量的增加而增加,当添加量为375 mg时,胆酸盐结合量最大。刘荣等[20]研究表明水溶性黑木耳多糖对胆酸盐的结合量会随着多糖添加量的增加而达到峰值,与本试验结果相似。此时溶液中的WUAX达到饱和,当添加量继续增大时会因为WUAX的黏度增大而使得其结合量下降[21]。WUAX对STC的结合量高于SGC,这与纪秀凤等[22]对于红树莓籽花青素结合胆酸盐的实验结果相似。WUAX的等温吸附曲线拟合方程的相关系数R2分别是0.971 2和0.972 4,说明拟合方程具有线性关系,符合Freundlich方程。在Freundlich方程中,1/n代表浓度或添加量对结合量影响的强弱,1/n越小,结合性能越好。当0.1<1/n≤0.5时,代表容易结合;当0.5<1/n≤1时,表明不易结合;当1/n>1时,表明结合困难。WUAX对STC和SGC拟合方程的1/n分别为0.51和1.31,说明相对于SGC,WUAX较易与STC结合[23]。
胰脂肪酶抑制活性实验结果表明:WEAX对胰脂肪酶的抑制能力高于WUAX,这可能因为WEAX所形成的高黏性溶液能更有效降低胰脂肪酶的活性[6]。WEAX对胰脂肪酶的抑制率随着质量浓度增加先升高后趋于平缓,黄琳翔等[15]和周巧杰等[24]试验结果中胰脂肪酶抑制率变化与本研究一致,原因可能是WEAX与胰脂肪酶的结合达到饱和状态使得抑制率趋于平缓。根据酶和抑制剂的结合特性,可分为可逆性抑制和不可逆性抑制,酶反应速率曲线经过原点的为可逆性抑制,不经过原点的是不可逆性抑制[25]。WEAX对胰脂肪酶是可逆性抑制,与酶结合是通过非共价键的形式,从而影响酶的活性[26]。酶的反应速率曲线变化趋势及交点与于洋君等[27]和张静等[28]研究可逆性抑制结果一致。Lineweaver-Burk方程拟合曲线结果表明WEAX对胰脂肪酶的抑制类型是混合型抑制。Liu 等[26]研究了红米多酚对胰脂肪酶活性的抑制,结果表明抑制类型为混合型抑制,与本研究得出的抑制类型相符合。混合型抑制即WEAX作为酶抑制剂,既可以与游离的酶反应,又可以与酶和底物的复合物反应,从而抑制胰脂肪酶的活性[29]。
综上所述,WUAX对胆酸盐的结合力显著高于WEAX,而WEAX对胰脂肪酶抑制活性高于WUAX。这些体外降脂作用的差异与2种AX的结构特性不同有关。基于此,笔者所在课题组后续将进一步对AX结构与降脂作用的关系进行研究,为AX降脂机制的探究提供参考。
